Одной из актуальных проблем современной кардиологии остается своевременный прогноз электрической нестабильности миокарда, который является ключевым при прогнозировании развития потенциально опасных аритмий. Внедрение компьютерных технологий, современных методов цифровой обработки ЭКГ-сигнала обусловило разработку и все более широкое использование в повседневной клинической практике компьютерных ЭКГ-систем.
Современное развитие компьютерных технологий дало возможность проводить анализ ЭКГ-сигнала на качественно более высоком уровне, что открыло новые возможности в диагностике кардиологической патологии. Особенно актуально это при выявлении электрической нестабильности миокарда, диагностике угрожающих для жизни нарушений ритма и риска внезапной сердечной смерти. Данные проспективных исследований показали, что за последние два десятилетия общая частота внезапной сердечной смерти, несмотря на применение новых методов диагностики и профилактики, существенно не изменилась и составляет приблизительно 20–25% всех случаев «острых сердечных приступов». В абсолютном большинстве случаев механизмом возникновения внезапной сердечной смерти является развитие желудочковых тахиаритмий. Проблема внезапной сердечной смерти осложняется еще и тем, что летальные аритмии могут возникать при отсутствии острой ишемии и выраженных функциональных и анатомических изменений, хотя часто сочетаются с ними. Выделение предикторов электрической нестабильности миокарда, разработка способов выявления групп больных с высоким риском аритмических событий — основные пути снижения частоты внезапной сердечной смерти. Значительную роль в решении этой проблемы отводят методам анализа ЭКГ-сигнала с использованием электронно-вычислительной техники.
В последние годы все большее развитие получает ЭКГ высокого разрешения (ЭКГ ВР) — метод исследования, который позволяет с помощью компьютерной обработки ЭКГ-сигнала регистрировать низкоамплитудные высокочастотные сигналы, невидимые на обычной ЭКГ.
Широкое применение нашло выявление так называемых поздних потенциалов желудочков (ППЖ) и поздних потенциалов предсердий (ППП) с помощью специальной методики записи ЭКГ. Эта методика предусматривает фильтрацию сигнала, усиление его в десятки тысяч раз и выделение из него полезной информации с помощью метода усреднения.
Регистрация сигналов с поверхности тела расширяет возможности использования метода ЭКГ ВР в клинической практике. Это обусловлено тем, что в настоящее время отсутствуют абсолютно надежные тесты для прогнозирования наджелудочковых нарушений ритма, хотя фибрилляция/трепетание предсердий считаются самыми распространенными формами нарушения ритма сердца и отмечаются в 0,4% случаев среди взрослого населения. Их распространенность повышается с возрастом, у лиц в возрасте старше 60 лет доходит до 2–10% случаев.
ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ ОСНОВЫ ППЖ И ППП
Электрофизиологический субстрат ППЖ представляет собой зоны миокарда с низкоамплитудной, фрагментированной, замедленной активностью и задержкой желудочковой деполяризации, которые получили название «аритмогенного субстрата», является анатомической основой для запуска желудочковых тахиаритмий по механизму re-entry.
В данное время считается, что подавляющее большинство желудочковых тахиаритмий возникает по механизму повторного входа волны возбуждения. Для развития этого феномена необходим ряд условий. Главное — это замедление скорости проведения возбуждения в определенном участке миокарда. Однако одного лишь замедленного проведения недостаточно для возникновения аритмии. Необходима также фрагментация электрической активности, которая возникает в участках, где мышечные волокна разделены соединительной тканью. Чаще всего такие участки оказываются на границах зон ИМ, где островки жизнеспособной ткани чередуются с очагами фиброза. Итак, зоны неоднородности ткани приводят к фрагментации электрических сигналов и замедленному распространению деполяризации, а регистрация ППЖ свидетельствует о наличии этих зон в миокарде. Поскольку при записи усредненной ЭКГ эти зоны миокарда регистрируются в виде низкоамплитудных всплесков активности в конце желудочкового комплекса или возникают в начале сегмента ST, они и получили свое название — ППЖ.
В последние годы ученые обратились к проблеме поиска маркеров субстрата мерцательной аритмии, предсердной тахикардии. В большинстве проведенных исследований выявлено, что действительно у больных с пароксизмальной формой фибрилляции предсердий отмечают низкоамплитудные сигналы в конце зубца P, так называемые ППП, которые отражают наличие замедленной фрагментированной деполяризации предсердий и являются маркерами физиологического субстрата таких наджелудочковых тахиаритмий, как фибрилляция предсердий и пароксизмальная предсердная тахикардия, развивающихся по механизму re-entry.
МЕТОДЫ РЕГИСТРАЦИИ ППЖ И ППП
Неинвазивная регистрация ППЖ и ППП с поверхности тела связана с рядом трудностей, в частности с тем, что их амплитуда является значительно меньшей, чем амплитуда шумов от разных внешних источников. Даже при прямой записи с поверхности тела она очень невысокая и поэтому на обычной ЭКГ ППЖ и ППП не регистрируются. Однако их можно зафиксировать, используя методику усредненной ЭКГ ВР. Эта методика предусматривает усиление ЭКГ-сигнала по меньшей мере в 20–50 тыс. раз с дальнейшим разделением (фильтрацией) «полезных» высокочастотных компонентов сигнала ЭКГ, низкочастотных его составляющих и внесердечной электрической активности, то есть шумов. Шумы имеют как минимум три источника: физиологический шум вследствие активации скелетной мускулатуры, электронный шум усилителей, которые используются при регистрации ЭКГ ВР, и фоновый (сетевой) шум. Главная проблема заключается в том, что при усилении сигнала вместе с повышением амплитуды «полезных» сигналов отмечают рост уровня шума, поэтому возникает необходимость применения методов для его устранения.
Основным способом устранения шума, кроме использования экранированного кабеля и бесшумовых входных предусилителей, является применение метода компьютерного усреднения сигнала. Этот метод позволяет отделить сигналы от шумов путем существенного улучшения соотношения сигнал/шум. Поскольку шумы являются случайными всплесками, то при усреднении не синхронизируются с исследуемым сигналом и потому от комплекса до комплекса накладываются хаотически (случайно), что приводит к существенному снижению их амплитуды. В то же время «полезный» сигнал, в отличие от шумов, повторяется с определенным интервалом (то есть не хаотически), поэтому при усреднении его амплитуда стабилизируется и возрастает, увеличивая таким образом соотношение сигнал/шум. Величина шума взаимосвязана с количеством усредненных комплексов. Накопление 100 сердечных циклов снижает уровень шума в 10 раз. Согласно международным рекомендациям методика ЭКГ ВР предусматривает регистрацию и анализ от 100 до 400 ЭКГ-комплексов.
При регистрации ППЖ необходимым является также устранение низкочастотных компонентов сигнала, которые возникают при дыхательных колебаниях. Для этого применяют специальные двунаправленные четырехполюсные фильтры Баттерворта в диапазонах 25–250 и 40–250 Гц.
Еще одним условием для усреднения сигнала является идентичность (сходство) исследуемых желудочковых комплексов. При этом важным является отбрасывание преждевременных возбуждений и весьма зашумленных сигналов. Решают эту проблему следующим образом: за эталон принимают первые 8 комплексов после начала усреднения в случае, если среднее стандартное отклонение сигнала <20 мкВ. Остальные возбуждения сравниваются с эталоном и автоматически откидываются электронно-вычислительной машиной, если величина погрешности больше, чем двойное стандартное отклонение в сравнении с эталоном.
Особенности проведения импульса по предсердиям, выражающиеся в продольном направлении продвижения предсердной активности (а не трансмуральной, как при активации желудочков), а также в наложении потенциалов пучка Гиса, соответствующих по времени изоэлектрическому пространству между концом зубца Р и комплексом QRS, осложняют выявление замедленной фракционированной активности предсердий.
Оборудование, необходимое для регистрации и анализа ЭКГ ВР, включает трехканальный электрокардиограф, который должен быть подключен к персональной ЭВМ с помощью аппаратного блока. Этот блок состоит из полосовых фильтров, триггерного устройства, масштабных усилителей, аналого-цифрового преобразователя и плато интерфейса для введения сигнала в компьютер. Составные части устройства соединяются между собой оптоволоконной линией связи.
АНАЛИЗ ЭКГ ВР
При исследовании ЭКГ ВР различают временные, амплитудные и частотные параметры сигнала. В связи с этим выделяют три подхода к выявлению зон замедленной деполяризации: временную, спектральную и спектрально-часовую. В настоящее время наиболее распространенным является метод временного анализа ППЖ и ППП, поскольку наибольшие величины чувствительности и специфичности, а также наиболее высокие значения воспроизводимости большинство авторов получили, используя именно временной метод анализа усредненной ЭКГ. Для регистрации ППЖ и ППП ЭКГ-сигнал записывается в трех ортогональных отведениях по Франку (Х, Y, Z). После усиления и фильтрации комбинируется для получения векторной величины: —√XI+YI+ZI, которая называется «отфильтрованным комплексом QRS». Далее с помощью автоматического алгоритма выводятся количественные показатели ППЖ и ППП. Во внимание принимаются следующие параметры:
- продолжительность отфильтрованного комплекса QRSf QRSd;
- продолжительность низкоамплитудных (<40 мкВ) сигналов в терминальной части (последние 40 мс) отфильтрованного желудочкового комплекса — LAS40;
- среднеквадратическая амплитуда колебаний в последние 40 мс комплекса QRS (RMS 40).
ППЖ при применении фильтра 40–250 Гц констатируют по таким критериям: QRSf >114 мс, LAS >38 мс, RMS <20 мкВ. Выявление как минимум двух из трех вышеназванных показателей свидетельствует о наличии ППЖ.
При использовании фильтра 25–250 Гц, по данным большинства авторов, критериями ППЖ являются QRSf >120 мс, LAS >38 мс, RMS <25 мкВ.
К временным параметрам отфильтрованного зубца Р относят следующие показатели:
- Продолжительность отфильтрованного зубца Р (FiP).
- Разница между продолжительностью отфильтрованного и неотфильтрованного зубца Р (FiP — Un FiP).
- Продолжительность сигналов <5 мкВ (D5).
Амплитудные параметры ППП — это среднеквадратичная амплитуда (RMS):
- Всего зубца Р (RMSP).
- Последних 10–20–30 мс (Last 10–20–30 или RMS 10–20–30).
Чаще всего используется показатель RMS 20.
Современное программное обеспечение метода ЭКГ ВР позволяет устанавливать режимы усреднения кардиоциклов с синхронизацией по зубцам Р, Q, R. При анализе ППП режим усреднения с синхронизацией по зубцу Р имеет ряд преимуществ по сравнению с режимом усреднения и синхронизацией по зубцу R. Неизбежно возникающие ошибки и неточности, приводящие к ослаблению полезного сигнала в конце зубца Р при усреднении с синхронизацией по зубцу R, являются результатом, с одной стороны, изменчивости интервала P–Q от цикла к циклу, с другой — невозможности исключения из процесса усреднения эктопических предсердных комплексов, которые нередко имеют место у больных с наджелудочковыми тахиаритмиями.
Характеристики FiP также зависят от полосы пропускания частот применяемого фильтра. При использовании фильтра с диапазоном пропускания частот в 20–30 Гц возникают трудности в определении терминальной части сигнала зубца Р из-за их перекрытия сигналами зубца R. В то же время при применении фильтров в 60–80 Гц сигналы FiP приближаются к сигналам стандартной ЭКГ. Считается, что использование высокочастотных фильтров в 40 Гц является оптимальным в данной методике для идентификации пациентов с пароксизмальной формой фибрилляции предсердий. Значительно изменяют показатели ЭКГ ВР по выделению ППП типы применяемых фильтров (двунаправленные, вперед- или назаднаправленные). Н. Ozawa и соавторы в своем сообщении заключают, что двунаправленные фильтры лучше, чем другие, поскольку отражают истинную продолжительность FiP. При этом получаемое значение временных характеристик FiP меньше, чем при использовании вперед- и назаднаправленных фильтров.
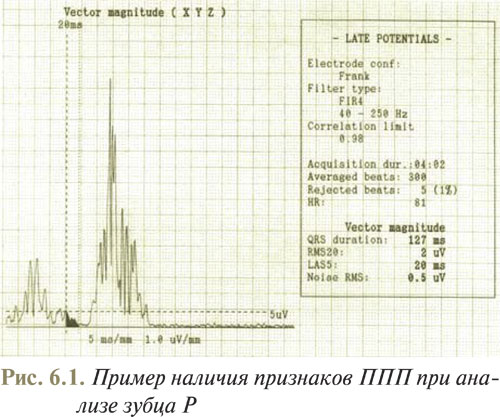
На рис. 6.1 представлен пример наличия признаков ППП при анализе зубца Р.
ИМ И ППЖ
У здоровых людей ППЖ регистрируют в 0–6% случаев. Появление ППЖ у больных c острым ИМ зависит от времени, которое прошло от начала заболевания, локализации зоны некроза и методов лечения. Данные о выраженности ППЖ в острой фазе ИМ противоречивы. ППЖ в этот период характеризуются выраженной нестабильностью. По данным разных авторов они регистрировались в 20–60% случаев, но у более чем половины пациентов позже отмечали нормализацию параметров ЭКГ ВР и исчезновение ППЖ. Неустойчивый характер ППЖ в острой фазе ИМ свидетельствует о том, что они отображают скорее степень выраженности ишемии, чем наличие аритмогенного субстрата, необходимого для возникновения желудочковых тахиаритмий.
Чаще всего ППЖ регистрируются в период между 6–30-м днем заболевания. В дальнейшем частота выявления ППЖ медленно снижается. Так, по данным Й. Киспаг и соавторов, среди больных с ИМ на момент выписки из стационара ППЖ регистрировались у 82%, через 1 год — у 61%, а через 5 лет — лишь у 48%. Однако у пациентов со стойкой желудочковой тахикардией ППЖ не исчезали. По данным ряда авторов частота выявления ППЖ в последнее время снижается, что объясняется более широким использованием тромболитической терапии и баллонной ангиопластики. Однако регистрация ППЖ остается независимым фактором риска развития желудочковых тахиаритмий. Это утверждение получило право на жизнь после того, как была доказана безоговорочная связь между ППЖ и угрозой развития опасных желудочковых нарушений ритма. Поэтому сегодня рекомендовано проводить регистрацию ЭКГ ВР с целью выявления ППЖ всем больным, перенесшим ИМ.
У больных после острого ИМ со стойкой желудочковой тахикардией, индуцированной во время ЭФИ сердца, ППЖ фиксировались в 80–100% случаев. У пациентов с постинфарктным кардиосклерозом наличие ППЖ также коррелирует с возникновением спонтанных желудочковых тахикардий. T.G. Turritto и соавторы считают, что регистрация патологических параметров усредненной ЭКГ — наиболее точный скрининг-метод для выявления вероятности индукции желудочковых тахикардий. Частота возникновения ППЖ зависит от типа тахиаритмий. M. Simson и соавторы показали, что у больных с крупноочаговым ИМ при стойкой желудочковой тахикардии ППЖ регистрировались в 91% случаев, а при фибрилляции желудочков только в 52%. По данным других авторов при возникновении фибрилляции желудочков ППЖ отмечали только в 12–18% случаев. R. Freedman и соавторы заметили, что частота выявления ППЖ почти в 3 раза выше у пациентов со стойкой желудочковой тахикардией, чем при фибрилляции желудочков. Такие же результаты получены при исследовании больных, успешно реанимированных после внезапной остановки сердца. Эти результаты свидетельствуют о существовании разных механизмов возникновения желудочковой тахикардии и фибрилляции желудочков. Поэтому вопрос прогностического значения ППЖ относительно развития опасных для жизни нарушений ритма окончательно не решен. Безусловно, что высокая прогностическая значимость отсутствия ППЖ позволяет с уверенностью отнести больных с ИМ без ППЖ к категории низкого риска развития желудочковой тахикардии и внезапной сердечной смерти. В то же время низкие величины положительной прогностической значимости (10–35%) свидетельствуют о большом количестве псевдоположительных результатов. Не у всех больных с нарушениями показателей усредненной ЭКГ развиваются желудочковая тахикардия и фибрилляция желудочков, поскольку ППЖ отображают лишь зоны замедленного проведения импульса в миокарде, что является необходимым, но не всегда достаточным условием для возникновения тахиаритмии по механизму повторного входа. Поэтому для повышения прогностической значимости выявления электрической нестабильности сердца, кроме ППЖ, в последние годы рекомендуется исследовать вариабельность ритма сердца, дисперсию Q–T-интервала и индуцируемость желудочковой тахикардии/фибрилляции желудочков при проведении программированной стимуляции желудочков.
В ряде исследований проанализирована связь ППЖ с функцией ЛЖ. Зарегистрировано, что в силу ухудшения функции ЛЖ отмечают рост частоты ППЖ и их продолжительности. Это свидетельствует о том, что анатомическим субстратом ППЖ является патологически измененный миокард, а ППЖ можно рассматривать как своеобразный «мостик» между электрофизиологическими нарушениями возбудимости и проводимости и механическими расстройствами.
Частота регистрации ППЖ зависит также от локализации ИМ. При нижней локализации ППЖ регистрируются достоверно чаще. Это связано с неравномерностью прохождения возбуждения в миокарде: нижнебазальные участки выходят из электрического возбуждения последними, что облегчает регистрацию ППЖ, если они возникают в этих участках. Межжелудочковая перегородка и передняя стенка активируются раньше, поэтому ППЖ при наличии аритмогенного субстрата в этих зонах могут появляться еще до окончания желудочкового комплекса и маскироваться им.
СВЯЗЬ МЕЖДУ РЕВАСКУЛЯРИЗАЦИЕЙ МИОКАРДА И ППЖ
В последнее время много внимания отводится влиянию тромболитической терапии и ангиопластики со стентированием при ИМ на желудочковые тахиаритмии и выявлению ППЖ. Данные большинства исследований показали, что при тромболитической терапии ППЖ регистрируются в среднем в 2–3 раза реже по сравнению с пациентами, у которых эта терапия не проводилась. При этом ППЖ чаще отмечали при сохраненной коронарной окклюзии (в 37–80%), в то время как в случаях успешного восстановления коронарной перфузии они фиксировались намного реже (16–25%). Таким образом, повторные регистрации ЭКГ ВР могут быть еще одним неинвазивным маркером успешной реваскуляризации, поскольку желудочковые нарушения ритма в первые 24 ч от начала ИМ, согласно современным взглядам, являются признаком реперфузии и не связаны с регистрацией ППЖ. Считается, что коронарная окклюзия является независимым фактором появления ППЖ, а успешная реперфузия благоприятно влияет на аритмогенный субстрат, маркером которого являются ППЖ.
ПРЕХОДЯЩАЯ ИШЕМИЯ МИОКАРДА И ППЖ
Анализ временных параметров ЭКГ ВР во время острой ишемии, вызванной проведением транслюминальной баллонной коронарной ангиопластики, показал снижение амплитуды и увеличение продолжительности высокочастотных колебаний (RMS и LAS) при неизменной величине продолжительности фильтрованного желудочкового комплекса (QRSf). При этом преходящая ишемия послужила причиной появления ППЖ у 48% больных. В то же время провокация ишемии миокарда с помощью дозированных физических нагрузок при осуществлении ВЭМ и тредмилергометрии, инфузии дипиридамола или добутамина не вызвали появления ППЖ как у больных со стенокардией, так и у пациентов после перенесенного ИМ.
Таким образом, вопрос о том, имеет ли прогностическое значение персистирование ППЖ вследствие переходной ишемии миокарда относительно возникновения желудочковой тахикардии, на сегодня остается открытым.
ЭКГ ВР И СИНКОПАЛЬНЫЕ СОСТОЯНИЯ НЕИЗВЕСТНОЙ ЭТИОЛОГИИ
Пациентов с синкопальными состояниями неизвестной этиологии часто направляют для проведения ЭФИ с целью индуцирования стойких желудочковых тахикардий и таким образом для подтверждения аритмогенного генеза синкопальных состояний. Выделение неинвазивных методов диагностики угрожающих жизни аритмий как непосредственной причины синкопальных состояний является чрезвычайно важным. Большие перспективы в этом контексте принадлежат ППЖ как неинвазивным маркерам электрической нестабильности миокарда. В исследовании D. Kuchar и соавторов (150 больных с синкопальными состояниями) ППЖ были выявлены у 16 из 22 пациентов с желудочковыми тахикардиями (чувствительность — 73%, специфичность — 89%). В других исследованиях также подтверждалось, что наличие ППЖ у больных с синкопальными состояниями совпадает со стойкой желудочковой тахикардией или ее индукцией при проведении ЭФИ (положительная прогностическая точность колебалась в пределах 40–83%, а отрицательная прогностическая точность во всех исследованиях составляла более чем 90%). Базируясь на этих данных, можно утверждать, что ЭКГ ВР имеет высокую ценность при обследовании больных с синкопальными состояниями, причиной которых являются желудочковые тахиаритмии. Особое клиническое значение ППЖ представляет их высокая отрицательная прогностическая точность. Нормальные значения параметров ЭКГ ВР у пациентов с синкопальными состояниями и низкой угрозой возникновения желудочковой тахикардии, по данным других методов диагностики (выявление желудочковой экстрасистолии высоких градаций, удлиненного Q–T-интервала, дисфункции ЛЖ), свидетельствуют о низкой вероятности аритмогенного генеза синкопальных состояний. Но при выявлении ППЖ угроза развития нарушений ритма сердца не всегда высокая.
ППЖ И БОЛЕЗНИ МИОКАРДА НЕИШЕМИЧЕСКОГО ПРОИСХОЖДЕНИЯ
Клиническое значение ППЖ наиболее глубоко исследовано при ИБС. Намного меньше внимания отводилось изучению параметров усредненной ЭКГ при других сердечно-сосудистых заболеваниях. Однако ряд исследований показал, что ЭКГ ВР может быть полезной в выделении группы риска возникновения желудочковых тахиаритмий среди больных с кардиомиопатиями. D. Roll и соавторы выявили, что у больных с ДКМП 83% пациентов с желудочковой тахикардией имели ППЖ, в то время как среди лиц без нарушений ритма сердца ППЖ регистрировались лишь в 14% случаев. По данным других авторов частота выявления ППЖ при ДКМП колеблется от 30 до 45%.
D. Manchini и соавторы отметили, что выживаемость больных с кардиомиопатиями на протяжении года при отсутствии ППЖ была на уровне 95%, в то время как при их наличии составляла только 39%.
Регистрация ППЖ при ДКМП свидетельствует о возможности индукции желудочковой тахикардии при проведении ЭФИ сердца. Это подтверждается тесной корреляционной связью между регистрацией ППЖ и желудочковой тахикардией, индуцированными при проведении программированной стимуляции сердца.
Выявление ППЖ коррелирует с данными биопсии у больных с ДКМП: они присутствуют в случаях выраженных дегенеративно-дистрофических изменений в миокарде, которые сопровождаются значительной дилатацией желудочков.
У пациентов с признаками ГКМП достоверно чаще отмечали патологическое значение одной из характеристик ЭКГ ВР — продолжительности низкоамплитудной, фрагментированной активности, но прогностическое значение этого феномена окончательно не выяснено.
Частота фиксирования ППЖ при ГКМП составляла по данным разных авторов 10–20%. Прогностическая ценность ППЖ относительно выявления электрической нестабильности сердца была относительно высокой у больных с желудочковой тахикардией (чувствительность — 75%, специфичность — 62%) и намного ниже у пациентов с фибрилляцией желудочков (чувствительность — 47%, специфичность — 23%).
Итак, наличие ППЖ при ГКМП не является надежным предиктором желудочкових тахиаритмий и риска внезапной сердечной смерти.
Ряд авторов выявили появление ППЖ у больных с гипертонической болезнью (частота ППЖ составляла от 2 до 27% случаев). При этом установлено, что ППЖ отмечают у 5% больных без ГЛЖ, у 13% — при наличии концентрической гипертрофии и у 48% — с асимметрической гипертрофией. Корреляция между ППЖ и желудочковой тахикардией выявлена лишь у больных при концентрической ГЛЖ. Это свидетельствует о том, что у лиц с АГ ППЖ в большей мере являются предикторами выраженности гипертрофии, чем желудочковых нарушений ритма сердца. Тесная корреляция между ППЖ и гипертрофией миокарда объясняется ростом массы миокарда, принимающей участие в деполяризации, а также увеличением участков фиброзной ткани, возникающей при наличии у пациента АГ и вызывающей задержку активации миокарда.
Среди больных с нарушениями желудочкового ритма без клинических проявлений заболеваний сердца (пациенты с так называемыми идиопатическими желудочковыми тахикардиями) ППЖ отмечали в 18–20% случаев. Регистрация ППЖ коррелировала с патологическими результатами биопсии миокарда (чрезмерное развитие фиброза). При этом констатировано, что ППЖ не являются достаточно чувствительным маркером для прогнозирования изменений при биопсии миокарда (63%) и индуцированности желудочковой тахикардии во время ЭФИ (37%), несмотря на то что имеют высокую специфичность (84 и 100% соответственно).
В отдельных работах изучались ППЖ у больных с врожденными пороками сердца (особенно при пороках Фалло), гемодинамически значимым пролапсом митрального клапана, миокардитом, аритмогенной дисплазией ПЖ. Однако в эти исследования было включено небольшое количество больных, что является недостаточным для решения вопроса о прогностическом значении ППЖ при этих заболеваниях.
АНТИАРИТМИЧЕСКИЕ ПРЕПАРАТЫ И ППЖ
Согласно результатам большинства исследований изменения параметров ЭКГ ВР, которые отмечают под влиянием разных антиаритмических средств, не имеют существенного значения в прогнозировании эффективности лечения. Только в некоторых работах у небольшого количества больных показано, что появление ППЖ или увеличение их количественных параметров на фоне приема антиаритмических препаратов совпадало с более легкой индуцированностью желудочковой тахикардии во время программированной стимуляции желудочков сердца.
Антиаритмические средства, блокируя ионные каналы клеточных мембран сердца, замедляют проведение электрических импульсов и увеличивают рефрактерность (кроме препаратов IB группы), что теоретически должно вызывать не исчезновение ППЖ, а, наоборот, возрастание частоты их регистрации. R. Freedman и соавторы показали, что применение антиаритмических средств 1А и особенно IC групп приводило к значительному увеличению продолжительности низкоамплитудных сигналов в конечной части желудочкового комплекса, связанного с удлинением цикла индуцированной желудочковой тахикардии. При лечении флекаинидом частота выявления ППЖ повышалась от 43 до 62%, при терапии пропафеноном — от 29 до 48%, тогда как при лечении мексилетином не изменялись параметры усредненной ЭКГ.
Амиодарон и соталол мало влияют на показатели ЭКГ ВР. По данным C. Hofman и соавторов у пациентов с наличием желудочковых экстрасистол высоких градаций изменения параметров усредненной ЭКГ, вызванные действием амиодарона, не коррелировали с эффективностью лечения. В других исследованиях показано, что у больных с индукцией желудочковой тахикардии во время ЭФИ применение амиодарона вызывает появление ППЖ.
Итак, изменения ЭКГ ВР на фоне антиаритмической терапии не были связаны с ее эффективностью, появлялись независимо от природы основного заболевания и клинико-анамнестических данных и не позволяли прогнозировать результаты лечения.
АКШ, ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ АРИТМИЙ И ППЖ
По данным ряда исследований после операции АКШ исчезновение ППЖ отмечали приблизительно у 40–50% больных. ППЖ после АКШ регистрировали у пациентов с низкой ФВ и частой желудочковой экстрасистолией, однако при проспективном наблюдении на протяжении 3 лет случаи внезапной смерти не фиксировались, поэтому прогностическое значение ППЖ у этого контингента больных остается неясным.
Хирургическая деструкция аритмогенных зон приводит к исчезновению ППЖ. Кроме того, нормализация параметров усредненной ЭКГ совпадает с устранением возможности повторной индукции желудочковой тахикардии, то есть усредненная ЭКГ может быть полезной в прогнозировании эффективности хирургического лечения у пациентов с наличием ППЖ до операции. По данным N. Marcus и соавторов у 90% больных с нормальными показателями ЭКГ ВР после лечения не удалось запустить любой вид желудочковой тахикардии во время ЭФИ. С другой стороны, ряд исследований показали, что у 85–100% пациентов, у которых стойкая желудочковая тахикардия оставалась и после хирургического устранения аритмогенного очага, ППЖ продолжали выявлять в послеоперационный период. В то же время приблизительно у половины больных с сохраненными ППЖ после лечения стойкая желудочковая тахикардия не индуцировалась. Причина в том, что регистрация ППЖ тесно связана с величиной участков замедленной деполяризации миокарда. Об этом свидетельствует корреляция между низкоамплитудными сигналами поверхностной усредненной ЭКГ, с одной стороны, количеством участков замедленной активации миокарда и ее продолжительностью по данным эндокардиального картирования — с другой. Персистирование ППЖ является доказательством того, что в сердце остаются зоны замедленного проведения импульса и угроза аритмии окончательно не устранена.
Таким образом, несмотря на ряд нерешенных вопросов диагностического и прогностического значения ППЖ, широкое использование методики ЭКГ ВР в клинической практике позволяет выявлять среди пациентов кардиологического профиля лица с высоким риском развития опасных для жизни желудочковых нарушений ритма и оптимизировать тактику их лечения.
ИНФОРМАТИВНОСТЬ ПОКАЗАТЕЛЕЙ ППП
Зарубежные и отечественные авторы установили высокую прогностическую ценность ЭКГ ВР в оценке риска возникновения пароксизмов фибрилляции предсердий. Доказано, что ППП регистрируют у 63–93% больных с пароксизмами фибрилляции предсердий.
Предлагаемые в литературе значения показателей ЭКГ ВР зубца Р для использования в качестве критериев выявления больных с фибрилляцией предсердий представлены в табл. 6.1.
Таблица 6.1
Предлагаемые пороговые значения показателей ЭКГ ВР зубца Р для выявления больных с фибрилляцией предсердий
| Авторы | Год | Критерии | Чувствительность | Специфичность |
| G. Opolski и соавторы | 1990 | FiP >104 | 76 | 90 |
| P. Marconi и соавторы | 1991 | FiP >130 | 68 | 92 |
| M. Fukunami и соавторы | 1991 | FiP >120 | 95 | 54 |
| J. Stainberg и соавторы | 1993 | FiP >135 | 63 | 98 |
| А.У. Елеуов и соавторы | 1993 | FiP >140 | 85 | 74 |
| S. Guidera и соавторы | 1993 | FiP >155 | 80 | 93 |
| Y. Abe и соавторы | 1994 | FiP >125 и RMS 20 <3,0 | 87 | 93 |
| D. Kontoyannis и соавторы | 1995 | FiP >120 | 90 | 84 |
| P. Stafford и соавторы | 1995 | FiP >155 | 81 | 93 |
| N. Gondo и соавторы | 1995 | FiP >120 | 85 | 84 |
Таким образом, очевиден широкий разброс пороговых величин, предлагаемых для выделения ППП. Это связано с техническим несовершенством метода и отсутствием единых методологических подходов.
Несмотря на то, что метод ЭКГ ВР используют для определения таких диагностических показателей, как ППЖ и ППП, возможности его применения в диагностических целях этим не ограничены. Данные, полученные при исследовании с помощью ЭКГ ВР изменений длительности зубца Р и его дисперсии, открывают новые диагностические возможности. Как известно, дисперсия зубца Р является маркером гетерогенного импульсного проведения и может быть использована как ЭКГ-маркер для выявления пациентов с фибрилляцией предсердий, ее вычисляют как разницу между максимальной и минимальной продолжительностью зубца Р.
По данным G. Villani и соавторов, индекс дисперсии зубца Р при комбинации с показателем длительности отфильтрованного сигнала позволяет значительно повысить чувствительность и специфичность метода ЭКГ ВР при идентификации пациентов с высоким риском развития пароксизмов фибрилляции предсердий. Были сравнены показатели ЭКГ ВР — FiP, RMS 20 и Р-дисперсии (в отведениях X, Y, Z) у 40 пациентов с пароксизмальной формой фибрилляции предсердий и контрольной группой. В 1-й группе по сравнению с контролем были выше показатели FiP (138 614 мс по сравнению с 120 612 мс; р<0,0005) и Р-дисперсии (862 мс по сравнению с 161 мс; р<0,0001). Показатели RMS 20 не отличались. Установлено, что FiP и Р-дисперсия позволяют идентифицировать пациентов с высоким риском развития пароксизмов фибрилляции предсердий.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ПОЯВЛЕНИЕ ППП
Рассматривая вопрос регистрации ППП, следует учитывать возможность влияния на них ряда факторов, среди которых необходимо отметить:
- перегрузку предсердий объемом и давлением;
- гипертрофию предсердий и ее степень;
- наличие или отсутствие органических заболеваний сердца;
- давность возникновения пароксизмов, их длительность и частоту;
- наличие синдрома слабости синусного узла.
При этом указанные аспекты недостаточно изучены и требуется проведение дальнейших исследований. Кроме того, очевидно, необходимо учитывать возможность наложения потенциалов пучка Гиса.
Расширению предсердий, в частности левого, придается большое значение как фактору возникновения фибрилляции/трепетания предсердий. Действительно, представляется логичным, что чем значительнее размеры предсердий, тем более выражено изменение их ультраструктуры и, следовательно, повышается вероятность появления и учащения пароксизмов тахикардии по механизму re-entry. Установлена зависимость между вероятностью сохранения синусового ритма после кардиоверсии в течение 6 мес и размерами полости левого предсердия — вероятность срыва ритма высокая при 4,5–5,0 см. Также имеет значение соотношение размеров полости левого предсердия и размера корня аорты. Предложено понятие «критический порог» увеличения полости левого предсердия, при котором аритмии становятся неизбежными.
Н. Ozawa и соавторы исследовали влияние перегрузки левого предсердия на значения показателей ЭКГ ВР. В исследование включили 10 здоровых лиц (1-я группа), 25 пациентов с пароксизмальной формой фибрилляции предсердий (2-я группа), 17 больных без фибрилляции предсердий, но с увеличением размеров левого предсердия >40 мм (3-я группа). Авторы не нашли какой-либо существенной разницы в продолжительности FiP-волны во всех группах. Продолжительность FiP как у пациентов с фибрилляцией предсердий, так и у больных с увеличенным размером левого предсердия была более длительной, чем у здоровых. Значительной разницы между этими показателями у пациентов 2-й и 3-й групп не было. Исследователи сделали вывод о том, что перегрузка левого предсердия у пациентов без нарушения ритма сердца также влияет на временные показатели ЭКГ ВР, что необходимо учитывать при использовании этого метода на практике.
Однако в литературе практически нет работ, анализирующих зависимость показателей ЭКГ ВР от размеров правого предсердия в сочетании с пароксизмами фибрилляции предсердий и без них.
G. Turitto и соавторы сопоставили показатели ЭКГ ВР и эхоКГ у пациентов с пароксизмальной формой фибрилляции и трепетания предсердий. Продолжительность FiP была увеличена как у тех, так и у других (150 и 147 мс) соответственно. Установлена достоверная корреляция между продолжительностью FiP и объемом левого предсердия. Исследователи считают, что с помощью временного показателя FiP невозможно определить, имеется ли у пациента фибрилляция или трепетание предсердий. Продолжительность FiP отражает лишь увеличенный объем левого предсердия. Амплитуда и продолжительность потенциалов области замедленного проведения в нижнезадней стенке правого предсердия — потенциального электрофизиологического субстрата развития трепетания предсердий — недостаточно большие для того, чтобы вызвать удлинение FiP. По совокупности показателей увеличенных продолжительности FiP и объема правого предсердия можно прогнозировать развитие трепетания предсердий. ППП несколько чаще выявляют у пациентов с пароксизмальной формой фибрилляции предсердий, чем у пациентов с предсердной тахикардией, развивающейся по механизму re-entry.
Kontoyannis и соавторы провели исследование ЭКГ ВР с синхронизацией и накоплением по зубцу Р в трех группах больных: 1-я — здоровые (30 человек); 2-я — с пароксизмальной формой фибрилляции предсердий (38 человек); 3-я — с пароксизмальной предсердной тахикардией (29 человек).
ППП были выявлены у 10% в 1-й группе, у 84% — во 2-й, у 79% — в 3-й группе. Специфичность и чувствительность по сравнению с 1-й группой составили соответственно для 2-й — 90 и 84%, для 3-й — 90 и 79%. Предполагается, что замедленная фрагментированная активность при пароксизмальной предсердной тахикардии недостаточна (по количеству) для того, чтобы быть зарегистрированной с поверхности тела в сравнении с субстратом аритмии при фибриляции предсердий.
В 1993 г. G. Villani и соавторы опубликовали результаты работы, целью которой было изучение возможности применения новой диагностической методики анализа усредненного сигнала зубца Р, используя чреспищеводную запись сигнала. Эти авторы установили более высокую чувствительность, специфичность и прогнозирующую ценность данной модификации по ряду показателей. Так, продолжительность FiP в группе пациентов с фибрилляцией предсердий была больше (126,6±12,4 мс), чем в контрольной (96,8±12,5 мс), р<0,001, а амплитудные показатели — ниже. Чувствительность, специфичность и прогнозирующая ценность составили для продолжительности FiP — 85, 100, 100%; RMS 20 — 84; 90 и 96% соответственно.
Весьма важно определение электрической нестабильности предсердий при ГКМП. Развитие фибрилляции предсердий у этой категории больных является неблагоприятным фактором и в ряде случаев требует проведения срочных вмешательств. A. Voss и соавторы наблюдали пациентов с ГКМП в течение 10 лет. Проведя многофакторный анализ, исследователи пришли к выводу, что только продолжительность FiP (сравнивали показатели размера левого предсердия, толщины стенки ЛЖ, ФК СН) является независимой величиной, связанной с риском возникновения фибрилляции предсердий.
Большое практическое значение имеют работы по изучению применения ЭКГ ВР в прогнозировании развития фибрилляции предсердий у пациентов после хирургических вмешательств на сердце. Пароксизмальная форма фибрилляции предсердий — наиболее распространенная форма аритмии, возникающая после АКШ, ее выявляют в 10–40% случаев. Несмотря на то что при этой аритмии редко возникают серьезные, опасные для жизни осложнения, она может вызвать гемодинамические расстройства, системную тромбоэмболию, удлиняет госпитальный период. Показатель FiP >155 мс позволяет идентифицировать пациентов, подверженных фибрилляции/трепетанию предсердий в послеоперационный период после проведения АКШ с чувствительностью 69%, специфичностью 79%, положительной прогнозирующей ценностью 65% и отрицательной прогнозирующей ценностью 82%.
Ю.А. Истомина и соавторы провели исследование с целью, во-первых, сравнить показатели ЭКГ ВР у больных с увеличенным правым и левым предсердием с таковыми контрольной группы, во-вторых, оценить частоту регистрации ППП у больных при различной патологии с увеличением правого и левого предсердия, в-третьих, сопоставить временные показатели ЭКГ ВР у больных с частыми и редкими пароксизмами аритмии. Всего обследованы 85 человек (70 больных и 15 здоровых). Из них 22 пациента с ИБС, включая постинфарктный кардиосклероз, стенокардию напряжения II–III ФК, 15 больных с АГ, 7 — с алкогольной миокардиодистрофией в сочетании с пароксизмами фибрилляции предсердий, 10 — с идиопатической формой пароксизмальной фибрилляции предсердий, 16 — с заболеваниями, сопровождающимися увеличением правого предсердия (ХОБЛ, первичная легочная гипертензия, вторичная легочная гипертензия на фоне митрального стеноза). Контрольную группу составили 15 добровольцев.
Больные, включенные в исследование, получали только базовую патогенетическую терапию после купирования пароксизма фибрилляции предсердий лекарственными средствами и были обследованы с учетом периода полувыведения препарата. Все пациенты вне зависимости от нозологической формы были разделены на 4 группы: 1-я — с нормальными размерами левого и правого предсердий (16), 2-я — с увеличенным размером левого предсердия >4,0 см при измерении из парастернального доступа (38), 3-я — с увеличенным размером правого предсердия, измеренного из верхушечной позиции, или предполагаемым увеличением на основании повышения давления в ЛА >20 мм рт. ст. (9), 4-я — с увеличенным правым и левым предсердиями (7). Кроме того, все больные с пароксизмами фибрилляции предсердий были разделены на 2 группы: 1-я — с частыми пароксизмами, 2-я — с редкими пароксизмами.
Полученные данные свидетельствуют, что минимальную частоту выявляемости ППП отмечали при идиопатической форме пароксизмальной фибрилляции предсердий — 60% и при увеличенном правом предсердии без пароксизмов фибрилляции предсердий — 40%, в то время как при других нозологических формах она составила 85–100%. Что касается показателя RMS 20, то выявляли различия в группе больных с идиопатической формой пароксизмальной фибрилляции предсердий по сравнению с контролем и другими нозологическими формами. Результаты исследования подтверждают независимость показателя RMS 20 от вида патологии, за исключением идиопатической формы пароксизмальной фибрилляции предсердий. Согласно полученным данным вид патологии существенно влияет на частоту выявляемости ППП. Достоверность отличия показателей FiP и RMS 20 при патологии различных видов в сравнении с нормой (группа контроля) представлена в табл. 6.2.
Таблица 6.2
Показатели ЭКГ ВР при различных видах патологии
| Группа | FiP, мс | RMS 20, мкВ | р для FiP | р для RMS 20 |
| Контроль, n=15 | 112±2,7 | 3,0±0,3 | — | — |
| ИБС с пароксизмами фибрилляции предсердий, n=13 | 141±3,0 | 3,0±0,6 | 0,0001 | 0,7 |
| ИБС без пароксизмов фибрилляции предсердий, n=9 | 124±3,8 | 3,2±0,6 | 0,003 | 0,7 |
| Гипертоническая болезнь с пароксизмами фибрилляции предсердий, n=7 | 140±4,2 | 3,9±0,9 | 0,0005 | 0,4 |
| Гипертоническая болезнь, n=8 | 135±4,0 | 2,3±0,8 | 0,003 | 0,15 |
| Миокардиодистрофия с пароксизмами фибрилляции предсердий, n=7 | 124±3,0 | 3,2±0,6 | 0,001 | 0,7 |
| Идиопатическая форма пароксизмальной фибрилляции предсердий, n=10 | 124±3,8 | 2,4±0,9 | 0,09 | 0,05 |
| Увеличение правого предсердия без пароксизмов фибрилляции предсердий, n=11 | 123±5,0 | 2,8±1,8 | 0,09 | 0,9 |
| Увеличение правого предсердия с пароксизмами фибрилляции предсердий, n=5 | 135±5,0 | 2,4±1,9 | 0,003 | 0,3 |
Таким образом, у пациентов с увеличенным правым отделом сердца в сочетании с пароксизмальной фибрилляцией предсердий показатели ЭКГ ВР достоверно отличались от групп контроля и больных с увеличенным правым предсердием без пароксизмов фибрилляции предсердий.
Несомненно, наиболее практически ценными представляются прогностические исследования, позволяющие оценить риск возникновения фибрилляции предсердий или перехода пароксизмальной формы фибрилляции предсердий в постоянную форму. Y. Abe и соавторы проводили наблюдение 71 пациента с пароксизмальной формой фибрилляции предсердий. Выявлено, что у 10 из них за 22 мес установилась постоянная форма фибрилляции предсердий, а у 61 пациента за 31 мес изменений не произошло. По мнению авторов, такие критерии ЭКГ ВР, как продолжительность FiP >145 мс и RMS 20 <3,0 мкВ, позволяют прогнозировать риск перехода пароксизмальной формы фибрилляции/трепетания предсердий в постоянную форму с чувствительностью 75% и специфичностью 93,7%.
В настоящее время отсутствуют однозначные данные о взаимосвязи ППП со степенью выраженности гипертрофии предсердий, морфологическими изменениями миокарда, их гемодинамической перегрузкой и степенью гипертрофии, характером и степенью выраженности нарушений процесса охвата возбуждением предсердий. Нет четкого понимания вклада каждого из предсердий в появление фрагментированной высокочастотной активности конечной части зубца Р. Данные вопросы требуют изучения и уточнения.
ЛИТЕРАТУРА
- Буланова Н.А. (1998) Прогностическое значение метода ЭКГ ВР у больных с пароксизмальной формой мерцательной аритмии. Кардиология, 3: 24-32.
- Истомина Т.А., Говша Ю.А., Воронин И.М., Иванов Г.Г. (1999) Роль увеличения левого и правого предсердия в генезе поздних потенциалов предсердий. Кардиология, 7: 31-37.
- Савельева И.В., Меркулова И.Н., Стражеско И.Д., Швилкин А.В., Абугов С.А., Руда М.Я. (1998) Влияние преходящей ишемии миокарда на поздние потенциалы при транслюминальной коронарной ангиопластике. Кардиология, 11: 32-36.
- Abe Y., Fukunami M., Shimonagata T. (1997) Prediction of paroxysmal atrial fibrillation in patients with congestive heart failure: a prospective study. Circulation, 29: 2612-2616.
- ACC/AHA/ESC (2006) quidelines for the management of patients with atrial fibrillation — executive summary. Eur. Heart J., 27: 1979-2030.
- Dibs S.R., Ng J., Arora R., Passman R.S., et al. (2008) Spatiotemporal characterization of atrial activation in persistent human atrial fibrillation: multisite electrogram analysis and surface electrocardiographic correlations — a pilot study. Heart Rhythm. May; 5 (5): 686-693. Epub 2008 Jan 29. PMID
- El-Sherif N., Gomes J., Restivo M. et al. (1998) Late potentials and arrhythmogenesis. Pace, 8: 440-462.
- Josephson M., Horowitj L., Farshidi A. (1998) Continuous local electrical activity: A mechanism of recurrant ventricular tachycardia. Circulation, 57: 659-665.
- Kuchar D., Rosenbaum D., Ruskin J. (2001) Late potentials on the signal-averaged electrocardiogram after canine myocardial infarction: correlation with induced ventricular arrythmias during the healing phase. J. Amer. Coll Cardiology, 75: 1365-1369.
- Priori S. et al. (2004) Early after depolarisations induced in vivo by reperfusion of ischemic myocardiums. A possible mechanism for reperfusion arrhytmias. Circulation, 81: 1911-1920.
- Stafford P., Turner I., Vincent R. (1999) Quantitative analysis of signal-averaged P waves in idiopathic paroxysmal atrial fibrillation. Amer. J. Cardiology, 68: 751-755.
- Swerdlow C.D., Zhou X., Voroshilovsky O., et al. (2008) High amplitude T-wave alternans precedes spontaneous ventricular tachycardia or fibrillation in ICD electrograms. Heart Rhythm., May, 5 (5): 670-676. Epub 2008 Feb 16. PMID: 18452868
- Zipes W. (1997) Genesis of cardiac arrhythmias: electrophysiological consideration heart disease. A textbook of cardiovascular medicine. Ed. E. Braunwald. Philadelphia; Toronto: Lippincoft: Williams Wilcins, 548-592.