ЭФИ И ПОКАЗАНИЯ К ЕГО ПРОВЕДЕНИЮ
Более 30 лет тому назад впервые с помощью электродного катетера зарегистрирована электрическая активность пучка Гиса. Это открытие стало новым шагом в развитии существующих представлений о механизмах нарушений ритма сердца и проводимости. Сначала эта методика получила название «исследование пучка Гиса», но уже в 1970 г. (Sheslag et al.) был внедрен термин «электрофизиологическое исследование» (ЭФИ). С того времени ЭФИ активно развивается и широко применяется в клинической практике. Применение ЭФИ дает возможность не только по-новому рассмотреть и понять механизмы нарушений ритма и проводимости сердца, но и подобрать оптимальную тактику лечения пациентов. Сформировались принципиально новые представления о механизмах действия антиаритмических средств. Благодаря активному внедрению ЭФИ в клинику получили интенсивное развитие кардиохирургические методы лечения аритмий, появился новый терапевтический метод — катетерная радиочастотная деструкция.
Задача внутрисердечного ЭФИ
- Определение функциональных характеристик проводящей системы сердца.
- Изучение механизмов аритмии, факторов ее индукции и прекращения, выявление анатомических субстратов аритмии на основе анатомо-электрофизиологических характеристик.
- Точная топическая диагностика субстрата аритмии перед радикальным хирургическим вмешательством или катетерной абляцией.
- Выявление аритмической патологии у больных с синкопальными состояниями, выявление больных с риском внезапной смерти.
- Осуществление подбора медикаментозной терапии (медикаментозное тестирование).
- Подбор режимов антитахикардитической электрокардиостимуляции, режимов кардиоверсии и дефибрилляции при имплантации кардиовертеров-дефибрилляторов.
- Проведение катетерной деструкции субстратов аритмии.
Требования к электрофизиологическим лабораториям
Инвазивные ЭФИ должны выполняться в центрах, которые имеют кардиологическую, анестезиологическую и кардиохирургическую службы, при наличии оборудованного кабинета ЭФИ, персонала, подготовленного по клинической электрофизиологии сердца. Неинвазивное ЭФИ могут выполнять на базе кабинетов функциональной диагностики кардиологических отделений при обеспечении их эффективными быстродействующими препаратами, дефибрилляторами и возможностями быстрой транспортировки больного в реанимационное отделение.
Требования к персоналу лаборатории ЭФИ
В проведении ЭФИ принимают участие такие специалисты: 2 врача-электрофизиолога, анестезиолог, инженер-электронщик и медицинская сестра. Персонал лаборатории работает в условиях рентгеновского облучения. Кардиохирурги привлекаются для предоставления хирургической помощи при возникновении угрожающих для жизни осложнений.
Оборудование лаборатории ЭФИ
- Рентгенотелевизионная система передвижного или стационарного типа.
- Универсальный электрокардиостимулятор.
- Многоканальное регистрирующее устройство для синхронной регистрации ЭКГ и внутрисердечных электрограмм.
- Эндокардиальные электроды.
- Оборудование для проведения реанимации.
Протокол ЭФИ
Под местной анестезией пунктируют и катетеризируют большую вену (обычно бедренную или подключичную) и под рентгенологическим контролем устанавливают эндокардиальные электроды в разных отделах сердца. Стандартными позициями электродов являются верхние отделы правого предсердия (HRA, high right atrium), венечный синус сердца (CS, coronary sinus), AV-соединение с пучком Гиса (НВ, His band), верхушечным отделом ПЖ (RV, right ventricular). Для размещения электрода в венечном синусе его вводят в левую подключичную или яремную вену. После проведения электродов в типичные позиции регистрируют полостные эндокардиальные электрограммы, обычно в биполярном режиме с синхронной записью стандартных и грудных отведений на разной скорости протяжения ленты (50 и 100 мм·с-1). После анализа базовых интервалов гисограммы на синусовом ритме приступают к выполнению стимуляции различных камер сердца. Обычно применяют биполярную стимуляцию с дистальным полюсом электрода как катода. В большинстве употребляемых в данное время протоколов стимуляций используется сила тока, которая в 2 раза превышает порог стимуляции (1–4 мА). Продолжительность стимулирующего импульса обычно 1–2 мс.
На электрограмме определяют такие интервалы (рис. 5.1).
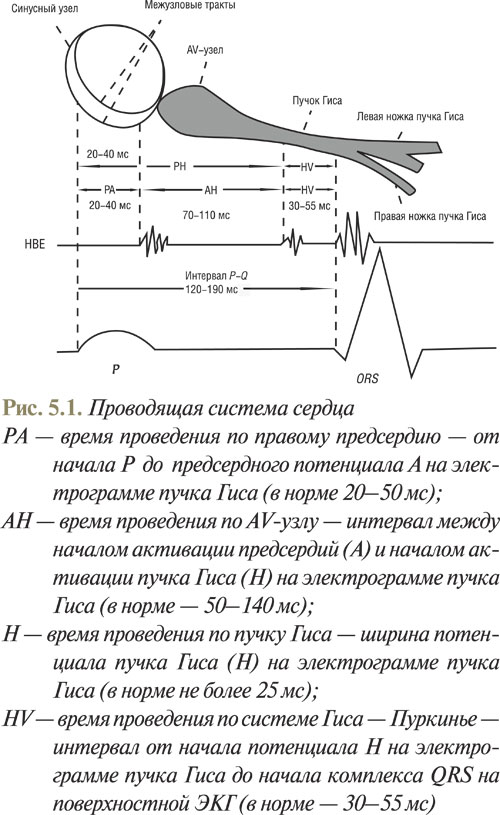
При проведении ЭФИ рекомендуют такую последовательность выполнения протокола исследования:
- Анализируют состояние проводящей системы сердца на начальном ритме по анализу базовых показателей электрограммы;
- Оценивают функцию синусного узла;
- Возрастающая по частоте стимуляция предсердия для оценки антероградного проведения и точки Венкебаха;
- Программированная стимуляция правого предсердия одним и двойным экстрастимулом на спонтанном и заданном ритме (2–3 базовых цикла);
- Стимуляция ПЖ вначале на верхушке, затем при необходимости на выходном тракте в 2–3 базовых циклах одним или двумя экстрастимулами;
- Далее можно выполнять медикаментозные пробы, направленные на выявление преходящих нарушений функции синусного узла и AV-проведения или провокацию пароксизмальных тахиаритмий.
Последовательность выполнения программы исследования может отличаться в зависимости от цели исследования, патологии и конкретной ситуации, возникающей в процессе проведения ЭФИ. Для получения максимально возможной информации следует придерживаться некоторых принципиальных моментов.
ЭФИ В ИЗУЧЕНИИ ФУНКЦИИ СИНУСНОГО УЗЛА
ЭКГ-проявления дисфункции синусного узла включают синусовую брадикардию в покое, неадекватный хронотропный ответ на нагрузку или стресс, синоатриальную блокаду выхода или остановку синусного узла. Общие проявления включают потерю сознания, предобморочное состояние, кратковременное головокружение или выраженную слабость. Аритмии обычно обусловлены одним или несколькими перечисленными факторами: поражение собственно синусного узла (например идиопатическая дегенерация, фиброз, ишемия или хирургическая травма), нарушение функции автономной нервной системы, а также действием препаратов. Клинически выявление возможной дисфункции синусного узла часто затруднено, поскольку симптомы аномалии могут быть кратковременными и доброкачественными, а у пациентов, не имеющих симптомов, возможно значительное изменение синусового ритма. Были предложены различные инвазивные тесты для оценки функции синусного узла.
Время восстановления функции синусного узла (ВВФСУ) используется для оценки влияния сверхчастой стимуляции на автоматизм синусного узла. Часто вносится поправка на продолжительность синусового цикла (СЦ), что определяется как корректированное время восстановления функции синусного узла (КВВФСУ = ВВФСУ — СЦ). В норме ВВФСУ не превышает 1500–2000 мс, а КВВФСУ — 600 мс. Чувствительность обоих показателей до 60%, специфичность — 88%. Таким образом нормальные их значения не всегда дают возможность исключить наличие дисфункции синусного узла. Рекомендации по проведению ЭФИ для оценки функции синусного узла даны в табл. 5.1.
Таблица 5.1
Рекомендации по проведению ЭФИ для оценки функции синусного узла
| Показания | Клинические группы пациентов |
| Абсолютно показано | Пациенты с клинической симптоматикой, у которых как причина симптомов подозревается дисфункция синусного узла, но после тщательного обследования причинная связь между аритмиями и симптомами не установлена |
| Эффективно |
|
| Не показано |
|
Синоатриальное проведение может быть измерено непосредственно или с помощью нанесения предсердного экстрастимула на фоне синусового ритма или при стимуляции предсердия.
Синопредсердная пароксизмальная тахикардия
- Во время тахикардии потенциал верхней части правого предсердия предшествует потенциалу нижней его части и существенным образом не отличается от такового на фоне синусового ритма.
- Тахикардия провоцируется электростимулом, нанесенным в период сердечного цикла, который предшествует блокаде его проведения в синусный узел. Интервал сцепления такого электростимула несколько короче интервала, при котором электростимул замещает синусовый импульс.
- Единичный электростимул, нанесенный на предсердие с несколько меньшим интервалом сцепления, чем тот, при котором возник пароксизм, способен прекратить приступ тахикардии.
- Частая стимуляция также провоцирует и угнетает эктопический ритм.
- Дополнительными критериями диагностики является развитие блокады II степени антероградного проведения импульса в AV-узле во время тахикардии, которая не сопровождается прекращением приступа, а также ретроградная блокада проведения импульса при искусственной стимуляции желудочков.
Предсердная пароксизмальная тахикардия
- Потенциал предсердия предшествует потенциалу пучка Гиса.
- Последовательность распространения возбуждения по предсердию в некоторых случаях нарушена. Если эктопический водитель ритма размещен в нижней части предсердия, потенциал его предшествует потенциалу верхней части правого предсердия; если водитель ритма находится в левом предсердии, то оно возбуждается прежде правого предсердия.
- В некоторых случаях зарегистрированные предсердные потенциалы имеют разную конфигурацию (несколько очагов эктопического ритма).
- Единичными электростимулами невозможно прекратить пароксизм. Частая стимуляция может лишь временно подавить эктопический ритм. В тех случаях, когда прогнозируют реципрокный механизм тахикардии, важнейшим диагностическим признаком считают ухудшение внутрипредсердной проводимости в момент провокации пароксизма.
- Дополнительным признаком является антероградная или ретроградная блокада проведения импульса по AV-узлу, поскольку наличие этих нарушений исключает узловую пароксизмальную тахикардию.
AV-узловая пароксизмальная тахикардия
- Предсердные электростимулы с интервалом сцепления, который постоянно становится короче, вызывают пароксизм тахикардии, возникновению которого предшествует внезапное или постепенное удлинение интервала P–R.
- Потенциал пучка Гиса предшествует во время тахикардии потенциалу желудочка.
- Потенциал нижней части предсердия предшествует потенциалу его верхней части и по времени возникновения совпадает с потенциалом желудочка.
- Стимуляция желудочка с возрастающей частотой или с помощью единичных импульсов с интервалом сцепления, который постоянно укорачивается, сопровождается постепенным замедлением ретроградного распространения возбуждения по предсердию. Это указывает на то, что импульс проводится AV-узлом, а не по дополнительному предсердно-желудочковому соединению.
- Прекращение пароксизма происходит лишь в результате блокирования импульса в AV-узле.
Фибрилляция, трепетание предсердий
Диагноз пароксизмальной мерцательной аритмии обычно не вызывает затруднений, поэтому ЭФИ проводить не обязательно. Лишь при необходимости дифференциации между желудочковой экстрасистолией и аберрантными комплексами следует провести регистрацию электрограммы пучка Гиса. Регистрация потенциала пучка Гиса на гисограмме и нормальной продолжительности интервала Н–V дает возможность утверждать, что желудочковые комплексы являются аберрантными. И, наоборот, отсутствие потенциала Н или значительное укорочение интервала Н–V является характерным для желудочковых экстрасистол. При трепетании предсердий очень четко выделяются волны f, связанные или частично диссоциированные с желудочковыми комплексами.
ЭФИ У ПАЦИЕНТОВ С ПРИОБРЕТЕННОЙ AV-БЛОКАДОЙ/ХРОНИЧЕСКИМ НАРУШЕНИЕМ AV-ПРОВЕДЕНИЯ
Возможность регистрации потенциала пучка Гиса во время ЭФИ дает возможность описать 3 анатомических участка AV-блокады:
а) Проксимальный (над пучком Гиса) — задержка проведения или блокада в AV-узле.
б) Интрагисовый — задержка проведения или блокада в пределах пучка Гиса.
в) Дистальный — размещен дистальнее пучка Гиса и располагается на уровне ножек пучка Гиса.
Такая диагностика является крайне важной, поскольку прогноз больных с AV-блокадой зависит от уровня блокады: чем ниже уровень блокады, тем хуже прогноз.
При прогрессирующем повышении частоты стимуляции правого предсердия отмечают постепенное удлинение интервала А–Н до развития AV-блокады II степени на уровне AV-узла — «точка Венкебаха». В норме этот показатель превышает 110–130 импульсов в минуту.
Есть определенные корреляции между картиной ЭКГ и уровнем блокады. При AV-блокаде II степени I типа с узкими комплексами QRS блокада обычно возникает на уровне AV-узла, реже может локализоваться в пучке Гиса. При AV-блокаде II степени тип I с широкими комплексами QRS (блокада ветви пучка Гиса) блокада проведения может возникать на уровне AV-узла, внутри или ниже пучка Гиса. AV-блокада II степени II типа обычно возникает на уровне пучка Гиса или ниже и чаще объединяется с блокадой ножки пучка Гиса. Изредка AV-блокада II типа возникает в AV-узле. При полной AV-блокаде с выскальзывающим ритмом и узкими комплексами QRS место блокады может локализоваться в AV-узле или пучке Гиса. При полной AV-блокаде с выскальзывающим ритмом с широкими комплексами QRS место блокады может располагаться в AV-узле, внутри или ниже пучка Гиса. Обычно она расположена ниже пучка Гиса.
Прогноз пациентов с AV-блокадой зависит от уровня ее возникновения. Хроническая AV-блокада I степени, особенно блокада на уровне AV-узла, обычно имеет доброкачественное течение. Данная аномалия часто связана с приемом лекарственных препаратов и имеет обратимый характер. Клиническое течение узловой AV-блокады II степени обычно доброкачественное, прогноз зависит от наличия и состояния основного заболевания сердца. Прогноз пациентов с AV-блокадой II степени на уровне пучка Гиса неоднозначный. У таких пациентов часто возникают потери сознания и проявления СН. При отсутствии лечения AV-блокада II степени на уровне ниже пучка Гиса имеет плохой прогноз, блокада у таких пациентов часто прогрессирует до более высоких степеней, появляется симптоматика с потерей сознания. У пациентов с приобретенной полной AV-блокадой без лечения часто отмечают симптоматику независимо от уровня блокады (табл. 5.2).
Согласно электрокардиографической классификации внутрижелудочковая проводящая система состоит из 3 пучков: переднего и заднего пучков левой ножки пучка Гиса и правой ножки пучка Гиса. Анатомическая основа деления проводящей системы у человека на 3 пучка не совсем понятна. Пациенты с двухпучковой блокадой имеют повышенный риск развития полной трехпучковой блокады.
Таблица 5.2
Рекомендации по проведению ЭФИ у пациентов с приобретенной AV-блокадой
| Показания | Клинические группы пациентов |
| Абсолютно показано |
|
| Показано |
|
| Не показано |
|
Внезапная смерть пациентов с двухпучковой блокадой может быть вызвана не только развитием полной трехпучковой блокады, но также и развитием желудочковых тахиаритмий. Последние могут играть важную роль у пациентов с прогресирующим заболеванием сердца и двухпучковой блокадой. По этой причине ЭФИ пациентов с дефектами внутрижелудочкового проведения и необъяснимыми симптомами должно также включать исследование AV-проводящей системы и оценку функции синусного узла, а также программированную предсердную и желудочковую стимуляцию с целью провокации тахиаритмии для выявления склонности к развитию как брадиаритмий, так и тахиаритмий (табл. 5.3).
Таблица 5.3
Рекомендации по проведению ЭФИ
| Показания | Клинические группы пациентов |
| Абсолютно показано | Пациенты с наличием клинических симптомов, у которых причина симптомов не установлена |
| Показано | Пациенты, не имеющие симптомов, с блокадой ветви пучка Гиса, если планируется проведение фармакотерапии, которая может увеличить задержку проведения или вызвать AV-блокаду |
| Не показано |
|
ЭФИ В ДИАГНОСТИКЕ ПАЦИЕНТОВ С ТАХИКАРДИЕЙ И ШИРОКИМИ КОМПЛЕКСАМИ QRS
При широких комплексах QRS (>120 мс) важно дифференцировать наджелудочковую тахикардию от желудочковой тахикардии. Для отличия наджелудочковых тахикардий от желудочковых стойкие симптомы тахикардии непоказательны. Если диагноз наджелудочковой тахикардии невозможно подтвердить или установить, то тахиаритмию следует расценивать как желудочковую тахикардию и лечить соответственно.
Тахикардия с широкими комплексами QRS может быть разделена на 3 группы: наджелудочковая тахикардия с блокадой ножек пучка Гиса, наджелудочковая тахикардия с проведением по дополнительному предсердно-желудочковому соединению и желудочковая тахикардия. ЭФИ позволяет точно диагностировать практически все тахикардии с широкими комплексами, а также определить последовательность и соотношение между активацией предсердий и желудочков. При этом можно зарегистрировать электрограммы от структур, которые не отображаются на стандартной ЭКГ (таких как пучок Гиса или дополнительные пути проведения), а также могут быть проанализированы ответы на разные пробы со стимуляцией. Поскольку знание механизма аритмии обычно имеет критическое значение для выбора надлежащей терапии, ЭФИ часто занимают важное место в клинической диагностике у пациентов, имеющих тахикардии с широкими комплексами (табл. 5.4).
Таблица 5.4
Рекомендации по проведению ЭФИ у пациентов с тахикардией и широкими комплексами QRS
| Показания | Клинические группы пациентов |
| Абсолютно показано | Пациенты с тахикардией и широкими комплексами QRS, с неустановленным точным диагнозом (после анализа доступных записей ЭКГ), установление которого необходимо для выбора тактики лечения |
| Не показано | Пациенты с желудочковой тахикардией или наджелудочковыми тахикардиями с аберрантным проведением или синдромом предвозбуждения, которые диагностируются на основании четких критериев ЭКГ и относительно которых данные ЭФИ не повлияют на выбор терапии. Тем не менее данные, полученные при начальном ЭФИ, у этих пациентов могут рассматриваться как руководство к дальнейшей терапии |
ЭФИ В ДИАГНОСТИКЕ ПАЦИЕНТОВ С ТАХИКАРДИЕЙ И УЗКИМИ КОМПЛЕКСАМИ QRS
Таблица 5.5
Рекомендации по проведению ЭФИ у пациентов с тахикардией и узкими комплексами QRS
| Показания | Клинические группы пациентов |
| Абсолютно показано |
|
| Показано | Пациенты с частыми эпизодами тахикардии, которые нуждаются в медикаментозном лечении, относительно которых есть предположение о проаритмическом эффекте препаратов или о влиянии антиаритмических препаратов на синусный узел или AV-проведение |
| Не показано | Пациенты с тахикардиями, вагусными пробами, которые легко контролируются, и/или хорошо переносимой лекарственной терапией, которые не являются кандидатами на немедикаментозное лечение |
ЭФИ У ПАЦИЕНТОВ С УДЛИНЕННЫМ ИНТЕРВАЛОМ Q-T
Удлинение интервала Q–T, связанное с потенциальной угрозой возникновения опасных для жизни аритмий, может регистрироваться постоянно или периодически как проявление врожденного синдрома удлиненного интервала Q–T или может возникать вследствие метаболических, токсических или патофизиологических факторов. ЭФИ имеет ограниченное значение для выявления, постановки диагноза или подбора терапии при врожденном или приобретенном удлинении интервала Q–T. ЭФИ у пациентов с врожденным синдромом удлиненного Q–T нередко приводит к запуску желудочковых аритмий, тогда как его диагностическое значение невысоко или отсутствует совсем (табл. 5.6).
Таблица 5.6
Рекомендации для проведения ЭФИ у пациентов с удлиненным интервалом Q–T
| Показания | Клинические группы пациентов |
| Показано |
|
| Не показано |
|
НАДЖЕЛУДОЧКОВЫЕ ТАХИКАРДИИ ПРИ ДОПОЛНИТЕЛЬНЫХ ПУТЯХ ПРОВЕДЕНИЯ
Дополнительные пути Кента и Джеймса
- Навязывание ритма предсердия, постоянно возрастающего по частоте, или нанесение отдельных стимулов с постоянным укорочением интервала сцепления при наличии пучка Кента приводит к росту выраженности волны дельта, интервал Р — дельта-волна остается стабильным. При этом как для пучка Кента, так и для пучка Джеймса характерен на определенном этапе скачкообразный переход проведения импульсов лишь по дополнительному предсердно-желудочковому соединению.
- Программированная стимуляция предсердия, вызывая пароксизм тахикардии, не выявляет отличитальных особенностей, присущих AV-узловой тахикардии, то есть внезапного удлинения интервала А–Н или появления периодики Венкебаха.
- Программированная стимуляция желудочка не сопровождается увеличением времени ретроградного проведения возбуждения на предсердие, которое отражает его распространение по дополнительному предсердно-желудочковому соединению, а не по AV-узлу.
- Выявляет нарушение последовательности ретроградного распространения волны возбуждения на предсердие. Это проявляется тем, что потенциал левого предсердия регистрируется раньше, чем правого.
- Дополнительным признаком является регистрация нижнепредсердного потенциала на гисограмме после желудочкового комплекса в отличие от узловой тахикардии, при которой этот потенциал по времени возникновения совпадает с желудочковым.
Дополнительный путь Махайма
- Потенциал Н на гисограмме по времени возникновения совпадает с деформированным желудочковым комплексом в отведении электрограммы от желудочка и предшествует ему, тогда как регистрируемый комплекс QRS нормальной формы.
- Частая стимуляция предсердия приводит к удлинению интервала P–Q и укорочению интервала H–V или даже к его слиянию с желудочковым комплексом, что сочетается с возникновением его аберрации по типу блокады одной из ножек пучка Гиса.
- Аберрантный желудочковый комплекс нормализуется после введения атропина или на фоне стимуляции пучка Гиса.
ЭФИ у пациентов с WPW-синдромом
Рекомендации по проведению ЭФИ у пациентов с WPW-синдромом приведены в табл. 5.7.
Таблица 5.7
Рекомендации по проведению ЭФИ у пациентов с WPW-синдромом
| Показания | Клинические группы пациентов |
| Абсолютно показано |
|
| Показано |
|
| Не показано | Пациенты с предвозбуждением желудочков, не имеющие симптомов, за исключением описанных выше |
ЭФИ У ПАЦИЕНТОВ С ЖЕЛУДОЧКОВЫМИ ЭКСТРАСИСТОЛАМИ, ПАРНЫМИ ЭКСТРАСИСТОЛАМИ И НЕСТОЙКОЙ ЖЕЛУДОЧКОВОЙ ТАХИКАРДИЕЙ
Таблица 5.8
Рекомендации по проведению ЭФИ у пациентов с желудочковыми экстрасистолами, парными экстрасистолами и нестойкой желудочковой тахикардией
| Показания | Клинические группы пациентов |
| Показано |
|
| Не показано | Пациенты с единичными парными желудочковыми экстрасистолами или нестойкой желудочковой тахикардией при отсутствии симптомов или неяркой их выраженности, без других факторов риска развития стойких аритмий |
Пароксизмальные желудочковые тахикардии
- Наличие предсердно-желудочковой диссоциации, которая регистрируется на электрограмме пучка Гиса. Этот критерий является очень важным, но не абсолютным, так как выявляется, хотя и очень редко, при наджелудочковых тахикардиях с аберрантной желудочковой проводимостью.
- Отсутствие потенциала Н перед желудочковыми комплексами или значительное укорочение интервала Н–V на гисограмме.
- Частая и программированная стимуляция ПЖ в большинстве случаев приводит к возникновению желудочковой тахикардии. Конфигурация комплексов при этом аналогична тем, которые возникают во время спонтанно возникшего приступа.
- Программированная стимуляция желудочков в большинстве случаев приводит к прекращению тахикардии. Желудочковая тахикардия с частотой ритма <175 уд./мин прекращается отдельными электростимулами или с помощью навязывания искусственного желудочкового ритма небольшой частоты. Для ее прекращения при тахикардии >175 уд./мин используют парные стимулы или частую стимуляцию желудочков.
ЭФИ У ПАЦИЕНТОВ С НЕОБЪЯСНИМОЙ ПОТЕРЕЙ СОЗНАНИЯ
Таблица 5.9
Рекомендации по проведению ЭФИ у пациентов с необъяснимой потерей сознания
| Показания | Клинические группы пациентов |
| Абсолютно показано | Пациенты с возможным структурным поражением сердца и потерей сознания, причина которой остается неясной после тщательного обследования |
| Показано | Пациенты с повторной потерей сознания неясной природы, не имеющие структурного поражения сердца, с отрицательным результатом тилт-теста (пассивной ортопробы), ортопробы, которая проводится на столе с изменяющимся углом наклона |
| Не показано | Пациенты с известной причиной потери сознания, у которых ЭФИ не повлияет на проводимое лечение |
ЭФИ У ПАЦИЕНТОВ, ВЫЖИВШИХ ПОСЛЕ ОСТАНОВКИ СЕРДЦА
Таблица 5.10
Рекомендации по проведению ЭФИ у пациентов, выживших после остановки сердца
| Показания | Клинические группы пациентов |
| Абсолютно показано |
|
| Показано |
|
| Не показано |
|
ЭФИ У ПАЦИЕНТОВ С НЕОБЪЯСНИМЫМ СЕРДЦЕБИЕНИЕМ
Таблица 5.11
Рекомендации по проведению ЭФИ у пациентов с необъяснимым сердцебиением
| Показания | Клинические группы пациентов |
| Абсолютно показано |
|
| Показано | Пациенты с клинически значительным сердцебиением, возможно, кардиального происхождения, у которых симптоматика носит спорадический характер и не может быть зафиксирована документально. Исследование проводится для уточнения механизма аритмии, установления необходимости проведения терапии или оценки прогноза |
| Не показано | Пациенты, у которых подтверждена некардиальная причина сердцебиения (например гипертиреоз) |
ЭФИ ПРИ ПОДБОРЕ АНТИАРИТМИЧЕСКОЙ ТЕРАПИИ У РАЗНЫХ ГРУПП ПАЦИЕНТОВ
ЭФИ позволяет серийно оценивать вызванные лекарственными препаратами изменения проводимости и рефрактерности тканей сердца, а также особенности аритмий, включая индуцированность; при индуцированных аритмиях — оценить частоту, морфологию и гемодинамические последствия. После базового исследования (желательно без препаратов), в течение которого индуцируется аритмия, назначается препарат и повторяется электрическая стимуляция. Предполагается, что вызванное антиаритмическим препаратом снижение возможности повторно индуцировать аритмию свидетельствует об отсутствии рецидивов аритмии. Наоборот, если аритмия остается индуцированной, то достоверность повтора аритмии выше, чем в группе больных, где удалось достичь ее прекращения препаратами. Такой подход используется прежде всего у пациентов со стойкими желудочковыми тахикардиями и у пациентов, которые выжили после остановки сердца, хотя проведение ЭФИ возможно и у пациентов с наджелудочковыми аритмиями (табл. 5.12).
Таблица 5.12
Рекомендации по проведению ЭФИ при подборе антиаритмической терапии у разных групп пациентов
| Показания | Клинические группы пациентов |
| Абсолютно показано |
|
| Показано |
|
| Не показано |
|
ЭФИ У ПАЦИЕНТОВ, ЯВЛЯЮЩИХСЯ КАНДИДАТАМИ ИЛИ УЖЕ ИМЕЮЩИХ ИМПЛАНТИРОВАННЫЕ АНТИАРИТМИЧЕСКИЕ УСТРОЙСТВА
Таблица 5.13
Рекомендации по проведению ЭФИ у пациентов, являющихся кандидатами или уже имеющих имплантированные антиаритмические устройства
| Показания | Клинические группы пациентов |
| Абсолютно показано |
|
| Показано | Пациенты с ранее документированными показаниями к имплантации кардиостимулятора для подбора наиболее соответствующих режимов и мест долгосрочной кардиостимуляции, исходя из влияния последних на симптоматику и гемодинамику |
| Не показано | Пациенты, которые не являются кандидатами для имплантации |
ЛИТЕРАТУРА
- Бредикис Ю.Ю. (1967) Электрическая стимуляция сердца в клинической практике. М: Медицина, 200 с.
- Бредикис Ю.Ю., Дрогайцев А.Д., Стирбис П.П. (1983) Физиологическая электростимуляция сердца: Обзор. Кардиология, 9, 114-118.
- Емельяненко В.М., Ефремов А.И., Кофаль Л.А. и др. (1995) Критерии клинической оценки тяжести нарушений ритма сердца. Клин мед и патофизиол; 2, 92-93.
- Ревишвили А.Ш. (1990) Электрофизиологическая диагностика и хирургическое лечение наджелудочковых тахиаритмий. Кардиология, 11, 56-59.
- Черняк Б.А., Никитина Т.Н., Фукс Р.А. и др. (1983) Клинико-функциональная характеристика синдрома преждевременной реполяризации желудочков. Тер арх; 4, 57-61.
- Шевченко Н.М. (1997) Рациональная кардиология, М., Стар’Ко, 256 с.
- Шубик Ю.В. (1999) Неинвазивное электрофизиологическое исследование при аномалиях проводящей системы сердца. СПб., ИНКАРТ, 84 с.
- Akhtar M., Achord J.L., Reynolds W.A. (1994) Clinical competence in invasive cardiac electrophysiological studies. ACP/ACC/AHA Task Force on Clinical Privileges in Cardiology. J Am Coll Cardiol; 23, 1258-1261.
- Andresen D., Steinbeck G., Habort R. et al. (1990) Programmed ventricular stimulation: Prognostic volue of noninducibility in patients with malignant ventricular tachyarhythmias. Eur. Heart J., Vol. 11, Abstr. Suppl. 3.
- Blomstrm-Lundqvist, Scheinman М.М. et al. ACC/AHA/ESC Guidelines for the Management of Patients With Supraventricular Arrhythmias — Executive Summary A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Supraventricular Arrhythmias).
- Brembilla-Perrot B., Spatz F., Khaldi E. et al. (1990) Value of esophageal pacing in evaluation of supraventricular tachycardia. Am. J. Cardiol.; 65, 322-330.
- Flowers N.C., Abildskov J.A., Armstrong W.F. et al. (1991) ACC policy statement: recommended guidelines for training in adult clinical cardiac electrophysiology. Electrophysiology. Electrocardiography Subcommittee, American College of Cardiology. J Am Coll Cardiol; 18, 637-640.
- Gallagher J.J., Smith W.M., Kerr C.R. et al. (1982) Esophageal pacing: a diagnostic and therapeutic tool. Circulation. Vol. 65, 2, 336-341.
- Hall R.J.C., Boyle R.M., Webb-Peploe M. et al. (1995) Guidelines for specialist training in cardiology. Council of the British Cardiac Society and the Specialist Advisory Committee in Cardiovascular Medicine of the Royal College of Physicians. Br Heart J; 73, 1-24.
- Hindricks G., for the Multicentre European Radiofrequency Survey (MERFS) investigators of the Working Group on Arrhythmias of the European Society of Cardiology (1993) The Multicentre European Radiofrequency Survey (MERFS): complications of radiofrequency catheter ablation of arrhythmias, fur Heart J; 14, 1644-1653.
- Horowitz L.N., Josephson M.E. (1990) Intracardiac electriphysiological tidy as a method of optimization of drug therapy in chronic V.T. Progr. Cardiovasc. Res. Vol. 2, 381-389.
- Josephson M.E., Maloney J.D., Barold S.S. (1995) Guidelines for training in adult cardiovascular medicine. Core Cardiology Training Symposium (COCATS) Task Force 6: training in specialized electrophysiology, cardiac pacing and arrhythmia management. J Am Coll Cardiol; 25, 23-26.
- Miller J.M. (1996) Therapy of Wolff-Parkinson-White syndrome and concealed bypass tracts. J Cardiovasc Electrophysiol., Vol. 7, 1, 85-93.
- Santini M., Ansalone G., Cacciatore G. et al. (1990) Transesophageal pacing. PACE, Vol. 13, 10, 1298-1323.
- Snezhitsky V.A., Baranovsky P.A., Roman T.S. et al. (1994) Transesophageal atrial programmed pacing for assessment of atrioventricular conduction function. RBM, Vol. 16, 3-4, 120-123.
- Zipes D.P., DiMarco J.P., Gillette P.C. et al. (1995) Guidelines for clinical intracardiac electrophysiological and catheter ablation procedures. A report of the American College of Cardiology. American Heart Association Task Force on practice guidelines. J Cardiovasc Electrophysiol., Vol. 6, 8, 652-679.
- Zipes D.P., DiMarco J.P., Gillette P.C. et al. (1995) Guidelines for clinical intracardiac electrophysiological and catheter ablation procedures: a report of the American College of Cardiology. American Heart Association Task Force on Practice Guidelines (Committee on Clinical Intracardiac Electrophysiologic and Catheter Ablation Procedures), developed in collaboration with the North American Society of Pacing and Electrophysiology. J Am Coll Cardiol; 26, 555-573.