Несмотря на безусловные достижения в лечении заболеваний сердца, разработку новых и совершенных технологий диагностики и лечения, проблема внезапной сердечной смерти даже в развитых странах до сих пор остается нерешенной. Около 13% случаев смерти от всех причин возникают внезапно, а 88% из них обусловлены внезапной сердечной смертью. В развитых странах ежегодно внезапно умирает 1 из 1 тыс. взрослых лиц.
Причиной обращения экспертов к этой проблеме стало появление и накопление большого количества новых данных (по результатам больших рандомизированных и проспективных исследований) о внезапной смерти как у пациентов с ИМ и СН, так и у лиц с более редкими заболеваниями, при которых внезапная смерть также является частым осложнением. Рекомендации по лечению желудочковых аритмий и профилактике внезапной сердечной смерти были предложены Европейским обществом кардиологов (ЕОК) в 2006 г. в качестве базовых для разработки национальных рекомендаций обществами — членами ЕОК. Предложенные методы как первичной, так и вторичной профилактики базируются на четкой стратификации факторов риска, подтверждены результатами проведенных за последнее время международных мультицентровых исследований.
Конечно, соотношение стоимость/эффективность, а также возможности реального внедрения существующих подходов к профилактике внезапной сердечной смерти зависят от уровня общественного развития и медицинских технологий. Поэтому использовать рекомендации в полном объеме в Украине сегодня невозможно (особенно относительно применения имплантированных искусственных кардиовертеров-дефибрилляторов). Но, учитывая современные тенденции интеграции Украины с европейскими странами, отечественные специалисты должны быть ознакомлены со всеми новейшими технологиями, чтобы иметь возможность обсуждать с пациентом все существующие возможности для предотвращения смерти.
СОВРЕМЕННАЯ КЛИНИЧЕСКАЯ ТЕРМИНОЛОГИЯ ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ
Термин «внезапная сердечная смерть» использовали на протяжении нескольких столетий и столько же времени велась полемика о его определении. Поводом для дебатов всегда был вопрос, когда неожиданную смерть следует называть внезапной и каким образом установить кардиальное происхождение смерти. Было предложено несколько критериев для связи внезапной сердечной смерти с определенным видом таковой. Ключевые концепции, являющиеся центральными при определении внезапной смерти, — нетравматический характер случая и тот факт, что внезапная смерть неожиданна и мгновенна. Чтобы уточнить термин «внезапная сердечная смерть», было введено слово «кардиальная». Дальнейшая субклассификация была создана с целью разграничения коронарного и некоронарного генеза внезапной сердечной смерти. Вначале было предложено считать внезапной смертью случай с клиническими проявлениями до 24 ч, но в дальнейшем этот срок был уменьшен до 1 ч или даже мгновения, чтобы объяснить наиболее вероятный аритмический механизм внезапной смерти. Вследствие этого появилось большое несоответствие в определениях, которые используют в разных клинических исследованиях. Проблемы, связанные с определением способа смерти, были предметом дебатов для многих авторов. Очень сложно классифицировать случаи смерти, которые происходят без свидетелей, как, например, «найденный мертвым в кровати». Большинство авторов ошибались, относя такие события к внезапной сердечной смерти, даже потому, что часто невозможно определить, сколько времени пациент оставался живым или на протяжении какого периода он ощущал симптомы, предшествующие смерти.
В рекомендациях ЕОК внезапную сердечную смерть определяют как «естественную смерть вследствие сердечных причин, которой предшествует внезапная потеря сознания на протяжении 1 ч от начала острых симптомов; возможно диагностирование предшествующего заболевания сердца, но время и способ наступления смерти неожиданные».
В классификации сердечно-сосудистых заболеваний Ассоциации кардиологов Украины внезапная сердечная смерть нашла свое отражение и согласована с МКБ 10-го пересмотра:
Внезапная сердечная смерть (аритмическая) — I46.1 (смерть, которая наступила на протяжении 1 ч после появления первых симптомов заболевания или существенного ухудшения состояния больного на фоне стабильного хронического течения заболевания):
- с восстановлением сердечной деятельности:
-
- фибрилляция желудочков;
- асистолия;
- электромеханическая диссоциация (отмечается по возможности);
- внезапная сердечная смерть (необратимая):
-
- фибрилляция желудочков;
- асистолия;
- электромеханическая диссоциация (отмечается по возможности).
Остановка сердца (смерть, которая наступила позже, чем через 1 ч после появления или увеличения выраженности симптомов заболевания):
- с восстановлением сердечной деятельности I45.0;
- остановка сердца (необратимая) I46.9.
В качестве примера — клинический диагноз: аритмогенная дисплазия ПЖ, стойкая мономорфная желудочковая тахикардия, внезапная сердечная смерть (аритмическая), необратимая (фибрилляция желудочков, асистолия, 6.12.2002).
Во многих случаях внезапная сердечная смерть является первым, но вместе с тем фатальным проявлением заболевания сердца, и потому основное направление исследований — поиск маркеров риска и путей эффективной профилактики внезапной сердечной смерти.
Клинические проявления внезапной сердечной смерти зависят от наличия определенного механизма. Согласно результатам одного из исследований, среди общего количества 157 амбулаторных больных, которые перенесли внезапную сердечную смерть во время проведения холтеровского мониторирования, смертельные случаи были вследствие желудочковых фибрилляций — 62,4%, брадиаритмии — 16,5%, пируэт-тахикардии — 12,7%, первичной желудочковой тахикардии — 8,3%. Изменение сегмента ST отмечено у 12,6%. Чем более точно установлен механизм, тем эффективнее могут быть профилактические меры. Хоть и доказано, что в большинстве случаев внезапной смерти после ИМ основной причиной являются тахиаритмии, есть другие механизмы, которые могут приводить к внезапной смерти, например разрыв аорты, разрыв субарахноидальной аневризмы, разрыв сердца и его тампонада, массивная легочная эмболия и прочие. С другой стороны, смерть может все же быть аритмогенной по природе, но не возникает внезапно, например пациент, умирающий в больнице от гемодинамического коллапса и осложнений при стойкой желудочковой тахикардии.
ЭПИДЕМИОЛОГИЯ
Наиболее важной причиной смерти среди взрослого населения промышленного мира является внезапная сердечная смерть при ИБС. Около 5–10% случаев внезапной сердечной смерти возникают при отсутствии ИБС и СН. Частота случаев возникновения внезапной сердечной смерти в разных исследованиях колеблется в диапазоне 0,36–1,28 на 1 тыс. жителей/год. В этих исследованиях были рассмотрены только больные, реанимированные службой неотложной помощи, или факт внезапной смерти был констатирован свидетелями, поэтому приведенные данные ниже реальных показателей внезапной сердечной смерти в общей популяции.
Случаи возникновения внезапной сердечной смерти вне больницы зависят от возраста, пола и наличия или отсутствия в анамнезе сердечно-сосудистых заболеваний. У мужчин в возрасте 60–69 лет с предшествующим анамнезом заболевания сердца уровень возникновения внезапной сердечной смерти составляет 8 на 1 тыс. населения/год. Были изучены случаи остановки сердца вне больницы у лиц в возрасте 20–75 лет. 21% всех летальных исходов были внезапными и неожиданными у мужчин и 14,5% — у женщин. 80% негоспитальных случаев смерти возникли дома и около 20% — на улице или в общественных местах. При исследовании 300 тыс. случаев внезапной смерти в США отмечено, что их среди населения было немногим более 1 на 1 тыс. в год.
Наиболее распространенной причиной внезапной сердечной смерти является острый коронарный синдром; у 25% больных с ИБС, умерших внезапно, внезапная сердечная смерть является первым и единственным проявлением заболевания. На внезапную сердечную смерть приходится также 40–50% случаев смерти больных с СН. У пациентов в постинфарктный период при высоком риске (данные исследований EMIAT, CAMIAT, TRACE, SWORD, DINAMIT) совокупная внезапная аритмическая смертность достигла ориентировочно 5% за 1 год и 9% за 2 года, в то время как кардиальная смерть неаритмического генеза составила соответственно 4 и 7%. Формированию внезапной сердечной смерти способствует ГЛЖ.
Вместе с тем почти в 12% случаев причина внезапной сердечной смерти остается неустановленной, учитывая, что при аутопсии или после всестороннего медицинского обследования пациентов, перенесших остановку сердца, признаков сердечного заболевания не выявляют. Процент пациентов, умирающих внезапно без диагностированного заболевания сердца, наибольший в молодом возрасте. Время от времени появляются сообщения о случаях внезапной сердечной смерти среди известных спортсменов, казалось бы, лиц с отличным состоянием здоровья. С эпидемиологической точки зрения внезапная сердечная смерть в молодом возрасте, прежде всего у лиц без клинических признаков заболевания сердца, имеет ограниченное значение, поскольку на нее приходится лишь незначительная часть случаев внезапной сердечной смерти, регистрирующихся в общей популяции. Впрочем, жертвами внезапной сердечной смерти становятся практически здоровые люди, преждевременная смерть которых имеет трагические последствия для семьи и общества. Заболевания и состояния, при которых чаще всего развивается внезапная сердечная смерть, приведены в табл. 6.1.
Таблица 6.1
Заболевания и состояния, при которых чаще всего развивается внезапная сердечная смерть
|
ПУТИ ПРЕДОТВРАЩЕНИЯ ЗАБОЛЕВАНИЙ СЕРДЦА, УМЕНЬШАЮЩИХ СКЛОННОСТЬ К ВОЗНИКНОВЕНИЮ ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ
В целях профилактики большому контингенту населения необходимо рекомендовать общие советы относительно образа жизни (учитывая соотношение стоимость/польза лечения). Наибольшая возможность уменьшить количество внезапной сердечной смерти в популяции состоит в уменьшении распространенности ИБС. Группы высокого риска среди населения следует идентифицировать отдельно. Идентификация и лечение таких пациентов — основная задача современной кардиологии.
Типы профилактики внезапной сердечной смерти по-разному рассматривают в эпидемиологических и клинических исследованиях. С точки зрения эпидемиологов, первичная профилактика состоит в предотвращении возникновения заболевания и факторов риска, вторичная — в выявлении бессимптомного заболевания и применении соответствующих терапевтических мероприятий с целью предотвращения его прогрессирования. Эпидемиологи используют также термин «третичная профилактика», обозначая им мероприятия, направленные на предотвращение дальнейшего ухудшения состояния больного или возникновение осложнений после того, как заболевание уже проявилось определенными признаками.
С клинической точки зрения первичная профилактика внезапной сердечной смерти должна быть направлена на предупреждение острого коронарного синдрома (основной причины внезапной сердечной смерти) и других состояний, способствующих формированию стойкого или динамического аритмогенного субстрата в миокарде желудочков. В отличие от эпидемиологических исследований, где предотвращение внезапной смерти аритмического генеза у лиц, перенесших ИМ, или у пациентов с дисфункцией ЛЖ рассматривают как третичную профилактику, в клинической практике термин «третичная профилактика» не применяют. Под первичной профилактикой клиницисты подразумевают терапевтические мероприятия с целью предупреждения внезапной сердечной смерти у пациентов, у которых, несмотря на структурное заболевание сердца, никогда ранее не выявляли злокачественных желудочковых тахиаритмий, а под вторичной профилактикой — меры по предотвращению внезапной сердечной смерти у лиц, реанимированных после эпизода внезапной сердечной смерти или после перенесенных эпизодов жизненно опасных аритмий сердца.
Профилактика внезапной сердечной смерти включает мероприятия, которые осуществляются на разных уровнях (этапах):
- предотвращение заболеваний сердца, повышающих склонность к возникновению внезапной сердечной смерти;
- раннее выявление и устранение состояний, повышающих склонность к возникновению внезапной сердечной смерти.
- стратификация риска у пациентов с заболеваниями сердца, в том числе с желудочковыми нарушениями ритма, с целью выявления и защиты лиц с наиболее высокой степенью риска;
- немедленная и эффективная реанимация в случае внезапной сердечной смерти;
- лечение лиц, которые перенесли эпизод внезапной сердечной смерти и были успешно реанимированы.
Безусловно, на каждом последующем этапе круг пациентов, которым могут быть проведены соответствующие лечебно-профилактические мероприятия, становится все более узким. С другой стороны, повышается показатель абсолютного риска и потому улучшается соотношение стоимости и эффективности профилактических мероприятий.
ФАКТОРЫ РИСКА ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ В ПОПУЛЯЦИИ
Популяционные исследования во многих промышленных странах продемонстрировали, что факторы риска внезапной сердечной смерти — преимущественно такие же, как и ИБС: повышение уровня общего ХС и ЛПНП, АГ, курение и сахарный диабет. Во многих исследованиях пытались идентифицировать факторы риска, которые помогли бы достоверно прогнозировать внезапную сердечную смерть в противоположность острому ИМ и/или другим проявлениям коронарной болезни в подгруппах населения без диагностированной болезни сердца. В некоторых исследованиях также упоминается в качестве специфического фактора риска — повышение ритма сердца и большое количество потребления алкоголя.
Внезапная сердечная смерть при отсутствии признаков структурного заболевания сердца
При наличии адекватных диагностических средств и достаточной настойчивости исследователей даже в случаях внезапной сердечной смерти без наличия сердечной патологии можно выявить нарушение структурно-функционального состояния миокарда. Независимыми механизмами патогенеза внезапной сердечной смерти у молодых людей являются преходящее действие триггеров (запускающих факторов), врожденные или приобретенные нарушения реполяризации, а также трудно диагностируемые доступными инструментальными исследованиями изменения миокарда (табл. 6.2).
Таблица 6.2
Факторы формирования внезапной сердечной смерти у пациентов без признаков структурного заболевания сердца
| Основные группы факторов формирования внезапной сердечной смерти |
Факторы и клинические синдромы |
| I. Преходящие триггерные события | Токсические, метаболические, электролитный дисбаланс
Вегетативные и нейрофизиологические нарушения Ишемия или реперфузия Гемодинамические изменения |
| II. Нарушение реполяризации высокого риска | Врожденный синдром удлиненного интервала Q–T
Приобретенный синдром удлиненного интервала Q–T Аритмогенное действие препаратов; взаимодействие лекарственных веществ |
| III. Клинически скрытое заболевание сердца | Недиагностированное
Которое не удается диагностировать |
| IV. Идиопатическая фибрилляция желудочков | Не установлены |
Очевидно, по мере выявления этих механизмов диапазон случаев идиопатической фибрилляции желудочков будет постепенно уменьшаться, а возможности индивидуализированной профилактики внезапной сердечной смерти расширяться.
Частота встречаемости внезапной сердечной смерти в зависимости от возраста пациентов
Соотношение этиологических факторов и распространенность внезапной сердечной смерти, безусловно, зависят от возраста. Ведущие причины внезапной сердечной смерти в возрасте до 35 лет — миокардит, ГКМП, врожденный синдром удлиненного интервала Q–T, аритмогенная дисплазия ПЖ, синдром Бругада, идиопатическая фибрилляция желудочков. В возрасте старше 40 лет распространенность внезапной сердечной смерти в популяции стремительно повышается, а среди причин внезапной сердечной смерти доминируют ИБС и кардиомиопатии. У пациентов, ранее перенесших острый коронарный синдром, вероятность внезапной сердечной смерти составляет 5% в год, с ФВ ЛЖ — <35% и/ или СН — 20%, после перенесенной остановки сердца или опасных для жизни нарушений ритма с успешной реанимацией — 25%, у пациентов из группы высокого риска после перенесенного ИМ — свыше 30% в год. Еще раз подчеркнем, что в общей популяции взрослых лиц вероятность внезапной сердечной смерти составляет в среднем 1 случай на 1 тыс. в год, и внезапная сердечная смерть является одной из основных причин смерти в развитых странах. Эти данные свидетельствуют о важности профилактики внезапной сердечной смерти как глобальной медико-социальной проблемы.
Гипертензия и ГЛЖ
Гипертензия — известный фактор риска ИБС, но несколько эпидемиологических исследований показали, что она играет непропорциональную роль в повышении риска внезапной сердечной смерти. Эффект снижения АД на возникновение внезапной сердечной смерти четко не был установлен с помощью рандомизированных исследований из-за небольшого количества исследованных и недостаточно высокого риска кардиальной смерти. Основной механизм, посредством которого АГ приводит к внезапной сердечной смерти, — это ГЛЖ. Другие детерминанты ГЛЖ включают возраст, ожирение, высокой уровень глюкозы в крови и генетические факторы.
Липиды
Эпидемиологическая связь между повышенным уровнем ХС (ХС ЛПНП) и риском всех проявлений ИБС, включая внезапную сердечную смерть, хорошо известны. Поэтому одна из стратегий оценки вероятности внезапной сердечной смерти — популяционный подход с целью лучшего выявления ИБС и субклинических структурных изменений миокарда. В этом случае стратификация риска внезапной сердечной смерти является неотъемлемой частью оценки общего риска у пациентов с ИБС. Осуществление скринингового обследования, и особенно вмешательство с целью коррекции факторов риска ИБС во всей популяции, связано с естественными трудностями. Более реально и перспективно обследование и вмешательство у четко определенных контингентов. Примером такого скрининга могут быть оценка липидного профиля и регистрация ЭКГ у спортсменов высокой квалификации. Очевидно, выбор того или иного контингента для скринингового обследования, а также его объем зависят от соотношения стоимости и ожидаемой эффективности.
Поскольку наиболее распространенной причиной внезапной смерти является ИБС, логично предположить, что в предотвращении внезапной сердечной смерти наибольший эффект может дать коррекция ишемии и связанных с ней состояний, в частности оглушенного вследствие реперфузионного повреждения или гибернированного миокарда. В этих случаях профилактика внезапной сердечной смерти не может рассматриваться как самостоятельное направление лечения ИБС, а является одним из положительных следствий адекватной противоишемической терапии. По данным ряда исследований, реваскуляризация сердечной мышцы методами АКШ или перкутанной транслюминальной коронарной ангиопластики позволяет не только улучшить функциональное состояние и качество жизни, но и уменьшить количество различных конечных точек у больных с ИБС и критическими стенозами коронарных артерий, в том числе вероятность развития у них внезапной сердечной смерти. Наличие миокарда, который плохо сокращается, но остается жизнеспособным (гибернированным), является независимым фактором риска внезапной сердечной смерти, восстановление же коронарного кровоснабжения позволяет снизить чувствительность желудочков. Установлено, что адекватная коррекция ишемии миокарда особенно эффективна для предупреждения внезапной сердечной смерти у пациентов с такими клиническими показателями:
1) функция ЛЖ относительно сохранена (ФВ ЛЖ 40–45%), без аневризмы;
2) во время перенесенного ранее эпизода внезапной сердечной смерти была зарегистрирована фибрилляция желудочков;
3) при внутрисердечном ЭФИ не индуцировалась стойкая мономорфная желудочковая тахикардия, но индуцировалась фибрилляция желудочков;
4) при нагрузке воспроизводилась ишемия миокарда;
5) во время коронарографии выявлен критический стеноз сосуда, питающего ишемизированный или гибернированный миокард.
В случае если пациентам с ИБС не может быть проведена полная реваскуляризация либо имеются выраженные изменения функции или геометрии желудочков, так же, как при кардиомиопатиях, преимущественно осуществляют мероприятия, направленные на лечение основного заболевания. Следует отметить, что частота возникновения внезапной сердечной смерти на протяжении последних лет является одной из конечных точек контролируемых исследований эффективности медикаментозных и немедикаментозных средств лечения кардиологических заболеваний, в частности ИБС и СН. В этих исследованиях, соответствующих критериям доказательной медицины, способность снижать риск внезапной сердечной смерти у пациентов после ИМ убедительно доказана для блокаторов β-адренорецепторов, ингибиторов АПФ и статинов, а у пациентов с СН — для ингибиторов АПФ (эналаприл, каптоприл, лизиноприл и др.), блокаторов β-адренорецепторов (метопролол, бизопролол и карведилол) и антагонистов рецепторов альдостерона (спиронолактон). С учетом маркеров риска опасных для жизни аритмий решается вопрос об имплантации автоматического внутреннего искусственного кардиовертера-дефибриллятора.
Диетические факторы
Изучение американскими врачами 20 551 мужчины в возрасте 40–84 лет без ИМ в анамнезе показало, что у пациентов, употребляющих рыбу не менее 1 раза в неделю, относительный риск внезапной сердечной смерти составлял 0,48 (р=0,04) по сравнению с теми, которые употребляли рыбу менее 1 раза в месяц. Этот эффект не зависел от других факторов риска. Доказано, что употребление морских продуктов, содержащих омега-3 жирные кислоты, было также связано со снижением риска внезапной сердечной смерти.
Физическая активность
Связь между значительной нагрузкой и внезапной сердечной смертью хорошо известна, но основные механизмы не установлены. Поскольку риск внезапной сердечной смерти и ИМ, как известно, значительно возрастает во время физической нагрузки, важным для здравоохранения является вопрос о том, снижает ли риск внезапной сердечной смерти регулярное выполнение умеренной физической нагрузки. После коррекции других коронарных факторов риска было установлено, что частота внезапной сердечной смерти у субъектов, регулярно выполняющих умеренную физическую нагрузку (например работа в саду или прогулка) или упражнения повышенной интенсивности на протяжении более 60 мин в неделю, была приблизительно на 70% ниже, чем у лиц, не выполняющих ничего из вышеперечисленного. Эти данные свидетельствуют в пользу регулярной физической активности с целью профилактики внезапной сердечной смерти.
Употребление алкоголя
Так же, как в случае с физическими упражнениями, существует зависимость между употреблением алкоголя и риском внезапной сердечной смерти. Чрезмерное употребление алкоголя, особенно длительное, повышают риск внезапной сердечной смерти. Эту взаимосвязь можно объяснить выявлением удлиненного интервала Q–T у алкоголиков. Однако ряд работ, посвященных этой теме, свидетельствуют о положительном эффекте умеренного (до 30–40 мл/сут в пересчете на этиловый спирт) употребления алкоголя для профилактики внезапной сердечной смерти.
ЧСС и ее вариабельность
Повышение ЧСС и низкая вариабельность сердечного ритма были доказаны как независимые факторы риска внезапной сердечной смерти в проведенных многочисленных исследованиях. Взаимосвязь между повышенной ЧСС и внезапной сердечной смертью отмечена у лиц с/без болезней сердца, с повышенным ИМТ. Снижение вариабельности ритма сердца свидетельствует о дисбалансе вегетативной регуляции сердечного ритма со снижением активности парасимпатического отдела вегетативной нервной системы и дальнейшим снижением порога формирования желудочковых нарушений ритма высоких градаций. Известно, что низкие показатели суточной вариабельности сердечного ритма после острого ИМ (стандартная погрешность интервалов R–R через сутки — <40–50 мс) являются высокочувствительным предвестником уменьшения продолжительности жизни вследствие развития в будущем желудочковой тахикардии и фибрилляции желудочков, даже по сравнению с такими важными прогностическими факторами, как ФВ ЛЖ и регистрация желудочковых нарушений ритма высоких градаций при холтеровском мониторировании ЭКГ.
Табакокурение
Доказано, что табакокурение — независимый фактор риска внезапной сердечной смерти и ИМ. Это касается и пациентов без ИБС. Длительное курение является также независимым фактором риска для повторной внезапной сердечной смерти у пациентов, которые уже перенесли негоспитальную остановку сердца.
Сахарный диабет
В литературе высказываются противоположные мысли относительно того, является ли снижение толерантности к глюкозе или сахарный диабет независимым фактором риска внезапной сердечной смерти. Результаты Австралийского и Парижского проспективного исследования свидетельствуют, что сахарный диабет в анамнезе является значимым фактором риска внезапной сердечной смерти. Напротив, Американское исследование считает диабет фактором риска внезапной сердечной смерти только у больных с доказанной ИБС. В других исследованиях, проведенных в Финляндии и Великобритании, сахарный диабет не был определен как независимый фактор риска внезапной сердечной смерти.
Изменения ЭКГ
12-канальная ЭКГ — простой неинвазивный метод, который можно широко применять во время первичного обследования пациента для оценки сердечно-сосудистого риска. Развитие компьютеризированных алгоритмов анализа делает интерпретацию ЭКГ доступной для врачей некардиологического профиля. Проведенные исследования подтвердили прогностическую ценность депрессии сегмента ST или инверсии зубца Т как маркеров риска сердечно-сосудистой смерти и внезапной сердечной смерти в частности.
Интервал Q–T
Ценным неинвазивным маркером повышенного риска опасных для жизни желудочковых нарушений ритма является увеличение продолжительности интервала Q–T, причем не только как проявление врожденного синдрома удлинения реполяризации желудочков. По данным холтеровского мониторирования ЭКГ внезапной аритмической смерти в ряде случаев непосредственно предшествует непродолжительное удлинение интервала Q–T. Исследователи обращают внимание также на дисперсию Q–T — разницу между наибольшей и наименьшей длительностью интервала Q–T в разных отведениях на поверхностной ЭКГ, зарегистрированной на 12-канальном электрокардиографе. У некоторых больных с дисфункцией или ГЛЖ дисперсия интервала Q–T возрастает до 85–100 мс и более, что может свидетельствовать об электрической негомогенности миокарда, увеличении неоднородности реполяризации и склонности к развитию желудочковых нарушений ритма высоких градаций, особенно при сочетании с другими маркерами аритмогенеза. До настоящего времени нет однозначных рекомендаций по оптимальному методу исследования дисперсии реполяризации желудочков в повседневной клинической практике и ее нормальных показателей. Поэтому данный параметр не учитывали как предиктор развития внезапной сердечной смерти.
ОЦЕНКА КЛИНИЧЕСКОГО И ПРОГНОСТИЧЕСКОГО ЗНАЧЕНИЯ ЖЕЛУДОЧКОВЫХ АРИТМИЙ, МЕТОДЫ ИССЛЕДОВАНИЯ АРИТМОГЕННОГО СУБСТРАТА
Желудочковые нарушения ритма
Проблема желудочковых нарушений ритма занимает особое место в современной кардиологии, что обусловлено как высокой частотой желудочковых нарушений ритма, так и трудностями оценки необходимости их преодоления. Многие десятилетия усилия исследователей были сосредоточены на разработке средств для устранения спонтанных желудочковых нарушений ритма на основании глубокого изучения электрофизиологических механизмов формирования аритмии. Затем в 70-е годы ХХ в. появились новые и чрезвычайно эффективные антиаритмические средства, были введены новые методы подбора и оценки эффективности терапии, в частности холтеровское мониторирование ЭКГ и внутрисердечное ЭФИ. Они обеспечили возможность точной количественной оценки желудочковых нарушений ритма, характеристики морфологических особенностей и субстрата аритмии (табл. 6.3), целенаправленного подбора лечения не только при желудочковой экстрасистолии, но и при опасных для жизни желудочковых тахикардиях.
Таблица 6.3
Клиническая систематизация желудочковых нарушений ритма
| Критерии систематизации | Систематизация |
| I. Количество, морфология и градация желудочковых экстрасистол (Lown B., 1971) | I — одиночные желудочковые экстрасистолы (<30/ч)
II — частые мономорфные желудочковые экстрасистолы (30/ч) III — полиморфные желудочковые экстрасистолы IVa — парные желудочковые экстрасистолы IVb — пробежки желудочковой тахикардии V — ранние (R на T) желудочковые экстрасистолы |
| II. Продолжительность пароксизма желудочковой тахикардии | Пробежка желудочковой тахикардии — 3–5 последовательных желудочковых комплексов
Нестойкая желудочковая тахикардия — 6 и более последовательных желудочковых сокращений длительностью до 29 с с частотой сокращений более 100 уд./мин (длительность цикла менее 600 мс), купирующихся самостоятельно Стойкая желудочковая тахикардия — продолжительность 30 с и/или необходимость купирования в связи с нарушением гемодинамики |
| III. Характер изменений ЭКГ во время пароксизма желудочковой тахикардии | Мономорфная желудочковая тахикардия — с однородной ЭКГ-морфологией комплекса QRS
Полиморфная желудочковая тахикардия — с нестабильной или полиморфной ЭКГ-морфологией комплекса QRS с продолжительностью цикла 600–180 мс Тахикардия re-entry с блокадой ножки пучка Гиса — желудочковая тахикардия по механизму re-entry с вовлечением системы Гиса — Пуркинье, как правило, с ЭКГ-морфологией блокады левой ножки пучка Гиса, которая обычно развивается при наличии кардиомиопатии Пируэт-тахикардия — желудочковая тахикардия, ассоциированная с удлиненным интервалом Q–T или корректированным Q–T, что электрокардиографически характеризуется оборачиванием верхушки комплексов QRS вокруг изоэлектрической линии при аритмии Двунаправленная желудочковая тахикардия — желудочковая тахикардия с отклонением при сокращениях оси комплекса QRS во фронтальной плоскости, часто ассоциированная с интоксикацией сердечными гликозидами |
| IV. Прогностическое значение желудочковых аритмий | Доброкачественные
Потенциально злокачественные Злокачественные |
Переломным событием для клинической аритмологии стало в конце 1980-х годов обобщение результатов многоцентровых исследований CAST. Оказалось, что устранение желудочковой экстрасистолии мощными и эффективными антиаритмическими средствами I класса не позволяло предотвратить внезапную смерть и более того сопровождалось ухудшением долговременного прогноза больных с постинфарктной дисфункцией миокарда, прежде всего за счет повышения опасности проявлений аритмогенного действия. Поэтому в 90-х годах ХХ в. кардинально изменилась стратегия лечения желудочковых нарушений ритма, были пересмотрены показания к применению антиаритмических препаратов у разных категорий больных на основании прогностического аспекта оценки эффективности терапии.
К важнейшим задачам ведения больных с желудочковыми нарушениями ритма относятся:
1) устранение гемодинамических изменений и симптомов, вызванных аритмией (в тех случаях, когда аритмия симптоматическая);
2) предотвращение желудочковых нарушений ритма высоких градаций, внезапной сердечной смерти и улучшение долгосрочного прогноза (в тех случаях, когда имеются маркеры риска внезапной сердечной смерти).
Во многих случаях желудочковые нарушения ритма не сопровождаются клиническими симптомами, а устранение аритмии далеко не всегда целесообразно, учитывая риск внезапной сердечной смерти. Следовательно, назначению терапевтических мероприятий должна предшествовать оценка клинико-гемодинамического и прогностического значения аритмии у конкретного больного.
Клинико-гемодинамическое значение желудочковых нарушений ритма состоит в возможности становиться причиной симптомов и синдромов, которые или непосредственно связаны с нарушениями гемодинамики (синкопальные состояния, стенокардия, СН, артериальная гипотензия и коллапс), или, не ухудшая состояния гемодинамики, отрицательно влияют на качество жизни больного (головокружение, тошнота, тревога, иногда страх и предсинкопе). Впрочем, очень часто желудочковые нарушения ритма протекают бессимптомно.
Тщательный сбор анамнеза и обследование больного дают возможность установить прогностическое значение желудочковых нарушений ритма, которые в определенной степени связаны с клинико-гемодинамическими нарушениями, но не всегда соответствуют выявленным симптомам. В частности, в отдельных случаях прогностически незначимые желудочковые нарушения ритма могут сопровождаться инвалидизующими симптомами. С другой стороны, бессимптомные желудочковые нарушения ритма у больных с тяжелыми структурными поражениями миокарда (прежде всего постинфарктным кардиосклерозом и/или СН) значительно ухудшают прогноз. У больных с систолической дисфункцией миокарда и СН прогноз выживаемости зависит от градации аритмии: появление желудочковой экстрасистолии отражает тяжесть поражения сердечной мышцы и является своеобразным маркером умирающего сердца, а желудочковые нарушения ритма высоких градаций — еще и свидетельством повышения вероятности внезапной аритмической смерти.
Современная комплексная оценка прогноза больных с желудочковыми нарушениями ритма требует синтеза всей имеющейся информации не только о характере самого нарушения ритма, но и об основном заболевании — этиологическом факторе желудочковых нарушений ритма. Это начинается уже при опросе и объективном осмотре и является одним из основных заданий дальнейшего инструментального обследования больных с желудочковыми нарушениями ритма (табл. 6.4).
Таблица 6.4
Классификация желудочковых аритмий по прогностической значимости
| Сравниваемые критерии | Доброкачественные | Потенциально злокачественные | Злокачественные |
| Риск внезапной смерти | Очень низкий | Низкий или умеренный | Высокий |
| Клинические проявления | Сердцебиение, выявленное при плановом осмотре | Сердцебиение, выявленное при плановом осмотре или массовом обследовании | Сердцебиение, синкопальные состояния, остановка сердца в анамнезе |
| Структурное поражение сердца | Как правило, нет | Есть | Есть |
| Рубец или гипертрофия сердца | Нет | Есть | Есть |
| ФВ ЛЖ | Нормальная (более 55%) | Умеренно снижена (30–55%) | Значительно снижена (менее 30%) |
| Частота желудочковой экстрасистолии | Незначительная или умеренная | Умеренная или значительная | Умеренная или значительная |
| Парные желудочковые экстрасистолы или нестойкая (длительностью меньше 30 c) желудочковая тахикардия | Нет | Есть | Есть |
| Стойкая (длительностью более 30 c) желудочковая тахикардия | Нет | Нет | Есть |
| Гемодинамические последствия аритмии | Нет | Нет или незначительные | Умеренные или выраженные |
Обязательным элементом обследования больных и оценки прогностического значения аритмии является эхоКГ-исследование, которое дает важную информацию о структурном поражении сердца, наличии рубцовых изменений миокарда и его гипертрофии, а также о степени дисфункции ЛЖ (табл. 6.5).
Таблица 6.5
Степени тяжести структурного поражения сердца и его потенциальное влияние на риск и эффективность антиаритмической терапии
| Степень | Характеристика поражения сердца | Риск | Эффективность |
| I | Структурная патология без влияния на желудочек: пролапс митрального клапана без регургитации или нарушений реполяризации, дополнительные AV-пути проведения, умеренный митральный стеноз | +++++ | + |
| II | Минимальная дисфункция ЛЖ, умеренная гипертрофия или перегрузка объемом без выраженной дилатации ЛЖ | ++++ | ++ |
| III | Поражение миокарда без застойных феноменов или тяжелой систолической дисфункции ЛЖ | +++ | +++ |
| IV | Выраженная ГЛЖ | ++ | ++++ |
| V | Застойная СН, тяжелая систолическая дисфункция ЛЖ, выраженная ишемия | + | +++++ |
Желудочковые нарушения ритма считают доброкачественными, если они не вызывают нарушений гемодинамики, не связаны со структурным поражением сердечной мышцы и имеют низкую градацию (единичные желудочковые экстрасистолы). Желудочковые нарушения ритма расценивают как доброкачественные приблизительно у 30% всех больных с симптоматическими желудочковыми аритмиями.
Потенциально злокачественные желудочковые нарушения ритма связаны со структурной патологией миокарда, дисфункцией сердечной мышцы, но также не вызывают существенных гемодинамических симптомов. Потенциально злокачественными могут быть желудочковые нарушения ритма любых градаций, за исключением стойкой желудочковой тахикардии. К этому классу относится около 65% всех случаев желудочковых нарушений ритма.
Злокачественные желудочковые нарушения ритма почти всегда возникают на фоне тяжелой структурной патологии и дисфункции миокарда, вызывают значимые гемодинамические нарушения и являются желудочковыми нарушениями высокой градации (обычно это пароксизмы стойкой желудочковой тахикардии). К злокачественным относят до 5% всех случаев желудочковых нарушений ритма.
С целью установления частоты и градации аритмии у больных с желудочковыми нарушениями ритма достаточно зарегистрировать обычную ЭКГ покоя. Показанием для осуществления холтеровского мониторирования ЭКГ с диагностической целью является периодическое появление приступов сильного сердцебиения, синкопальных состояний неустановленной этиологии и других симптомов, вероятно обусловленных тахиаритмией, не зарегистрированной на ЭКГ. Холтеровский мониторинг используют не только для верификации риска внезапной сердечной смерти, а и оценки эффекта антиаритмической терапии. Чаще всего в клинической практике используют критерии эффективности антиаритмической терапии, которые были предложены Хоровицем и Лауном:
- уменьшение на 50% общего количества желудочковых экстрасистол;
- снижение на 90% парных желудочковых экстрасистол;
Проведение пробы с дозированной физической нагрузкой должно быть рекомендовано взрослым пациентам с желудочковой аритмией, имеющим умеренную или высокую достоверность наличия ИБС (с учетом возраста, пола и симптоматики), которая может инициировать развитие ишемических изменений или желудочковую аритмию.
Проведение эхоКГ рекомендуется больным с желудочковыми нарушениями с подозрением на органическое заболевание сердца или родственникам больных с наследственными нарушениями, ассоциированными с внезапной сердечной смертью. Рекомендуется проведение стресс-тестов с фармакологическими пробами или пробы с дозированной физической нагрузкой с каким-либо методом визуализации (эхоКГ или ОФЭКТ с перфузией миокарда) для выявления немой ишемии у больных с желудочковыми аритмиями, у которых отмечают умеренную достоверность наличия ИБС.
Проведение МРТ, КТ сердца или радиоизотопной ангиографии может быть необходимым у пациентов с желудочковыми аритмиями в случаях, когда эхоКГ не позволяет точно оценить функцию ЛЖ или ПЖ сердца и/или выявить характер его структурных изменений.
Проведение коронарной ангиографии помогает установить или исключить наличие ИБС с выраженной окклюзией коронарных артерий у пациентов с угрожающими жизни желудочковыми аритмиями или у лиц, перенесших внезапную сердечную смерть, у которых отмечают умеренную достоверность наличия ИБС (с учетом возраста, пола и симптоматики). Визуализация ЛЖ может быть целесообразна у пациентов, которым планируют установить бивентрикулярный кардиостимулятор.
Сигнал-усредненная ЭКГ высокого разрешения
С целью выявления аритмогенного субстрата у больных с приступами сердцебиения и кратковременной потерей сознания неустановленной этиологии, особенно при наличии структурного поражения миокарда, осуществляют исследование ППЖ. В пораженном миокарде ППЖ — низкоамплитудные высокочастотные электрические сигналы в конце комплекса QRS или в начале сегмента ST являются отражением зоны замедленного проведения, что может стать субстратом для повторного входа возбуждения и возникновения пароксизмальной желудочковой тахикардии. Выявление ППЖ позволяет предвидеть повышенный риск фатальных аритмий после перенесенного ИМ и облегчить отбор больных для проведения внутрисердечного ЭФИ.
Внутрисердечное ЭФИ
Программированное внутрисердечное ЭФИ является эталонным (хотя и нерутинным) методом диагностики желудочковых нарушений ритма у больных с приступами сердцебиения и синкопальными состояниями неустановленной этиологии. Тем не менее вследствие изменения стратегии лечения злокачественных желудочковых нарушений ритма, когда не так часто используют антиаритмические средства I класса, а в основном эмпирически назначают амиодарон и блокаторы β-адренорецепторов (в развитых странах, кроме того, имплантируют кардиовертер-дефибриллятор), внутрисердечное ЭФИ с последовательной оценкой эффективности антиаритмических средств проводят редко. Вместе с тем возросло значение внутрисердечного ЭФИ для картирования миокарда и определения локализации источника тахиаритмии перед выполнением процедуры катетерной радиочастотной абляции эктопических очагов, имплантации искусственного кардиовертера-дефибриллятора.
Генетическая база внезапной сердечной смерти
Внезапная кардиальная смерть может возникать как результат наследственной генетической патологии, влияющей на ключевые белки сердца. Болезни типа синдрома удлиненного интервала Q–T, синдрома Бругада, ГКМП, аритмогенной дисплазии ПЖ, катехоламинергической полиморфной желудочковой тахикардии или ДКМП — примеры вероятных факторов внезапной сердечной смерти. Свидетельство в поддержку существования генетического фактора склонности к внезапной сердечной смерти было выявлено после крупных эпидемиологических исследований, продемонстрировавших связь внезапной сердечной смерти с наследственностью. Наличие в семейном анамнезе остановки сердца и генетической патологии (синдром удлиненного интервала Q–T, синдром Бругада, ГКМП) следует обязательно всесторонне оценивать, особенно если речь идет об остановке сердца в молодом возрасте. В этих случаях необходимо активно предотвращать развитие ИБС.
ПРОФИЛАКТИКА ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ: ОБЩИЕ ПОДХОДЫ
Первичная профилактика внезапной сердечной смерти у больных с ИБС. Согласно концепции треугольника П. Кумеля, условиями формирования внезапной сердечной смерти у пациентов с ИБС являются взаимосвязанные факторы:
1) наличие чувствительного миокарда (компоненты которого — остаточная ишемия, электрическая нестабильность и дисфункция ЛЖ);
2) действие различных триггеров (тахикардия, экстрасистолия);
3) на фоне влияния соответствующих модуляторов (дисфункция вегетативной нервной системы, чаще всего — снижение активности ее парасимпатического отдела и порога возникновения фибрилляции желудочков).
Современные представления об аритмогенном желудочке включают объединение механической дисфункции (вследствие растяжения волокон, со структурным и электрическим ремоделированием камер сердца и кардиомиоцитов), нарушение функции ионных каналов, ишемию и наличие рубца или другого поражения ткани миокарда, а также нарушения проводимости. Учитывая перечисленные факторы, наиболее хорошо разработаны методы оценки риска внезапной сердечной смерти именно у пациентов со структурным заболеванием сердца, особенно у тех, которые были реанимированы после внезапной сердечной смерти или перенесли ранее эпизоды опасных для жизни нарушений ритма.
Принципы индивидуализированной оценки риска внезапной аритмической смерти у пациентов, перенесших эпизод внезапной сердечной смерти, в последнее время значительно изменились. С одной стороны, комплекс информативных методов, таких как холтеровское мониторирование ЭКГ, ЭФИ, регистрация ППЖ и вариабельности ритма сердца в сочетании с ФВ ЛЖ и ФК СН, позволил наиболее точно определять принадлежность пациентов к группе высокого риска внезапной сердечной смерти и пароксизмальной желудочковой тахикардии. Зарегистрированные при холтеровском мониторировании ЭКГ параметры, такие как количество, градация и морфология желудочковых аритмий, дисбаланс вариабельности ритма сердца и колебание длительности интервала Q–T остаются важными предвестниками высокого риска при решении вопроса о целесообразности осуществления первичной профилактики внезапной сердечной смерти путем имплантации кардиовертера-дефибриллятора или назначения антиаритмической терапии. Особенно информативным параметром для прогнозирования внезапной сердечной смерти по результатам многих исследований оказалась сниженная вариабельность ритма сердца, отражающая потерю адекватной парасимпатической защиты сердца от фибрилляции желудочков. Но наиболее мощным предвестником риска опасной для жизни аритмии, исходя из результатов исследования ATRAMI, было сочетание низкой вариабельности ритма сердца со сниженной ФВ ЛЖ и нарушенной чувствительностью барорефлекса.
Впрочем, анализ ЭКГ у пациентов, реанимированных после остановки сердца, свидетельствует, что непосредственными механизмами внезапной сердечной смерти наиболее часто являются фибрилляция или трепетание желудочков, а также полиморфная желудочковая тахикардия с высокой частотой, а не мономорфная желудочковая тахикардия. На долю пациентов с предварительно документированной стойкой желудочковой тахикардией приходится менее 1% (!) из числа лиц, ежегодно умирающих внезапно в западных странах. При инвазивном внесердечном ЭФИ более чем у 80% пациентов воссоздавали стойкую мономорфную желудочковую тахикардию, возникающую по механизму re-entry, в то время как у 50% больных, реанимированных после внезапной сердечной смерти, удавалось индуцировать опасную для жизни полиморфную желудочковую тахикардию или фибрилляцию желудочков. Можно предположить, что механизм возникновения фатальных аритмий отличается и значительно сложнее от простого кольца macro re-entry — ведущего механизма формирования мономорфной желудочковой тахикардии. В исследованиях установлено, что группу пациентов, перенесших эпизод внезапной сердечной смерти, следует четко отличать от пациентов, у которых индуцируется мономорфная желудочковая тахикардия, а риск опасных для жизни аритмий сердца нельзя полностью отождествлять с риском внезапной сердечной смерти. С другой стороны, неиндуцированная мономорфная желудочковая тахикардия на фоне лечения антиаритмическими средствами имеет ограниченное диагностическое значение как критерий эффективности антиаритмической терапии для индивидуальной профилактики внезапной сердечной смерти, особенно при наличии тяжелого структурного заболевания сердца.
Возникновение на фоне фиксированного аритмогенного субстрата желудочковых тахиаритмий с переходом в фибрилляцию желудочков не является единственным непосредственным механизмом формирования внезапной сердечной смерти. В частности, у значительного количества пациентов с острым коронарным синдромом формируется динамический аритмогенный субстрат и возникает первичная фибрилляция желудочков, тогда как у многих пациентов с ХСН непосредственным механизмом внезапной сердечной смерти являются брадиаритмии.
Учитывая это, современная стратегия стратификации риска внезапной сердечной смерти у лиц со структурным заболеванием сердца не ограничивается определением критериев наличия стойкого аритмогенного субстрата. Она прежде всего связана с поиском маркеров электрической нестабильности миокарда, остаточной ишемии и дисфункции ЛЖ (табл. 6.6 и 6.7).
Таблица 6.6
Факторы патогенеза и методы оценки риска внезапной сердечной смерти у пациентов с ИБС
| Компоненты патогенеза внезапной сердечной смерти | Маркеры риска внезапной сердечной смерти | Методы исследования |
| Электрическая нестабильность миокарда | Желудочковые нарушения ритма высоких градаций
Снижение вариабельности сердечного ритма Увеличение продолжительности корригированного интервала Q–T |
Холтеровское мониторирование ЭКГ
Проба с дозированной физической нагрузкой ЭФИ |
| Дисфункция ЛЖ | Клинические проявления СН
Нарушение глобальной и региональной сократимости миокарда Нейрогуморальные нарушения |
ЭхоКГ
Радиоизотопная вентрикулография, контрастная вентрикулография МРТ, КТ сердца Исследование активности компонентов РААС и САС |
| Ишемия миокарда | Стенокардия
Диагностические изменения ЭКГ |
Проба с дозированной физической нагрузкой
Холтеровское мониторирование ЭКГ Стресс-эхоКГ Ангиография коронарных артерий |
Таблица 6.7
Стратификация риска внезапной сердечной смерти у пациентов с ИМ и СН
| Рекомендации | Параметры и процедуры |
| Параметр, полезный для стратификации риска | Демографические показатели
ФВ ЛЖ Вариабельность сердечного ритма, чувствительность барорефлекса Объем ЛЖ |
| Доказательства или мнения экспертов в пользу применения процедуры или параметра | Желудочковые экстрасистолы
Нестойкая желудочковая тахикардия ЧСС в покое |
| Аргументы в пользу проведения процедуры или параметра более слабые | ППЖ
Интервал Q–T ЭФИ Альтернирующий зубец Т Турбулентность сердечного ритма Проходимость инфаркт-обусловившей артерии |
| Параметр, не полезный для стратификации риска | Дисперсия Q–T |
Определяющими клиническими факторами оценки прогноза выживаемости у большинства больных с ИБС и СН являются ФВ ЛЖ и ФК СН по классификации NYHA. Среди пациентов с СН I–II ФК общий риск смерти относительно низкий, но 67% летальных исходов были внезапными; в то время как при значительно более плохом общем прогнозе выживаемости только 29% пациентов с СН IV ФК умирали внезапно. Следовательно, при определении показаний для специфической профилактики внезапной сердечной смерти следует использовать существующие предвестники риска внезапной сердечной смерти и предусмотреть потенциальную вероятность смерти от разных причин. Это позволяет более точно разработать стратегию лечения.
Следует отметить, что, учитывая результаты ряда контролируемых исследований в течение последнего десятилетия, были пересмотрены принципы оценки эффективности антиаритмической терапии методом холтеровского мониторирования ЭКГ. Несмотря на значительную корреляцию между риском внезапной сердечной смерти и количеством и градацией зарегистрированных желудочковых экстрасистолий у пациентов со структурным заболеванием сердца, этот метод не стал надежным индикатором эффективного устранения аритмии, для которой характерны существенные спонтанные колебания. Как показали результаты исследования ESVEM, у пациентов, перенесших ИМ, даже при якобы эффективном преодолении злокачественной желудочковой тахикардии антиаритмическими средствами в 50% случаев они восстанавливались уже на протяжении последующих 2 лет. Но еще более опасным было то, что наряду с успешным угнетением желудочковых нарушений ритма определенными препаратами класса IC повышался риск внезапной сердечной смерти в отдаленные сроки от начала лечения. Эти данные получены в исследованиях CAST, CAST-II и ESVEM.
Итак, распространенная в 80-е годы ХХ в. гипотеза о возможности предотвращения внезапной сердечной смерти у пациентов с желудочковыми нарушениями ритма путем устранения триггеров — преждевременных желудочковых сокращений не была подтверждена. С другой стороны, препараты группы блокаторов β-адренорецепторов, антиаритмическая эффективность которых по преодолению желудочковой экстрасистолии относительно слабая, показали способность снижать риск внезапной сердечной смерти у разных категорий пациентов и предотвращать аритмогенное действие препаратов I класса (табл. 6.8).
Таблица 6.8
Целесообразность применения блокаторов β-адренорецепторов для предотвращения внезапной сердечной смерти
| Рекомендации | Категории пациентов и тип профилактики внезапной сердечной смерти |
| Польза бесспорная | После ИМ, в том числе у пациентов с СН (первичная профилактика)
Симптоматический синдром удлиненного интервала Q–T (первичная) Синдром удлиненного интервала Q–T — вместе с ИКД (вторичная) |
| Доказательства или мнение экспертов в пользу применения блокаторов β-адренорецепторов | Пациенты в постинфарктный период, реанимированные после желудочковой тахикардии/фибрилляции желудочков, спонтанная стойкая желудочковая тахикардия (вторичная)
Бессимптомный синдром удлиненного интервала Q–T (первичная) Миокардиальные «мостики» (первичная) Катехоламинергическая полиморфная желудочковая тахикардия (первичная и вторичная) |
| Аргументы в пользу применения блокаторов β-адренорецепторов более слабые | Аритмогенная дисплазия ПЖ (первичная) |
| Нет оснований для применения | ГКМП (первичная) |
Результаты холтеровского мониторирования ЭКГ не отражают реальных изменений риска ранней сердечной смерти и ограниченно информативны для оценки эффективности антиаритмической терапии. Именно поэтому во многих клинических ситуациях антиаритмические средства, прежде всего амиодарон и/или блокаторы β-адренорецепторов, назначают эмпирически и без учета собственно антиаритмической эффективности терапии.
В группах доказанного высокого риска внезапной сердечной смерти (прежде всего у пациентов, перенесших ИМ с желудочковыми нарушениями ритма) в течение последнего десятилетия было проведено несколько больших многоцентровых рандомизированных исследований, позволивших определить место различных антиаритмических препаратов и устройств в первичной и вторичной профилактике внезапной сердечной смерти. Единственным антиаритмическим средством, по которому получены доказательства целесообразности применения для первичной профилактики внезапной сердечной смерти, остается амиодарон. Наиболее известным стал метаанализ ATMA — совокупный анализ 13 рандомизированных исследований, проведенных в 90-е годы ХХ в., в которых оценивали эффект амиодарона по сравнению с плацебо у пациентов после перенесенного ИМ (8 исследований) и с СН (5 исследований) и желудочковыми нарушениями ритма. Всего были проанализированы результаты лечения 6553 пациентов. Установлено, что риск внезапной сердечной смерти при длительном (на протяжении 2 лет) применении амиодарона достоверно снизился на 29%, а общая смертность — на 13%. Среди побочных эффектов амиодарона чаще всего (до 4% случаев длительного применения препарата) выявляли нарушения со стороны щитовидной железы, значительно реже — нейропатии, появление легочных инфильтратов, брадикардию или нарушение функции печени. Учитывая это, амиодарон показан для первичной профилактики внезапной сердечной смерти прежде всего тем пациентам со структурным заболеванием сердца, у которых имеются критерии высокого риска опасных для жизни аритмий сердца и польза применения препарата безусловно превышает риск побочных эффектов (табл. 6.9).
Таблица 6.9
Целесообразность применения амиодарона для предотвращения внезапной сердечной смерти
| Рекомендации | Категории пациентов и тип профилактики внезапной сердечной смерти |
| Доказательства или мнение экспертов в пользу применения препарата | Пациенты, перенесшие ИМ (первичная) Пациенты, перенесшие ИМ, реанимированные после желудочковой тахикардии/фибрилляции желудочков, спонтанная желудочковая тахикардия (вторичная)
Аортальный стеноз (первичная) |
| Аргументы в пользу применения препарата более слабые | ГКМП (первичная)
ДКМП (первичная) Аритмогенная дисплазия ПЖ (первичная) WPW-синдром (первичный) |
Что касается блокаторов β-адренорецепторов, то необходимо подчеркнуть, что эффективность в плане предупреждения внезапной сердечной смерти доказана для метопролола, бизопролола и карведилола.
Одним из современных методов предотвращения внезапной сердечной смерти с наиболее убедительными доказательствами эффективности у пациентов из групп высокого риска является имплантация искусственного кардиовертера-дефибриллятора. Например, в исследование MADIT включили 196 пациентов с ФВ ЛЖ (35% после перенесенного ИМ), с неустойчивой желудочковой тахикардией, документированной с помощью холтеровского мониторирования ЭКГ или пробы с физической нагрузкой, а также стойкой желудочковой тахикардией, индуцированной при ЭФИ. Рандомизированно осуществляли имплантацию искусственного кардиовертера-дефибриллятора или продолжали обычное медикаментозное лечение. На протяжении 27 мес наблюдения смертность в группе больных с имплантированным искусственным кардиовертером-дефибриллятором составила 15%, в группе медикаментозного лечения — 38% (хотя следует отметить, что часть больных в этой группе принимала антиаритмические препараты I класса). В этом исследовании была впервые доказана целесообразность имплантации искусственного кардиовертера-дефибриллятора у пациентов, перенесших ИМ, с высоким риском внезапной аритмической смерти.
Вместе с тем применение специфических средств профилактики фибрилляции желудочков нецелесообразно у пациентов с высоким риском смерти от других причин. В частности, у пациентов с ФВ ЛЖ <25% и СН III–IV ФК наихудший общий прогноз выживаемости и наивысший риск смерти вследствие СН. Вмешательства, которые направлены только на предотвращение внезапной сердечной смерти у таких больных и не влияют на течение основного заболевания (такие как имплантация искусственного кардиовертера-дефибриллятора), позволяют значительно снизить вероятность фатальной фибрилляции желудочков и показатель внезапной сердечной смерти среди возможных причин смерти, но практически не улучшают общий прогноз. Больные с высоким общим риском смерти (аритмической и неаритмической) после имплантации искусственного кардиовертера-дефибриллятора умирают приблизительно в те же сроки по другим причинам, в частности вследствие острой СН или тромбоэмболии.
Конечно, вопрос о целесообразности имплантации кардиовертера-дефибриллятора решается по-разному в зависимости от возможности приобретения этих приборов. В последнее время получены данные, позволяющие расширить показания для применения имплантации искусственного кардиовертера-дефибриллятора. Цель исследования MADIT-II — установить, позволит ли профилактическая имплантация кардиовертера-дефибриллятора повысить выживаемость больных c ИБС и систолической дисфункцией ЛЖ по сравнению с медикаментозной терапией. Это исследование включало пациентов с хронической ИБС и хотя бы одним перенесенным ранее ИМ, ФВ ЛЖ <30% и более 10 желудочковых экстрасистол в час при холтеровском мониторировании ЭКГ без возрастных ограничений. В исследование не включали пациентов с пароксизмами неустойчивой желудочковой тахикардии или у которых во время внутрисердечного ЭФИ индуцировали стойкую желудочковую тахикардию. К ноябрю 2001 г. в исследование успели включить 1232 пациента, среди которых большинство получали оптимальную медикаментозную терапию — ингибиторы АПФ и блокаторы β-адренорецепторов, часть — антиаритмические средства. Исследование прекратили преждевременно в связи с полученными убедительными данными о большей выживаемости пациентов, которым имплантировали искусственный кардиовертер-дефибриллятор за счет снижения риска внезапной сердечной смерти. Профилактическое применение имплантации кардиовертера-дефибриллятора на протяжении 3 лет ассоциировалось со статистически достоверным снижением смертности на 31%. Причем польза имплантации искусственного кардиовертера-дефибриллятора была очевидной у разных категорий пациентов, среди которых у 75% диагностировали СН II–III ФК.
Какие же категории пациентов могут быть кандидатами для первичной профилактики внезапной сердечной смерти с помощью антиаритмических препаратов или устройств? К ним, прежде всего, относятся пациенты с неинвазивными маркерами высокого риска внезапной сердечной смерти после перенесенного ИМ, а также пароксизмами нестойкой желудочковой тахикардии при застойной СН или ГКМП.
Рекомендации по стратификации риска и профилактике внезапной сердечной смерти у больных c ИМ и СН приведены в табл. 6.10 и 6.11.
Таблица 6.10
Рекомендации для стратификации риска развития внезапной сердечной смерти у больных с ИМ и СН
| Очень важно | Важно | Менее важно |
| ФВ ЛЖ
Вариабельность сердечного ритма или барорефлекторная чувствительность Объем ЛЖ |
Желудочковые экстрасистолы
Нестойкая желудочковая тахикардия ЧСС покоя |
ППЖ
Интервал Q–T Альтерация зубца T Турбулентность сердечного ритма Программированная стимуляция желудочков Проходимость пораженной коронарной артерии |
Таблица 6.11
Первичная профилактика внезапной сердечной смерти у больных, перенесших ИМ с/без СН
| Категории пациентов | Очень важно | Важно | Менее важно |
| Перенесшие ИМ | Блокаторы β-адренорецепторов
Ингибиторы АПФ Липидоснижающие средства |
Амиодарон
Высококонцентрированные омега-3 полиненасыщенные жирные кислоты Соталол Реваскуляризация миокарда |
|
| ИМ + дисфункция ЛЖ | Блокаторы β-адренорецепторов
Ингибиторы АПФ Ингибиторы рецепторов альдостерона Имплантация кардиовертера-дефибриллятора |
Амиодарон
Высококонцентрированные омега-3-полиненасыщенные жирные кислоты Имплантация кардиовертера-дефибриллятора (если ФВ <30%) Имплантация кардиовертера-дефибриллятора + абляция (если ФВ >40%) |
|
| Гемодинамически стабильные желудочковые тахикардии | Не показаны антиаритмические препараты (при бессимптомном течении неустойчивой желудочковой тахикардии) | Амиодарон
Блокаторы β-адренорецепторов |
Имплантация кардиовертера-дефибриллятора
Абляция Хирургическая коррекция Амиодарон |
| ФВ <40% + нестойкие желудочковые тахикардии при холтеровском мониторировании + желудочковые тахикардии, индуцируемые во время ЭФИ | Реваскуляризация миокарда
ИКД* |
Амиодарон
Блокаторы β-адренорецепторов |
Амиодарон
Блокаторы β-адренорецепторов |
*Можно рекомендовать больному.
ИКД — имплантированный кардиовертер-дефибриллятор.
ПРОФИЛАКТИКА ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ ПРИ РАЗЛИЧНЫХ КЛИНИЧЕСКИХ СОСТОЯНИЯХ
Учитывая то, что большинство случаев внезапной сердечной смерти происходит за пределами клиник, в которых могут быть обеспечены соответствующие условия для проведения реанимационных мероприятий, вероятность спасения этих пациентов очень низкая. Кроме того, даже после успешной реанимации возможность повторного эпизода внезапной сердечной смерти на протяжении года у не получающих адекватной терапии пациентов составляет не менее 30%. Однако изменение стратегии антиаритмической терапии, состоявшееся после исследования CAST, и особенно широкое внедрение в развитых странах имплантации искусственного кардиовертера-дефибриллятора позволили улучшить перспективы вторичной профилактики внезапной сердечной смерти.
Следует повторно акцентировать внимание на полученных безусловных доказательствах по результатам нескольких рандомизированных контролируемых многоцентровых исследований (САSH, AVID, CIDS) о преимуществах имплантации искусственного кардиовертера-дефибриллятора по сравнению с любыми антиаритмическими средствами у больных, перенесших эпизод опасного для жизни нарушения ритма или реанимированных после внезапной сердечной смерти. К сожалению, высокая стоимость и недоступность имплантации искусственного кардиовертера-дефибрилятора не позволяют ввести эту инновацию в тактику лечения большинства наших пациентов. При этих условиях средством выбора вторичной профилактики внезапной аритмической смерти является амиодарон в сочетании с блокаторами β-адренорецепторов, а при наличии систолической дисфункции ЛЖ и/или СН — ингибиторами АПФ. Общее применение амиодарона и блокаторов β-адренорецепторов (обязательно без внутренней симпатомиметической активности, например метопролол или карведилол) оказывает синергический эффект, значительно улучшает результаты вторичной (в некоторых случаях и первичной) профилактики внезапной сердечной смерти и прогноз выживаемости больных.
Рекомендации относительно вторичной профилактики внезапной сердечной смерти у больных, перенесших ИМ с/без СН, приведены в табл. 6.12.
Таблица 6.12
Вторичная профилактика внезапной сердечной смерти у больных, перенесших ИМ с/без СН
| Категории пациентов | Очень важно | Важно | Менее важно |
| Больные, реанимированные после желудочковой тахикардии/фибрилляции желудочков, со спонтанной гемодинамически нестабильной желудочковой тахикардией | Имплантация кардиовертера-дефибриллятора* | Амиодарон
Блокаторы β-адренорецепторов |
|
| Больные с гемодинамически стабильной мономорфной желудочковой тахикардией | Амиодарон
Блокаторы β-адренорецепторов |
Имплантация кардиовертера-дефибриллятора* |
*Можно рекомендовать больному.
Риск внезапной сердечной смерти у больных с нестабильной стенокардией
В Украине 1997–2001 гг. в Институте кардиологии им. Н.Д. Стражеско АМН Украины было проведено проспективное 4-летнее исследование с целью выявления независимых факторов риска внезапной сердечной смерти у больных, перенесших нестабильную (прогрессирующую) стенокардию. Во время наблюдения у 44 из 392 больных развилась внезапная сердечная смерть. После проведения мультифакторного регрессионного анализа 150 клинико-инструментальных показателей независимыми предикторами развития внезапной сердечной смерти оказались факторы, приведенные в табл. 6.14.
Кроме того, в этом исследовании была оценена прогностическая значимость разных исследовательских приемов с целью стратификации риска развития внезапной сердечной смерти у больных, перенесших нестабильную стенокардию. Эти данные приведены в табл. 6.15.
Риск внезапной сердечной смерти у больных с СН (табл. 6.13)
Таблица 6.13
Профилактика внезапной сердечной смерти у больных с СН
| Категории больных | Очень важно | Важно | Менее важно |
| Больные с ФВ ЛЖ ≤30–40% (первичная профилактика) | Имплантация кардиовертера-дефибриллятора*
Амиодарон Блокаторы β-адренорецепторов |
Амиодарон
Соталол Блокаторы β-адренорецепторов |
|
| Больные, реанимированные после желудочковой тахикардии/фибрилляции желудочков, со спонтанной гемодинамически нестабильной желудочковой тахикардией, ФВ ЛЖ ≤40% | Имплантация кардиовертера-дефибриллятора* | Амиодарон
Блокаторы β-адренорецепторов |
|
| Больные с гемодинамически стабильной мономорфной желудочковой тахикардией | Имплантация кардиовертера-дефибриллятора*
Амиодарон Блокаторы β-адренорецепторов |
Имплантация кардиовертера-дефибриллятора* |
*Можно рекомендовать больному.
Таблица 6.14
Независимые факторы развития внезапной сердечной смерти у больных, перенесших нестабильную стенокардию
| Фактор | Отношение шансов (OR) с 95% доверительным интервалом |
| Эпизоды безболевой (немой) ишемии миокарда ≥3 в сутки при холтеровском мониторировании | OR=3,02 (0,23–5,80), p=0,0351 |
| Количество пораженных коронарных артерий ≥2 | OR=2,94 (0,92–4,92), p=0,0214 |
| Депрессия сегмента ST на 1 мм и более в ≥3 отведениях при ВЭМ | OR=2,1 (1,37–4,49), p=0,0032 |
| СН I–IIА стадии | OR=2,10 (1,37–4,49), p=0,0032 |
| Суммарная продолжительность ишемии через сутки ≥40 мин | OR=1,91 (1,51–3,21), p=0,0034 |
| Пробежки желудочковой тахикардии ≥3 через сутки при холтеровском мониторировании | OR=1,53 (0,52–2,56), p= 0,0034 |
Таблица 6.15
Информативность использованных исследовательских приемов для прогнозирования внезапной сердечной смерти у больных, перенесших нестабильную стенокардию
| Исследовательские приемы | Информативность | p |
| Холтеровское мониторирование ЭКГ | OR=66,0 χ2=26,6 | <0,0001 |
| Коронароангиография | OR=33,4 χ2=23,0 | <0,001 |
| ЭхоКГ | OR=30,5 χ2=23,0 | <0,001 |
| Чреспищеводная электрокардиостимуляция | OR=29,0 χ2=23,6 | <0,0001 |
| ВЭМ | OR=27,0 χ2=36,6 | <0,0001 |
| Клинические показатели | OR=20,5 χ2=58,0 | <0,0001 |
Наиболее информативным исследовательским приемом (из примененных) для прогнозирования внезапной сердечной смерти у больных, перенесших нестабильную стенокардию, оказалось холтеровское мониторирование ЭКГ (OR=66,0 χ2=26,6; p<0,0001), которое практически в 2 раза превосходит ценность такого общепризнанного исследовательского приема, как коронароангиография, считающаяся золотым стандартом диагностики ИБС.
Данный факт можно объяснить тем, что холтеровское мониторирование характеризует выраженность сразу двух важнейших факторов риска развития внезапной сердечной смерти — наличие ишемии и признаков электрической нестабильности миокарда, в то время как метод коронарной ангиографии оценивает только наличие анатомического субстрата ишемии и не дает информации относительно функционального характера коронарных повреждений.
Следует учитывать то, что эти данные получены в единственном исследовании, проведенном в связи с этой проблемой, поэтому имеют некоторые ограничения для широкого использования.
Профилактика внезапной сердечной смерти при ГКМП
ГКМП — часто встречающееся заболевание сердца, распространенность которого среди взрослого населения составляет 1:500. Внезапная неожиданная смерть при этом заболевании является наиболее грозным последствием, встречающимся в разные периоды жизни, но особенно часто в молодом возрасте и у пациентов без симптомов заболевания. Основная задача кардиологов направлена на идентификацию небольшого количества пациентов с ГКМП, имеющих высокий риск развития внезапной сердечной смерти. Анамнез ГКМП разнообразен, но течение заболевания «мягкое» для большинства пациентов. Внезапную сердечную смерть наиболее часто отмечают в молодом возрасте (до 30 лет), но она может возникать и в других возрастных группах с ежегодной частотой 2,4%. Внезапная сердечная смерть при ГКМП достоверно является следствием взаимодействия многочисленных механизмов. Важность каждого фактора как пускового механизма или только детерминанты обычно сложно установить ретроспективно. Имплантация кардиовертера-дефибриллятора для предотвращения развития внезапной сердечной смерти наиболее показана у пациентов, которые перенесли остановку сердца или с наличием двух и более факторов риска. Лечение амиодароном может представлять фармакологическую альтернативу имплантации искусственного кардиовертера-дефибриллятора, если имплантация кардиовертера по различным причинам невозможна.
Рекомендации по стратификации риска внезапной сердечной смерти и средствам ее первичной и вторичной профилактики приведены в табл. 6.16.
Таблица 6.16
Профилактика внезапной сердечной смерти у больных с ГКМП
| Очень важно | Важно | Менее важно | |
| Стратификация риска | Остановка сердца или стойкие желудочковые тахикардии
Нестойкая желудочковая тахикардия при холтеровском мониторировании Семейный анамнез сердечной смерти Синкопе Толщина межжелудочковой перегородки >3 см Гипотензия после нагрузки |
Фибрилляция предсердий
Ишемия миокарда Обструкция выносящего тракта ЛЖ Мутация, свидетельствующая о высокой степени риска Интенсивная физическая нагрузка |
|
| Первичная профилактика | Имплантация кардиовертера-дефибриллятора | Амиодарон
ЭФИ |
|
| Вторичная профилактика | Имплантация кардиовертера-дефибриллятора* | Амиодарон |
*Можно рекомендовать больному.
Профилактика внезапной сердечной смерти при ДКМП
ДКМП — хроническое заболевание сердечной мышцы, характеризующееся дилатацией ЛЖ и ухудшением систолической функции. В эпидемиологических исследованиях установлено, что частота выявления составляет около 20 случаев/100 тыс. населения в год, распространенность — 38 случаев/100 тыс. населения в год. В 40% случаев возможен семейный анамнез с преобладанием аутосомно-доминантного типа наследования, хотя имеются сообщения об изменениях, связанных с Х-хромосомой (2–5%). При ДКМП параллельно с улучшением в лечении СН постепенно снижается 5-летняя смертность с 70% в 1981 г. до около 20% — в настоящее время. Внезапная сердечная смерть при ДКМП составляет не менее 30% всех смертей и может возникать у пациентов с выраженной, а также умеренной степенью болезни, и даже у пациентов с клиническим и эхокардиографическим улучшением.
Предикторами общей смертности при ДКМП являются изменения ФВ и КДО, мужской пол, пожилой возраст, гипонатриемия, постоянный III тон, синусовая тахикардия, повышенное капиллярное давление в легких, системная гипотензия и фибрилляция предсердий. ФВ не является основным предиктором внезапной сердечной смерти при ДКМП. Возникновение синкопальных эпизодов или фибрилляции/трепетания желудочков — другие, более точные, индикаторы риска внезапной сердечной смерти при этом заболевании.
Терапевтические стратегии, нацеленные на снижение риска внезапной сердечной смерти у пациентов с ДКМП и зарегистрированными желудочковыми аритмиями, включают ингибиторы АПФ, блокаторы β-адренорецепторов, амиодарон и имплантацию искусственного кардиовертера-дефибриллятора. Средства стратификации риска внезапной сердечной смерти и их профилактики при хроническом миокардите такие же, как и при ДКМП.
Предложенные рекомендации по профилактике внезапной сердечной смерти при этом заболевании базируются на результатах небольшого количества проведенных исследований и основываются на мнении экспертов (табл. 6.17).
Таблица 6.17
Профилактика внезапной сердечной смерти у больных с ДКМП и хроническим миокардитом
| Очень важно | Важно | Менее важно | |
| Стратификация риска | ЭФИ | Предшествующая остановка сердца/фибрилляция желудочков
Стойкая желудочковая тахикардия |
↓ ФВ
Нестойкие желудочковые тахикардии |
| Первичная профилактика | Имплантация кардиовертера-дефибриллятора
Ингибиторы АПФ Блокаторы β-адренорецепторов |
Ингибиторы рецепторов альдостерона | Амиодарон
Имплантируемые кардиовертеры-дефибрилляторы |
| Вторичная профилактика | Имплантация кардиовертера-дефибриллятора*
Ингибиторы АПФ Блокаторы β-адренорецепторов |
Имплантация кардиовертера-дефибриллятора
Ингибиторы рецепторов альдостерона |
Амиодарон
Имплантируемые кардиовертеры-дефибрилляторы |
*Можно рекомендовать больному.
Профилактика внезапной сердечной смерти при аритмогенной дисплазии ПЖ
Аритмогенная дисплазия ПЖ или правожелудочковая кардиомиопатия — заболевание миокарда, характеризующееся очаговыми или глобальными фиброзными изменениями миокарда ПЖ с/без увеличения ЛЖ и с сохранением толщины межжелудочковой перегородки. Распространенность этого заболевания совершенно неизвестна, ориентировочно находится в пределах 1:1 тыс.–1:10 тыс. населения.
Для данной патологии характерна графика ЭКГ в виде перевернутых зубцов T и распространенных QRS-комплексов с эпсило-волнами в правых грудных отведениях. Болезнь выявляют у подростков и лиц молодого возраста с желудочковыми аритмиями, в то же время клинические проявления у детей определяют редко. Начальным признаком заболевания может быть потеря сознания (29%) или остановка сердца (7–23%).
Мономорфная желудочковая тахикардия с блокадой левой ножки пучка Гиса — наиболее частая (70–92%) аритмия, которую отмечают при аритмогенной дисплазии ПЖ, однако проявления ее могут быть и другими: от бессимптомной желудочковой экстрасистолии до тяжело переносимой полиморфной желудочковой тахикардии.
Аритмогенная дисплазия является одной из главных причин внезапной сердечной смерти в возрастной группе без заболеваний коронарных артерий. Хотя прогностические маркеры внезапной сердечной смерти еще не были определены в больших проспективных исследованиях, внезапная сердечная смерть возникает чаще у пациентов с распространенными изменениями в ПЖ с вовлечением ЛЖ. Считают, что у пациентов со стойкой мономорфной желудочковой тахикардией прогноз более благоприятный.
Доказательства, которые привели к данным рекомендациям, основаны на небольших исследованиях или на мнении экспертов (табл. 6.18).
Таблица 6.18
Профилактика внезапной сердечной смерти у больных с аритмогенной дисплазией ПЖ
| Очень важно | Важно | Менее важно | |
| Стратификация риска | Диффузная дилатация ПЖ
Вовлечение ЛЖ Дисфункция/дилатация ЛЖ + желудочковая тахикардия, индуцированная при внутрисердечном ЭФИ Остановка сердца/фибрилляция желудочков |
||
| Первичная профилактика | Имплантация кардиовертера-дефибриллятора | ЭФИ
Антиаритмические препараты |
|
| Вторичная профилактика | Имплантация кардиовертера-дефибриллятора* | Амиодарон, соталол | Абляция |
*Можно рекомендовать больному.
Профилактика внезапной сердечной смерти при пролапсе митрального клапана
Пролапс митрального клапана — довольно распространенная патология створок клапана, имеющая нечеткие эхоКГ-критерии. После уточнения ее эхоКГ-критериев распространенность этой патологии заметно уменьшилась. Последние данные Фремингемского исследования продемонстрировали, что в нерандомизированной группе амбулаторных пациентов распространенность пролапса митрального клапана составляла 1–3% на 3491 субъект. Пролапс митрального клапана в основном не является неотложным состоянием, хотя внезапная сердечная смерть и была отмечена в сочетании с пролапсом митрального клапана.
Считается, что в основе внезапной сердечной смерти при пролапсе митрального клапана лежат аритмии, а фибрилляция желудочков в большинстве случаев, вероятно, является непосредственной причиной внезапной сердечной смерти. L. Zuppiroli и соавторы сообщили о результатах проспективного исследования, в котором наблюдали 316 больных в течение 102 мес. На протяжении исследования только 6 пациентов умерли вследствие причин, связанных с заболеваниями сердца, из них у 3 зафиксирована внезапная сердечная смерть, 1 пациенту проведена коррекция митрального клапана за 14 мес до смерти. Однако следует подчеркнуть, что в связи с относительно высокой распространенностью пролапса митрального клапана в общей популяции даже при низком уровне осложнений могут отмечать большое количество случаев смерти.
Избыточные и миксоматозные створки — наиболее важные эхоКГ-«находки», связанные с внезапной сердечной смертью. В исследовании Nishimuri и соавторов у всех 6 пациентов с пролапсом митрального клапана, умерших внезапно, выявляли избыточные створки. Взаимосвязь между наличием и тяжестью регургитации на митральном клапане и внезапной сердечной смертью не установлена. Н. Boudoulas с соавторами, а также Kampbal с соавторами установили, что изменения сегмента ST в заднебоковых отделах были связаны с возникновением желудочковой тахикардии или фибрилляции желудочков. Данные других исследований позволили предположить, что удлинение интервала Q–T и увеличение дисперсии Q–T может стать маркером аритмической смертности. Частые или групповые желудочковые экстрасистолы, как и предполагали, оказались фактором риска внезапной сердечной смерти, но их прогностическая роль все же не была доказана. ЭКГ высокого разрешения может быть информативна при идентификации пациентов с пролапсом митрального клапана без склонности к злокачественным аритмиям. Возникновение желудочковой тахикардии при внутрисердечном ЭФИ в то же время не считается достоверным прогностическим признаком. Наиболее информативными прогностическими маркерами внезапной сердечной смерти в этой группе пациентов являются наличие в анамнезе предшествующей остановки сердца, внезапной сердечной смерти в семейном анамнезе в молодом возрасте и избыток митральной створки.
Проспективные исследования, изучавшие эффективность блокаторов β-адренорецепторов и других антиаритмических препаратов по предотвращению внезапной сердечной смерти, не проводили. Однако блокаторы β-адренорецепторов, вероятно, должны быть основными препаратами выбора у больных с клиническими симптомами пролапса митрального клапана. У пациентов, имеющих в анамнезе остановку сердца, показана имплантация искусственного кардиовертера-дефибриллятора. Эти выводы базируются только на данных небольших обзорных исследований и мнении экспертов и приведены в виде рекомендаций в таблице 6.19.
Таблица 6.19
Рекомендации по профилактике внезапной сердечной смерти у больных с пролапсом митрального клапана
| Очень важно | Важно | Менее важно | |
| Стратификация риска | Остановка сердца/желудочковая тахикардия | Наличие в семейном анамнезе внезапной сердечной смерти
Избыток/миксоматоз створок клапана |
Удлиненный интервал Q–T
Частые желудочковые экстрасистолы Индуцированность желудочковых тахикардий при внутрисердечном ЭФИ Регургитация на митральном клапане Увеличение левого предсердия |
| Первичная профилактика | Блокаторы β-адренорецепторов
Реконструкция митрального клапана или его замена |
||
| Вторичная профилактика | Имплантация кардиовертера-дефибриллятора* | Блокаторы β-адренорецепторов |
*Можно рекомендовать больному.
Профилактика внезапной сердечной смерти при аортальном стенозе
Аортальный стеноз может быть врожденной патологией, а также приобретенной после острой ревматической атаки или вследствие возрастного дегенеративного процесса (сенильный аортальный стеноз). Обычно анамнез аортального стеноза характеризуется длительным бессимптомным периодом, в течение которого повышается степень стеноза. В 1968 г. Ross и Braunwald показали, что риск внезапной сердечной смерти у пациентов без клинических проявлений — низкий (3–5%). Позднее проспективное исследование продемонстрировало, что внезапной сердечной смерти не отмечали ни в одном из 123 случаев бессимптомного течения у больных, наблюдавшихся на протяжении 2–5 лет. Клиническая манифестация аортального стеноза включает потерю памяти, стенокардию и/или диспноэ. При появлении клинической картины прогноз пациентов драматически ухудшается и частота внезапной сердечной смерти колеблется в пределах 8–34% по данным разных исследований. Механизмы внезапной сердечной смерти при аортальном стенозе достаточно не изучены, хотя по имеющимся данным значительная роль отводится рефлексу Бецольда — Яриша, желудочковым тахиаритмиям или нарушениям проведения через AV-соединение. Анализ холтеровского мониторирования у 7 пациентов, умерших внезапно, показали наличие желудочковой тахиаритмии в 6 случаях, но только в одном случае смерть была связана с брадиаритмией. Потерю сознания и внезапную сердечную смерть отмечали у многих пациентов, но не установлено, является ли потеря сознания предиктором внезапной сердечной смерти. Аортальный стеноз также связан с нарушениями проводимости в AV-узле и трехпучковой системе, которые выявляют наиболее часто при кальцификации клапана.
Сложность заключается в том, чтобы предположить наличие аортального стеноза у больного без клинических проявлений, когда риск внезапной сердечной смерти еще низкий. Степень стеноза (систолический градиент, площадь открытия клапана), уровень кальцификации и тяжесть ГЛЖ можно использовать для прогнозирования скорости прогрессирования стеноза и необходимости хирургического вмешательства. Однако предикторы внезапной сердечной смерти, базирующиеся на возникновении частых и/или комплексных желудочковых аритмий, поздних потенциалах или сниженной вариабельности сердечного ритма все еще обсуждаются, еще нет достаточно точных прогностических факторов относительно рекомендаций по замене аортального клапана.
После замены аортального клапана у пациентов остается некоторый риск внезапной сердечной смерти, вызванной аритмиями сердца, блокадами ножек пучка Гиса, полной блокадой сердца, нарушением функции ЛЖ, остаточной ГЛЖ, фиброзом, сопутствующей ИБС или дисфункцией протезированного клапана. В этой группе пациентов внезапная сердечная смерть проявлялась с частотой 2–4% на протяжении 7 лет. Более высокая частота внезапной сердечной смерти была выявлена в ранний период восстановления (3 нед) после замены клапана. Преходящая полная AV-блокада в послеоперационный период не является предиктором повторных нарушений проводимости. Прогностические факторы относительно AV-блокады, требующей имплантации постоянного водителя ритма, таковы: существующие ранее нарушения проводимости, низкая ФВ и кальциноз субаортального отдела межжелудочковой перегородки.
Ограничение физической активности должно быть рекомендовано пациентам с умеренным и особенно тяжелым аортальным стенозом. Предотвращение внезапной сердечной смерти — одна из целей хирургического лечения аортального стеноза. Однако если операция выполняется с целью снижения риска внезапной сердечной смерти, риск вероятных осложнений в данном случае должен быть сопоставлен со смертностью при хирургическом вмешательстве и известными осложнениями при протезировании клапанов. Большинство клиницистов откладывают хирургическое вмешательство до появления клинических признаков. Пациенты должны знать о типичных симптомах заболевания и необходимости раннего оперативного вмешательства до возникновения симптомов заболевания. Если пациенту проводят АКШ, рекомендуется параллельно заменять аортальный клапан для предупреждения ранней повторной операции. Пациенты с желудочковыми тахикардиями или фибрилляцией, спровоцированной внутрисердечным ЭФИ, должны рассматриваться как претенденты на имплантацию кардиовертера-дефибриллятора.
Роль антиаритмической терапии амиодароном пока не установлена. Пациентам с имеющимися желудочковыми тахиаритмиями показана имплантация кардиовертера-дефибриллятора. Данные рекомендации основаны на результатах проведенных небольших исследований и на мнении экспертов (табл. 6.20).
Таблица 6.20
Профилактика внезапной сердечной смерти у больных со стенозом аорты
| Очень важно | Важно | Менее важно | ||
| Стратификация риска | Перед заменой клапана | Синкопе
Стенокардия |
Значительная желудочкова аритмия
Дисфункция ЛЖ Неадекватная реакция на нагрузку |
Степень стеноза |
| После замены клапана | Значительная желудочковая аритмия | |||
| Первичная профилактика | Хирургическое лечение (замена аортального клапана) | Амиодарон | ||
| Вторичная профилактика | Имплантация кардиовертера-дефибриллятора* | Амиодарон |
*Можно рекомендовать больному.
Профилактика внезапной сердечной смерти при WPW-синдроме
Распространенность WPW-синдрома составляет 0,1–0,2%. Его наличие может приводить к внезапной кардиальной смерти. Это случается, если пароксизм фибрилляции предсердий вызывает очень быструю активацию желудочков через дополнительный AV-путь с коротким антероградным периодом рефрактерности и провоцирует фибрилляцию желудочков. Внезапная сердечная смерть при WPW-синдроме — редкий, но драматический случай у практически здорового человека. У пациентов с клиническими проявлениями, выявленными третичными водителями ритма, распространенность внезапной сердечной смерти с удачной реанимацией составляет 2–11%. Результаты популяционных исследований свидетельствуют о более низкой частоте внезапной сердечной смерти (0,15% в год).
В небольшом количестве исследований, включавших больных, выживших после внезапной сердечной смерти, установлена высокая частота следующих маркеров: анамнез симптоматической тахикардии, короткие интервалы R–R между предвозбужденными сокращениями в период фибрилляции предсердий; множественные дополнительные пути; пути, расположенные заднесептально; семейный характер заболевания и повышенная частота аномалии Эбштейна. Неустойчивый характер преэкзитации и резкая потеря феномена преэкзитации при нагрузочном тестировании указывают на низкий риск внезапной сердечной смерти. Потеря преэкзитации после внутривенной инфузии препаратов, например аймалина или прокаинамида, также является свидетельством низкого риска внезапной сердечной смерти. Однако дополнительные влияния (нагрузка, стресс, алкоголь) могут сокращать рефрактерный период дополнительного пути. Частое проведение через дополнительный путь при фибрилляции предсердий рассматривается в качестве чувствительного маркера риска, но его специфичность и прогностическая ценность являются низкими. Однако предвозбужденный интервал R–R <250 мс имеет прогностическую ценность внезапной сердечной смерти >95%.
В анамнезе у около 50% больных с ЭКГ-WPW-синдромом нет аритмий. У большинства таких пациентов хороший прогноз. Потеря сознания не имеет прогностической ценности для внезапной сердечной смерти. Но в то же время внезапная сердечная смерть может быть первым проявлением болезни. При внутрисердечном ЭФИ около 20% больных без клинических симптомов имели ускоренный желудочковый ритм при индуцированной фибрилляции предсердий. Однако специфичность и положительная прогностическая ценность этого инвазивного предиктора слишком низки для скринингового применения при бессимптомном WPW-синдроме. Таким образом, внутрисердечное ЭФИ для стратификации риска следует применять у больных, имеющих в анамнезе внезапную сердечную смерть в семье, или у лиц, чей образ жизни или профессиональные действия нуждаются в оценке риска. Детальное внутрисердечное ЭФИ целесообразно, если планируется абляция дополнительных проводящих путей у больных с клиническими проявлениями.
Удачная реанимация больного с документированной фибрилляцией желудочков или фибрилляцией предсердий с клиническими проявлениями и быстрым ответом желудочков через дополнительный путь — несомненное показание для абляции дополнительного пути проведения. У больных с клинически значимыми аритмиями лечебная тактика зависит от их особенностей. Пациентам с бессимптомным WPW-синдромом можно рекомендовать катетерную абляцию только при особых обстоятельствах, таких как анамнез внезапной сердечной смерти в семье, высокий профессиональный риск (у пилотов, шахтеров, операторов сложного индустриального оборудования и т.п., а также у спортсменов).
Показания для проведения терапии основаны на консенсусе экспертов и клиническом опыте. Рекомендации приведены в табл. 6.21.
Таблица 6.21
WPW-синдром
| Очень важно | Важно | Менее важно | ||
| Стратификация риска | Приобретенная АV-блокада у взрослых | АV-блокада III степени
АV-блокада II степени II типа Сопутствующая кардиальная патология или СН Синкопе |
||
| Врожденная АV-блокада III степени | Синкопе
Удлиненный интервал Q–T Врожденные пороки сердца |
|||
| Хроническая бифасцикулярная и трифасцикулярная блокада | Сопутствующие заболевания сердца или СН | Синкопе
НV (His-Ventricle) >100 мс или воспроизведение интра-Гис-блокады во время электростимуляции Индуцируемость желудочковой тахикардии во время внутрисердечного ЭФИ |
||
| Профилактика внезапной сердечной смерти | Имплантация кардиостимулятора | |||
*Можно рекомендовать больному.
Профилактика внезапной сердечной смерти при нарушениях проводящей системы сердца
Внезапная сердечная смерть может быть результатом брадиаритмий в 15–20% случаев. Если нарушение проводимости вызвано необратимой структурной аномалией у пациентов с нарушением проводимости, то внезапная сердечная смерть может быть вызвана желудочковой тахиаритмией. Водитель сердечного ритма, безусловно, улучшает состояние пациентов с брадиаритмиями и может снижать смертность.
Рекомендации по стратификации риска и профилактике внезапной сердечной смерти при нарушениях проводящей системы сердца приведены в табл. 6.22.
Таблица 6.22
Профилактика внезапной сердечной смерти у больных с нарушениями проводящей системы сердца
| Очень важно | Важно | Менее важно | |
| Стратификация риска | Короткий (< 250 мс) R–R интервал во время фибрилляции предсердий
Короткий (<270 мс) антероградный рефрактерный период дополнительного пути Многочисленные дополнительные пути Два и больше суправентрикулярных нарушения ритма Синкопе в анамнезе, связанное с нарушением ритма |
Потеря возбуждения во время аймалинового или прокаинамидового теста | |
| Первичная профилактика | Катетерная абляция* у больных с симптомами, при наличии фибрилляции предсердий и дополнительных путей проведения | Катетерная абляция* у больных без симптомов с семейным анамнезом внезапной клинической смерти, у больных с профессией высокого риска, у спортсменов | Амиодарон
Антиаритмические препараты IA и IС классов |
| Вторичная профилактика | Катетерная абляция* |
*Можно рекомендовать больному.
Профилактика внезапной сердечной смерти при катехоламинергической полиморфной желудочковой тахикардии
Катехоламинергическая полиморфная желудочковая тахикардия как клинический синдром впервые описана Кумелем в 1978 г. и более подробнее Линдхардтом в 1995 г. Это заболевание характеризуется адренергически вызванной полиморфной желудочковой тахикардией при структурно нормальном сердце. Пациенты, как правило, обращаются к кардиологу в связи с возникновением синкопальных состояний, семейным анамнезом (потеря сознания и внезапная сердечная смерть), которые отмечают приблизительно у трети пациентов. ЭКГ-картина при катехоламинергической полиморфной желудочковой тахикардии характеризуется наличием полиморфной желудочковой тахикардии, часто имеющей двунаправленный вид QRS-комплексов. Аритмия может быть выявлена при проведении нагрузочного стресс-теста или инфузии изопротеренола до повышения ЧСС >120 уд./мин. Отсутствие структурных изменений сердца было показано в исследовании Линдхардт и соавторов со средней длительностью наблюдения 7 лет. Такие же данные получены и в других работах по этой проблеме, что позволяет предположить таким образом присутствие первичной электрической нестабильности миокарда.
В ранних исследованиях генетический анализ при катехоламинергической полиморфной желудочковой тахикардии не проводили, однако есть подтверждения относительно аутосомного наследования, что предполагает генетическое наследование в основе патогенеза этого заболевания. Позднее эта концепция была поддержана Сваном и коллегами, которые продемонстрировали взаимосвязь между фенотипом катехоламинергической полиморфной желудочковой тахикардии и участком хромосомы Iq42-q43 в двух больших пораженных заболеванием семьях. В последних исследованиях Приоре и соавторы продемонстрировали присутствие мутаций hRyR2 в 4 семьях, где выявлены больные с катехоламинергической полиморфной желудочковой тахикардией, демонстрируя таким образом связь между измененпым hRyR2-белком и катехоламинергической полиморфной желудочковой тахикардией. Эти данные подтверждают концепцию, согласно которой катехоламинергическая полиморфная желудочковая тахикардия зависит от генетически заложенного излишка внутриклеточного кальция, возможно, путем проскальзывания ионов кальция из саркоплазматического ретикулума.
На сегодня из-за недостатка контролируемых клинических исследований информация о стратификации риска пациентов с катехоламинергической полиморфной желудочковой тахикардией ограничена. Наиболее крупное исследование представлено Линдхартом и соавторами в 1995 г. В нем демонстрировали данные семейного анамнеза внезапной сердечной смерти в 33% случаев и возникновение первого эпизода потери сознания в среднем на 7,8±4 году жизни. При этом отмечена четкая корреляция между сроком первого синкопального эпизода и степенью тяжести заболевания (считается, что более раннее начало можно рассматривать как предиктор неблагоприятного прогнозирования). Оценка риска развития тяжелой клинической манифестации должна базироваться на результатах клинической оценки, анамнеза заболевания, наличия в анамнезе внезапной необъяснимой сердечной смерти среди родственников. Большинство случаев смерти выявляют во втором десятилетии жизни у внешне здоровых лиц. Однако относительно высокая смертность у пациентов с использованием блокаторов β-адренорецепторов (5–10%) может стать показанием для имплантации искусственного водителя ритма тем из них, у которых отмечали раннее начало заболевания и наличие в семейном анамнезе внезапной сердечной смерти.
Опыт фармакологического лечения больных c катехоламинергической полиморфной желудочковой тахикардией ограничен. На сегодня наиболее эффективна антиадренергическая терапия с использованием блокаторов β-адренорецепторов. Эта концепция базируется на ретроспективном анализе опубликованных случаев с частотой внезапной сердечной смерти 4 из 38 (10,5%) и 10 из 21 (48%) пациента и без терапии блокатором β-адренорецепторов соответственно.
Все же большие проспективные исследования не проводили, представленные рекомендации базируются на мнении экспертов и приведены в табл. 6.23.
Таблица 6.23
Профилактика внезапной сердечной смерти у больных с катехоламинергической полиморфной желудочковой тахикардией
| Очень важно | Важно | Менее важно | |
| Стратификация риска | Остановка сердца/стойкая желудочковая тахикардия | Семейный анамнез внезапной сердечной смерти
Нестойкая желудочковая тахикардия при холтеровском мониторировании Синкопе в детском возрасте |
Синкопе |
| Первичная профилактика | Блокаторы
β-адренорецепторов |
Имплантация кардиовертера-дефибриллятора* у пациентов с синкопе/желудочковой тахикардией
Блокаторы β-адренорецепторов Имплантация кардиовертера-дефибриллятора у больных без синкопе/желудочковой тахикардии, когда диагноз установлен в детстве |
Блокаторы β- адренорецепторов |
| Вторичная профилактика | Имплантация кардиовертера-дефибриллятора* + блокаторы β-адренорецепторов | Блокаторы β-адренорецепторов |
*Можно рекомендовать больному.
Профилактика внезапной сердечной смерти при аномальном отхождении коронарных артерий
Аномалии коронарных артерий редкие. Распространенность этих аномалий в общей популяции неизвестна. По разным данным, их выявляют у 0,3–1,2% пациентов, прошедших коронарографию. Наиболее частая коронарная аномалия — a. circumflexa (как правило, сосуд отходит от правого коронарного синуса). В этой группе не отмечали неблагоприятных событий. Однако начало левой коронарной артерии от правого или некоронарного аортального синуса Вальсальвы достоверно связано с повышением риска внезапной сердечной смерти, особенно когда артерия проходит между аортой и ЛА. Аномальное отхождение правой коронарной артерии от левого синуса Вальсальвы соответственно полученным данным связано с внезапной сердечной смертью, но не имеет того же уровня риска, как аномальное отхождение левой коронарной артерии. Внезапная сердечная смерть является также основной причиной смерти у больных с аномальным отхождением левой коронарной от ЛА, которые дожили до зрелости.
Внезапная сердечная смерть обычно возникает у мужчин при физической активности. К сожалению, данные литературы показывают, что диагностировать подобные аномалии прижизненно возможно лишь приблизительно в 20% случаев. Наличие аномально расположенной коронарной артерии следует заподозрить у молодых пациентов, преимущественно мужчин с загрудинной болью при нагрузках, синкопальными состояниями в сочетании с необъяснимыми изменениями QRS и ST–T. Стресс-тесты, допплеровское цветное картирование и трансэзофагеальная эхоКГ — часто применяемые неинвазивные методы диагностики аномального отхождения левой коронарной артерии. Однако коронарная ангиография должна быть рекомендована даже при отрицательном нагрузочном тесте всем молодым пациентам, которые перенесли остановку сердца.
У пациентов с аномальным отхождением левой коронарной артерии от ЛА реимплантация сосуда в аорту снижает смертность и продолжительность заболевания. Пациентам с аберрантным отхождением левой или правой коронарной артерии, которые благополучно перенесли эпизод желудочковой фибрилляции, может быть рекомендовано хирургическое вмешательство (как правило, шунтирование). У больных с признаками ишемии миокарда целесообразно проведение хирургического лечения.
Данные рекомендации базируются на небольших обзорных исследованиях и мнении экспертов (табл. 6.24).
Таблица 6.24
Профилактика внезапной сердечной смерти при аномальном развитии коронарных артерий
| Очень важно | Важно | Менее важно | |
| Стратификация риска | Остановка сердца | Пациенты молодого возраста со стенокардией
Положительный тест во время стресс-эхоКГ |
|
| Первичная профилактика | Хирургическое лечение* | ||
| Вторичная профилактика | Хирургическое лечение* |
Миокардиальные «мостики» состоят из фиброзно-мышечных ножек, которые покрывают эпикардиальные коронарные артерии на разном уровне. Наличие миокардиальных «мостиков» по данным ангиографии отмечают в 0,5–4,5% случаев. Левая передняя нисходящая артерия поражается практически всегда. Типичное ангиографическое проявление — систолическое сужение сосуда из-за преходящей миокардиальной компрессии. Хотя многие миокардиальные «мостики» вреда не оказывают, они также могут быть причиной ишемии миокарда, ИМ, злокачественных желудочковых аритмий, AV-блокад и внезапной сердечной смерти.
Верификация и оценка тяжести миокардиального «мостика» — важная клиническая задача. Для оценки его гемодинамической значимости применяют нагрузочный ЭКГ-тест, добутаминовую стресс-эхоКГ или миокардиальную перфузионную сцинтиграфию. В отдельных случаях проводится внутрикоронарное допплеровское исследование скорости потоков или коронарография при добутаминовом стресс-исследовании для оценки состояния внутри сосуда под влиянием миокардиального «мостика». Миокардиальные «мостики» выявляют у 30–50% пациентов с ГКМП и рассматривают как вероятную причину внезапной сердечной смерти у этих пациентов.
Положительный эффект выявляют у пациентов с наличием миокардиальних «мостиков» с клиническими проявлениями при проведении терапии блокаторами β-адренорецепторов. Эффект блокаторов β-адренорецепторов в данном случае обусловлен отрицательным инотропным и хронотропным действием. Нитраты повышают ЧСС и могут приводить к ухудшению состояния пациентов. Пациентам, рефрактерным к медикаментозной терапии, проводят оперативное лечение (миотомия или коронарное шунтирование). Целесообразными также могут быть ангиопластика или стентирование. Долгосрочный прогноз изолированных миокардиальных «мостиков» благоприятный, но в некоторых случаях они могут вызывать желудочковые тахиаритмии и внезапную сердечную смерть.
Рекомендации относительно стратификации риска внезапной сердечной смерти при миокардиальных «мостиках» основаны на ограниченном количестве небольших обзорных наблюдений и мнении экспертов и приведены в табл. 6.25.
Таблица 6.25
Профилактика внезапной сердечной смерти у больных с миокардиальными «мостиками»
| Очень важно | Важно | Менее важно | |
| Стратификация риска | Остановка сердца
Гемодинамически значимая желудочковая тахикардия |
Ишемия миокарда | |
| Первичная профилактика | Хирургическое лечение у пациентов с ИБС* | Блокаторы β-адренорецепторов | |
| Вторичная профилактика | Хирургическое вмешательство у пациентов с ИБС* | Блокаторы β-адренорецепторов |
*Можно рекомендовать больному.
Профилактика внезапной сердечной смерти при «спортивном сердце»
Аномалии сердечно-сосудистой системы у многих спортсменов заключаются в увеличении массы ЛЖ, полости, толщины стенки или сочетании этих факторов. Сердечно-сосудистые причины внезапной сердечной смерти у спортсменов существенно меняются в зависимости от возраста. В возрасте старше 35 лет преобладающей причиной смерти является ИБС. И наоборот, у спортсменов в возрасте моложе 35 лет основная причина — сердечная патология в виде врожденных заболеваний (аномалий), редко выявляемых в общей популяции. Результаты нескольких исследований указывают на то, что ГКМП является наиболее частой причиной внезапной сердечной смерти у молодых тренированных атлетов, составляющей около 1/3 части фатальных событий. Вторые по важности и частоте — врожденные аномалии коронарных артерий, такие как неправильное отхождение сосуда от синуса Вальсальвы. Изучение аутопсий молодых спортсменов, умерших вследствие внезапной сердечной смерти, показывает, что кардиомиопатию ПЖ отмечают не часто. Скрининг в бессимптомных нормальных популяциях спортсменов позволяет выявить некоторые нарушения, особенно при сочетании 12-канальной ЭКГ и эхоКГ. Отстранение от соревнований и тренировок атлетов с сердечно-сосудистыми заболеваниями для проведения полной оценки патологии сердечно-сосудистой системы снижает риск возникновения внезапной сердечной смерти.
Оценку состояния спортсменов с нарушениями ритма сердца, органическими заболеваниями сердца или другими признаками и симптомами, указывающими на вероятность наличия сердечно-сосудистого заболевания, следует проводить так же, как и у других пациентов, но с учетом специфичности их занятий спортом.
Данные рекомендации были сделаны на основе неконтролируемых, ретроспективных и логически обоснованных наблюдений.
Профилактика внезапной сердечной смерти в период беременности
Беременным, у которых развилась гемодинамически нестабильная желудочковая тахикардия или фибрилляция желудочков, необходимо провести кардиоверсию или дефибрилляцию. У пациенток с наличием удлиненного интервала Q–T, у которых раньше отмечали симптомы заболевания, необходимо продление терапии блокаторами β-адренорецепторов на протяжении всего периода беременности и после родов, за исключением наличия противопоказаний к такой терапии.
Профилактика внезапной сердечной смерти у людей пожилого возраста
Не следует использовать искусственный кардиовертер-дефибриллятор у людей пожилого возраста, у которых прогнозируемая продолжительность жизни в связи с основным или сопутствующими заболеваниями менее 1 года. Для снижения общей смертности у людей пожилого возраста необходимо более активно применять блокаторы β-адренорецепторов.
Внезапная смерть у детей
В литературе последних лет большое внимание уделяется синдрому внезапной смерти у детей грудного возраста, причем этот синдром выделен в отдельную педиатрическую проблему. Данный синдром характеризуется неожиданной смертью практически здорового ребенка в возрасте от 7 дней до 1 года, при которой тщательно проведенная аутопсия не позволяет объяснить причину смерти. Существующие в данное время две основные гипотезы — нарушение дыхания в виде апноэ и нарушение сердечной деятельности не объясняют всех аспектов данной проблемы.
ПЕРВИЧНАЯ ПРОФИЛАКТИКА ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ ПРИ «ИСТИННО ЭЛЕКТРИЧЕСКИХ» ЗАБОЛЕВАНИЯХ СЕРДЦА
У пациентов с «истинно электрическими» феноменами, при которых повышается вероятность внезапной сердечной смерти, целесообразность первичной профилактики вызывает значительно меньше сомнений и дискуссий, чем у пациентов с ИБС, осложненной желудочковыми аритмиями.
Синдром удлиненного интервала Q–T
Особой формой жизненно опасных нарушений сердечного ритма являются полиморфные желудочковые тахикардии, которые возникают у пациентов с врожденным или приобретенным синдромом удлиненного интервала Q–T (Q–T-синдром). Обычно у лиц с врожденным Q–T-синдромом не отмечают никаких проблем в детстве. Но в подростковом или молодом возрасте у них появляются предсинкопальные состояния, обусловленные эпизодами полиморфной желудочковой тахикардии — пируэт-тахикардии. При отсутствии соответствующего лечения один из таких эпизодов может закончиться внезапной сердечной смертью. Первое сообщение о врожденном Q–T-синдроме сделали A. Jervell и F. Lange-Nielsen в 1957 г. У нескольких членов одной семьи они заметили сочетание глухонемоты, удлинения интервала Q–T и внезапной смерти в молодом возрасте. В 1963 г. Романо, a в 1964 г. Уорд сообщили об аутосомно-доминантном характере наследования удлинения Q–T и внезапной сердечной смерти, в отличие от аутосомно-рецессивного типа синдрома Джервелла — Ланге-Нильсена (Jervell — Lange-Nielsen). Хотя случаев врожденного Q–T-синдрома описано не так много (в международном реестре 1994 г. — около 500 семей), его истинная распространенность, вероятно, значительно больше, а клиническое значение обусловлено появлением синкопальных состояний, опасных для жизни аритмий и внезапной сердечной смерти. Около 21% пациентов с симптомами заболевания, не получающих лечение, умирают в течение года после первого синкопального эпизода, а в течение 10 лет смертность составляет 50%.
Впрочем, осуществление первичной профилактики внезапной сердечной смерти связано с рядом трудностей, обусловленных как разнообразием механизмов, так и гетерогенностью внешних проявлений (фенотипа) у пациентов с генетическими нарушениями, типичными для Q–T-синдрома. В частности, у 5–10% носителей генетических дефектов вообще не отмечают удлинения интервала Q–T; у около 5% членов семей с типичным Q–T-синдромом пароксизмы опасных для жизни полиморфных желудочковых тахикардий или эпизоды синкопе возникают на фоне нормального интервала Q–T.
Долгое время считали, что ключевое значение в «запуске» приступов, приводящих к внезапной сердечной смерти, имеет внезапная выраженная активация САС. Ведь приступы часто начинаются после значительной физической нагрузки или психоэмоционального возбуждения, или, например, после того, как в полной тишине громко включается будильник. Поэтому с целью предупреждения влияния «запускающих» факторов, триггеров, опасных для жизни аритмий, традиционно базисными средствами лечения Q–T-синдрома являются блокаторы β-адренорецепторов в высоких дозах. Их постоянное применение позволяет предупреждать синкопальные эпизоды в 75% случаев. Пациентам, у которых эффективность блокаторов β-адренорецепторов ограничена, выполняют хирургическое вмешательство — денервацию левого сердечного симпатического ганглия. Если аритмия возникает на фоне выраженной брадикардии или возможность повышения дозы блокаторов β-адренорецепторов ограничена вследствие брадикардии, применяют постоянную кардиостимуляцию. Пятилетняя смертность на фоне внедрения этих методов лечения снизилась и составила <5%.
Однако в последнее время стало ясно, что наши представления о Q–T-синдроме далеко не исчерпаны, а методы лечения не всегда соответствуют его истинным патогенетическим механизмам. Удивление вызывают не только разнообразные ЭКГ-проявления синдрома, например, тот факт, что успешное лечение Q–T-синдрома блокаторами β-адренорецепторов не сопровождалось нормализацией длительности интервала Q–T. Сложно объяснить также сообщения об отдельных случаях внезапной сердечной смерти во время сна. Существует не менее 3 генетических форм врожденного Q–T-синдрома, характеризующихся разными механизмами запуска пароксизмов пируэт-тахикардии. Более того, в одном из вариантов активность симпатического отдела вегетативной нервной системы даже играет защитную роль. Следовательно, не во всех случаях возникает потребность в назначении блокаторов β-адренорецепторов. При определенных генетических вариантах врожденного Q–T-синдрома эффективными также могут быть блокаторы натриевых каналов, в первую очередь мексилетин, уменьшающий длительность реполяризации; дискутируют также о целесообразности имплантации искусственного кардиовертера-дефибриллятора.
Значительно чаще в клинической практике встречаются пациенты с приобретенным Q–T-синдромом, возникновению которого способствует применение антиаритмических средств IА и III классов, высоких доз антидепрессантов, некоторых антибактериальных и антигистаминных препаратов. Неинвазивными предвестниками высокого риска пируэт-тахикардии вследствие аритмогенного действия лекарства являются длительность интервала Q–T свыше 600 мс, удлинение интервала T–U, наличие T-alternans (колебание конфигурации и амплитуды зубца T), изменение конфигурации TU в постэкстрасистолическом комплексе, а также наличие маленьких пируэтов (torsadelets). Существует целый ряд методов предупреждения тахикардии по типу «пируэт». Это, в частности, коррекция электролитных нарушений, особенно гипокалиемии и гипомагниемии, профилактика выраженной брадикардии на фоне антиаритмической терапии (в том числе путем постоянной кардиостимуляции), исключение препаратов IА и III классов (кроме амиодарона) у больных с низкой ФВ ЛЖ, снижение дозы антиаритмических средств при длительности корригированного интервала Q–T свыше 480 мс или дисперсии Q–T свыше 60 мс, продолжительное мониторирование пациентов групп высокого риска в начале применения антиаритмических средств, начало лечения в стационарных условиях.
Рекомендации по профилактике внезапной сердечной смерти у больных с синдромом удлиненного интервала Q–T приведены в табл. 6.26.
Таблица 6.26
Профилактика внезапной сердечной смерти у больных с синдромом удлиненного интервала Q–T
| Очень важно | Важно | Менее важно | |
| Стратификация риска | Остановка сердца
Фибрилляция желудочков Тахикардия по типу torsade de pointes Синкопе JLN* LQT3-генетический вариант |
Q–T корригированный >600 мс
Сердечные события в грудном возрасте Период после родов AV-блокада Альтерация зубца T Женский пол |
Внезапная коронарная смерть в семейном анамнезе
Дисперсия интервала Q–T |
| Первичная профилактика | Исключение средств, удлиняющих интервал Q–T
Коррекция уровня электролитов Исключение физических нагрузок* Блокаторы β-адренорецепторов* |
Изменение образа жизни
Блокаторы β-адренорецепторов |
Денервация левосердечного симпатического узла Пейсмекер |
| Вторичная профилактика | Имплантация кардиовертера-дефибриллятора** + блокаторы β-адренорецепторов
Исключение средств, удлиняющих интервал Q–T Исключение физических нагрузок |
Имплантация кардиовертера-дефибриллятора + блокаторы β-адренорецепторов | Блокаторы β-адренорецепторов |
*Эффективный у пациентов без синкопе или носителей генов без клинического проявления JLN-синдрома (Джервелла — Ланге-Нильсена) рецессивный вариант;
**можно рекомендовать больному.
Тактика прекращения пароксизма полиморфной тахикардии, ассоциированной с приобретенным удлинением интервала Q–T (пируэт-тахикардия), имеет некоторые особенности по сравнению с лечением обычного приступа желудочковой тахикардии. Обязательным первым шагом является отмена провоцирующего препарата, далее осуществляют коррекцию уровня электролитов, внутривенно вводят препараты магния, назначают препараты или кардиостимуляцию для повышения частоты сердечного ритма. Антиаритмические препараты в этом случае не только неэффективны, но и могут противодействовать прекращению пароксизма вследствие еще большего увеличения длительности реполяризации. Наоборот, при нормальной длительности интервала Q–T последовательно внутривенно вводят блокаторы β-адренорецепторов, лидокаин и амиодарон (табл. 6.27).
Таблица 6.27
Особенности ведения пациентов с полиморфной желудочковой тахикардией в зависимости от длительности интервала Q–T (по Kowey P.R. et al., 1999)
| Удлиненный Q–T | Нормальный Q–T |
|
|
Синдром Бругада
В 1992 г. братья Педро, Хосе и Рамон Бругада, работающие в разных клиниках в Бельгии, Испании и США, описали новый синдром, вызывающий внезапную сердечную смерть у лиц без структурного заболевания сердца. Этот синдром характеризуется особым типом ЭКГ (блокада правой ножки пучка Гиса, подъемы сегмента ST) (рис. 6.1), а также эпизодами желудочковой тахикардии, которые могут привести к внезапной сердечной смерти. Авторы сообщения сразу предположили, что это заболевание имеет наследственный характер. Наличие генетического дефекта, который служит причиной синдрома Бругада, было доказано уже в 1997 г. Дефект локализован в 3-й хромосоме и поражает один из натриевых каналов. Нарушения состава канала, обусловленные этими врожденными изменениями, приводят к нарушениям электрической функции сердца и летальным сердечным аритмиям.
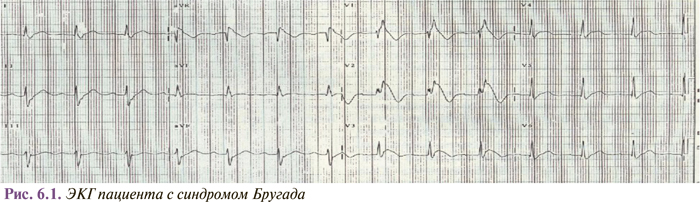
Синдром Бругада выявляют у мужчин и женщин, а также в детском возрасте. У детей, у которых болен один из родителей, вероятность заболеть составляет 50%. Случаи этого синдрома были зарегистрованы во всем мире, но особенно часто — в Японии и Южной Азии. По оценке братьев Бругада, в Европе и Америке частота случаев внезапной сердечной смерти вследствие этого синдрома составляет около 1 на 10 тыс. жителей в год. Причем в среднем внезапная сердечная смерть происходит в возрасте 40 лет.
При распознавании этого синдрома проводят скрининговое обследование всех членов семьи. Обязательно регистрируют ЭКГ и анализируют состав ДНК, а при необходимости осуществляют ЭФИ. Единственным эффективным методом лечения является имплантация искусственного кардиовертера-дефибриллятора, который распознает аритмию и немедленно прекращает ее электрическим разрядом 700 вольт. К сожалению, ни один из антиаритмических препаратов не обеспечивает адекватной защиты при этом синдроме. Если не имплантирован искусственный кардиовертер-дефибриллятор, 30% пациентов умирают на протяжении 3 лет после первого возникновения симптомов. Разрабатываются средства генной терапии для коррекции генетического дефекта и возвращения нормальной электрической активности сердца. Очень близким по своим клиническим проявлениям к синдрому Бругада является феномен внезапной смерти неустановленной этиологии в Юго-Восточной Азии. Его изучение началось задолго до появления первой публикации о синдроме Бругада. Хорошо известно, что в конце войны во Вьетнаме много беженцев из Лаоса, Камбоджи и Вьетнама прибыли в США. Уже в 1976–1977 гг. американские центры по контролю и предотвращению заболеваний отмечали весьма высокий уровень смертности среди молодых мужчин, прибывших из Юго-Восточной Азии. Синдром так и назвали — синдром непонятной внезапной смерти (sudden unexplained death syndrome). Всего тогда был зарегистрирован 121 случай. Большинство смертей произошло ночью во время сна. Средний возраст жертв составил 32 года. Но фактически этот синдром был известен еще раньше: на Филиппинах его называли «бангунгут», в Японии — «поккури», в Тайланде — «ругай таи». Эти термины переводят как «смерть людей ночью во сне», наступающая преимущественно у молодых мужчин. Синдром особенно распространен в Таиланде, где в отдельных регионах является второй по частоте после автомобильных катастроф причиной смерти молодых мужчин: ежегодная смертность составляет около 40 на 100 тыс.
У нескольких обследованных пациентов с этим синдромом, реанимированных после эпизода остановки сердца, были интактные коронарные артерии, нормальная функция ЛЖ и ПЖ при проведении эхоКГ или ангиографии ПЖ. Все они адекватно выполняли пробу с физической нагрузкой на тредмилле. Во время нагрузки не было изменений интервала Q–T; при эхоКГ-исследовании не выявляли структурных изменений миокарда, в частности ГЛЖ. Впрочем, на ЭКГ, так же, как и при синдроме Бругада, зарегистрировали тип блокады правой ножки пучка Гиса со значительным увеличением интервала ST в нескольких отведениях. У всех пациентов на сигнал-усредненной ЭКГ находили ППЖ, а фибрилляция желудочков легко вызывалась одним или двумя преждевременными стимулами при инвазивном ЭФИ.
Вполне вероятно, что с увеличением количества зарегистрированных пациентов синдром непонятной сердечной смерти окажется одной из клинических форм синдрома Бругада, поскольку последний имеет более широкий диапазон клинических проявлений. Таким образом, имплантация искусственного кардиовертера-дефибриллятора является единственным методом эффективной первичной профилактики внезапной сердечной смерти.
Рекомендации по стратификации риска, первичной и вторичной профилактике внезапной сердечной смерти у больных с синдромом Бругада приведены в табл. 6.28.
Таблица 6.28
Рекомендации по профилактике внезапной сердечной смерти у больных с синдромом Бругада
| Очень важно | Важно | Менее важно | |
| Стратификация риска | Имплантация кардиовертера-дефибриллятора* у больных с синкопе/желудочковой тахикардией | ЭФИ
Имплантация кардиовертера-дефибриллятора у больных без симптомов с индуцируемой желудочковой тахикардией/фибрилляцией желудочков |
|
| Первичная профилактика | Стойкая желудочковая тахикардия
Остановка сердца/фибрилляция желудочков |
Семейный анамнез внезапной сердечной смерти | |
| Вторичная профилактика | Имплантация кардиовертера-дефибриллятора* |
*Можно рекомендовать больному.
Идиопатическая фибрилляция желудочков
К этой категории принадлежат пациенты, пережившие остановку сердца вследствие фибрилляции желудочков, но у которых не выявлены изменения структурно-функционального состояния миокарда. Перспектива исследований патогенеза идиопатической фибрилляции желудочков связана с выявлением генетических маркеров внезапной сердечной смерти, а также структурных нарушений на молекулярном уровне. В странах Западной Европы и США с этой целью создан ряд реестров для обобщения данных длительного наблюдения пациентов, реанимированных после идиопатической фибрилляции желудочков, а также тем, кому имплантировали искусственный кардиовертер-дефибриллятор. Можно надеяться, что эти исследования позволят уточнить механизмы внезапной сердечной смерти и лучше оценивать прогноз выживаемости этих пациентов.
Алгоритмы дифференцированного ведения больных с желудочковыми нарушениями ритма
Ведение больных с желудочковыми нарушениями ритма обязательно предусматривает коррекцию образа жизни, диетические мероприятия, лечение основного заболевания, а также попытки устранения всех вероятных факторов, способствующих появлению аритмии, в том числе препаратов, которые в определенных условиях могут приводить к возникновению и усилению аритмий (табл. 6.29). Только при неэффективности этих мероприятий начинают антиаритмическую терапию (табл. 6.30).
Таблица 6.29
Предикторы возникновения аритмогенного действия антиаритмических препаратов
| Антиаритмические препараты IA и III класса | Антиаритмические препараты IC класса |
| Удлиненный интервал Q–T (Q–Tc >460 мс)
Синдром удлиненного интервала Q–T Структурные заболевания сердца, ГКМП Дисфункция ЛЖ Гипокалиемия/гипомагниемия Женский пол Дисфункция почек Исходная брадикардия Быстрое повышение дозы препаратов Высокие дозы (соталол, дофетилид) Накопление препарата Добавление других препаратов:
Аритмогенные эффекты в анамнезе Значительное увеличение продолжительности интервала Q–T после приема препарата |
Широкий комплекс QRS (>120 мс)
Желудочковая тахикардия, ассоциированная со структурным заболеванием сердца Дисфункция ЛЖ Высокая частота желудочковых сокращений:
Быстрое повышение дозы Высокие дозы дополнительных препаратов Средства с отрицательным инотропным эффектом Чрезмерное (более чем на 150%) распространение комплекса QRS от начального (на момент назначения терапии) |
Таблица 6.30
Средства первого выбора при лечении желудочковых нарушений ритма в зависимости от их клинико-гемодинамического и прогностического значения
| Клинико-гемодинамическое значение аритмии | Прогностическое значение | ||
| Доброкачественные | Потенциально злокачественные | Злокачественные | |
| Нет клинических симптомов | Не требуют лечения | Лечение основного заболевания | |
| Есть клинические симптомы и/или нарушение гемодинамики | Седативные, блокаторы β-адренорецепторов, пропафенон | После перенесенного ИМ — блокаторы β-адренорецепторов, при хронической ИБС — соталол, при систолической дисфункции миокарда и СН — ингибиторы АПФ, амиодарон | При систолической дисфункции миокарда и СН — амиодарон или соталол в сочетании с ингибиторами АПФ и низкими дозами блокаторов β-адренорецепторов, в других случаях возможны отбор препаратов I класса, радиочастотная катетерная абляция, имплантация кардиовертера-дефибриллятора |
У больных с доброкачественными желудочковыми нарушениями ритма единственной целью лечения является устранение симптомов, отрицательно влияющих на качество жизни больных; поэтому если больной не предъявляет жалоб, назначение антиаритмической терапии нецелесообразно. В противном случае препаратами выбора прежде всего являются седативные средства и блокаторы β-адренорецепторов (пропранолол 60–80 мг/сут или метопролол 50–100 мг/сут), терапия которыми связана с минимальным риском кардиальных побочных эффектов. Критерием дальнейшего выбора при их неэффективности, учитывая относительно незначительный риск аритмогенных проявлений у этой категории больных, является риск развития экстракардиальных побочных эффектов. В дальнейшем целесообразно применять пропафенон (450–600 мг/сут), сочетающий свойства класса IС и блокаторов β-адренорецепторов, или морацизин (400–800 мг/сут). Эти препараты эффективны и менее токсичны, чем препараты классов IA и IB.
Цель лечения при потенциально злокачественных желудочковых нарушениях ритма — не только устранение аритмии, но и улучшение прогноза больных. У многих больных с СН уменьшения количества желудочковых нарушений ритма по данным холтеровского мониторирования ЭКГ достигают уже при традиционном лечении ингибиторами АПФ, которые достоверно улучшают долгосрочный прогноз. Определенное значение имеет также коррекция уровня калия и магния в крови, особенно на фоне терапии петлевыми или тиазидными диуретиками. При неэфективности этих мер осторожно используют блокаторы β-адренорецепторов или амиодарон. При отсутствии противопоказаний блокаторы β-адренорецепторов обязательно рекомендуют больным, перенесшим острый ИМ, поскольку эти препараты предотвращают внезапную сердечную смерть и повышают выживаемость больных. Но в этом случае их доза выше, чем при лечении доброкачественных аритмий (пропранолол 80–120 мг/сут). При частых клинически выраженных желудочковых нарушениях ритма у больных после перенесенного ИМ при недостаточной эффективности блокаторов β-адренорецепторов наиболее безопасным, учитывая риск аритмоген-ных проявлений, является применение соталола (160–240, иногда 320 мг/сут) и амиодарона. Обычно доза амиодарона при длительном применении не должна превышать 200–300 мг/сут, что позволяет существенно снизить риск экстракардиальных побочных эффектов препарата. Только при неэффективности этого средства оценивают эффективность антиаритмических лекарственных средств I класса, причем преимущество отдают менее арит-могенным препаратам классов IA и IB.
Средствами выбора для прекращения пароксизма мономорфной желудочковой тахикардии является новокаинамид или амиодарон внутривенно. При злокачественных желудочковых нарушениях ритма у больных с тяжелой дисфункцией ЛЖ бесспорным препаратом выбора является амиодарон, возможно, в комбинации с низкими дозами блокаторов β-адренорецепторов (метопролол 6,25–25,0 иногда 50 мг/сут) и, конечно, в сочетании с ингибиторами АПФ. Доза амиодарона в период насыщения составляет 600–1200 мг/сут, в дальнейшем ее снижают до минимально эффективной. При отсутствии признаков тяжелой дисфункции миокарда и/или СН можно применить соталол в терапевтической дозе (160–320 мг/сут). При неэффективности или противопоказаниях к применению этих препаратов оценивают эффективность антиаритмических средств классов IA или IB (лидокаин, мексилетин, новокаинамид, дизопирамид, хинидин) и только потом — препаратов класса IC. Подчеркнем, что до настоящего времени ни в одном из выполненных исследований антиаритмические препараты I класса не улучшили долгосрочный прогноз больных со злокачественными желудочковыми нарушениями ритма.
При пароксизмах желудочковой тахикардии, которые сопровождаются выраженными нарушениями гемодинамики (отек легких, кардиогенный шок, потеря сознания), средством выбора является электрическая кардиоверсия. Алгоритм, рекомендованный ЕКО, определяет тактику лечения пароксизма стойкой желудочковой тахикардии в зависимости от наличия проявлений нарушения гемодинамики, уровня электролитов крови, эффективности лекарственных средств и электрической кардиоверсии (схема 6.1).
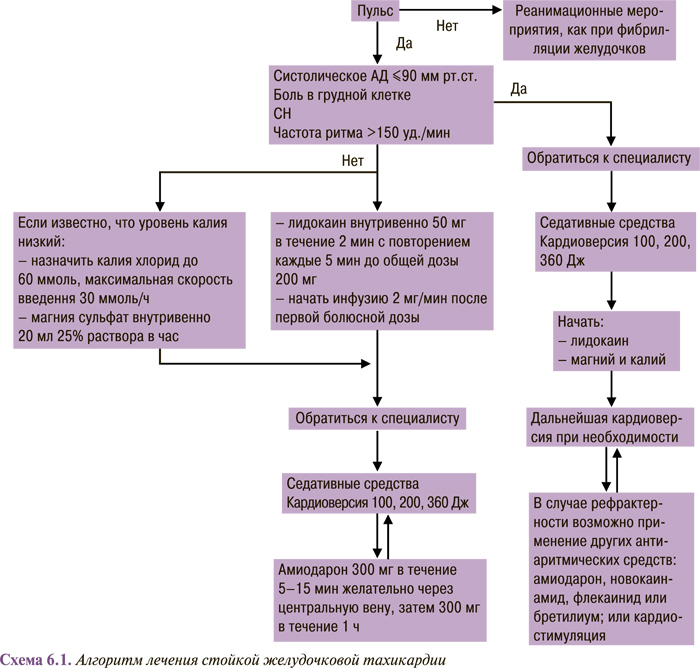
ТАХИКАРДИЯ С ШИРОКИМИ КОМПЛЕКСАМИ (СТОЙКАЯ ЖЕЛУДОЧКОВАЯ ТАХИКАРДИЯ)
В развитых странах широко применяют радикальные немедикаментозные методы лечения злокачественных желудочковых нарушений ритма: радиочастотную абляцию эктопических очагов и имплантацию искусственного кардиовертера-дефибриллятора.
Целесообразно ли применять антиаритмические средства для повышения эффективности реанимационных мероприятий при остановке сердца, особенно в случаях, когда после дефибрилляции не удается восстановить синусовый ритм сердца? Бесспорно, недостаток убедительных данных относительно эффективности антиаритмических препаратов при условиях сердечно-легочной реанимации обусловлен особенностями клинической ситуации и трудностями организации контролируемых исследований. Проблема состоит также в том, что препараты могут быть эффективными, но не достигать клеточных мембран, где реализуется их фармакологическое действие, в связи с неадекватным кровоснабжением жизненно важных органов. Первым препаратом, для которого получены адекватные доказательства эффективности при остановке сердца, стал амиодарон. В 1999 г. в США закончилось уникальное плацебо-контролируемое исследование ARREST, которое осуществлялось в «полевых» условиях, вне стационаров. Пациентам с остановкой сердца вследствие фибрилляции желудочков или желудочковой тахикардии после трехразовой дефибрилляции еще до поступления в клинику рандомизированно внутривенно вводили амиодарон 300 мг (n=246) или плацебо (n=258). Применяли также все стандартные мероприятия сердечно-легочной реанимации, включая при необходимости введение других антиаритмических средств.
Первичной конечной точкой исследования была выживаемость пациентов при поступлении в госпиталь. Этот показатель составлял 44% пациентов после парентерального введения амиодарона и 34% — в группе плацебо. Следовательно, относительное улучшение прогноза выживаемости составляло почти 30%, абсолютное — 10%, что было статистически достоверным (р=0,03). Это означает, что при применении амиодарона у 10 пациентов с остановкой сердца, рефрактерной к повторным электрическим дефибрилляциям, удалось дополнительно спасти до поступления в госпиталь еще одного пациента. Подчеркнем, что назначение амиодарона было эффективным, несмотря на более частое возникновение гипотензии и брадикардии в группе активного лечения по сравнению с плацебо. До этого времени не установлено, позволяет ли введение амиодарона улучшать долгосрочный прогноз выживаемости у пациентов, которые перенесли остановку сердца. Впрочем, учитывая результаты исследования ARREST, в 2000 г. в алгоритмы сердечно-легочной реанимации при фибрилляции желудочков включили рекомендацию вводить амиодарон в дополнение к стандартным реанимационным средствам. Амиодарон — единственный антиаритмический препарат, рекомендованный в настоящее время для внутривенного применения при рефрактерности к повторным процедурам электрической дефибрилляции сердца.
НЕОТЛОЖНАЯ ПОМОЩЬ ПРИ ВНЕЗАПНОЙ ОСТАНОВКЕ КРОВООБРАЩЕНИЯ
Догоспитальный этап
Единственной наиболее важной детерминантой выживаемости пациентов после внезапной смерти является время от начала остановки кровообращения до проведения электрической дефибрилляции. В норме миокард сокращается одновременно, единым мышечным пластом, каждое его волокно своевременно получает посредством проводящей системы электрический импульс. Фибрилляции желудочков — несинхронизированные сокращения отдельных волокон и мышечных групп. Этот процесс крайне энергоемкий, использование кислорода очень высокое, в условиях гипоксии миокард нечувствителен к импульсам, которые генерируются в синусном узле, поэтому условий для самостоятельного восстановления эффективного ритма практически нет.
В развитии фибрилляции желудочков выделяют 4 стадии:
А — трепетание желудочков, длящееся 2 с, при котором происходят координированные сокращения, а на ЭКГ регистрируют высокоамплитудные ритмические волны с частотой 250–300/мин.
Б — судорожная стадия (1 мин), при которой происходят хаотические некоординированные сокращения отдельных участков миокарда с появлением на ЭКГ высокоамплитудных волн с частотой до 600/мин.
В — стадия мерцания желудочков (мелковолновая фибрилляция желудочков) продолжительностью около 3 мин. Хаотическое возбуждение отдельных групп кардиомиоцитов проявляется на ЭКГ хаотическими низкоамплитудными волнами с частотой >1000/мин.
Г — атоническая стадия — затухающие возбуждения отдельных участков миокарда, на ЭКГ нарастает длительность и снижается амплитуда волн при их частоте <400/мин.
Механизмы фибрилляции желудочков таковы: повышение автоматизма в одном или нескольких участках миокарда, повторный вход волны возбуждения (re-entry) и сочетание этих механизмов.
Через 15–30 с от начала фибрилляции желудочков больной теряет сознание, через 40–50 с развиваются характерные судороги — одновременное тоническое сокращение скелетных мышц. Расширяются зрачки, достигая максимального размера через 1,5 мин. Шумное и частое дыхание прекращается на 2-й минуте клинической смерти.
Таким образом, время, отпущенное на проведение реанимации со значительными шансами на успех, мизерное — немногим более 1 мин (этот период соответствует крупноволновой фибрилляции: трепетание и судорожная стадии). В этот период необходимо проведение электрической дефибрилляции. Электрический разряд при кардиоверсии вызывает кратковременную асистолию и полную деполяризацию миокарда, что дает возможность собственным центрам автоматизма восстановить гемодинамически значимую электрическую активность. В этом заключается цель дефибрилляции.
Использование дефибрилляторов с устройством для немедленной регистрации ЭКГ с электродов дефибриллятора обеспечивает быстрое определение механизма остановки кровообращения и позволяет ускорить проведение кардиоверсии.
До внедрения автоматических внешних дефибрилляторов спонтанное восстановление кровообращения отмечали только у 15% больных с внезапной смертью вне стационара. Из них только 50% доживало до выписки (то есть 5–7%). Если рассматривать только фибрилляции желудочков, то выживаемость к выписке составляла 15–20%. Если амбулаторный персонал быстро прибывал на место события и имел внешние дефибрилляторы, выживаемость повышалась до 25–28%.
Остановка кровообращения чаще случается дома (2/3 случаев), у мужчин старше 50 лет (3/4 случаев), в течение дня (8–18 ч), при свидетелях (2/3 случаев). Лица, которые обычно находятся в данное время рядом с потенциальной жертвой внезапной сердечной смерти — это домохозяйки, члены семьи, родственники. Соответственно учебные программы по оказанию неотложной помощи при внезапной остановке сердца должны быть рассчитаны прежде всего на них.
Предложена так называемая цепочка выживания для наиболее эффективного предоставления помощи пациентам с внезапной остановкой кровообращения:
- первое звено — ранний приступ, который включает распознавание данной ситуации, вызов и доставку опытного персонала к пациенту;
- второе — ранняя сердечно-легочная реанимация, которой обычно достаточно для поддержания пациента до приезда опытной бригады (алгоритм BLS, схема 6.2). Следует отметить, что по данным литературы любая сердечно-легочная реанимация, даже только компрессия грудной клетки, значительно лучше, чем ее отсутствие;
- третье — ранняя дефибрилляция;
- четвертое — наиболее раннее предоставление квалифицированной и специализированной медицинской помощи (алгоритм Advanced Cardiac Life Support, схема 6.3).
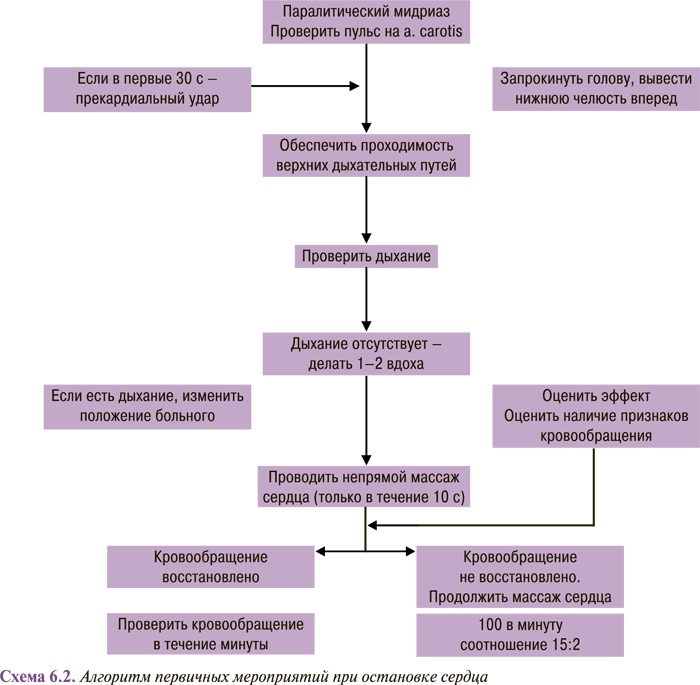

Если причиной внезапной остановки кровообращения является фибрилляция предсердий желудочков, то неотложная помощь сводится к немедленному проведению дефибрилляции. Если восстановить сердечный ритм не удалось, необходимо немедленно начать закрытый массаж сердца и искусственную вентиляцию легких (ИВЛ) в соответствии с алгоритмом АCLS. Приведенный алгоритм BLS во многом совпадает с известным перечнем реанимационных мероприятий, которые входят в реанимационный алфавит П. Сафара, известный также как система АВС:
А — Airway — обеспечение проходимости дыхательных путей.
B — Breath — искусственная вентиляция легких приступообразным методом, например при дыхании способом «рот в рот».
C — Circulation — обеспечение гемоциркуляции — непрямой массаж сердца.
D — Drugs — введение лекарственных препаратов.
E — Electrocardiography — регистрация ЭКГ.
F — Fibrillation — проведение при необходимости электрической дефибрилляции (кардиоверсии).
G — Gauge — оценка первичных результатов.
H — Hypothermy — охлаждение головы.
I — Intensive care — проведение интенсивной терапии постреанимационных синдромов.
До недавнего времени рекомендации по сердечно-легочной реанимации рассматривали отсутствие пульса на каротидных артериях как диагностический шаг, который является определяющим для начала проведения непрямого массажа сердца. Последние исследования показали, что время, необходимое для определения наличия или отсутствия пульсации сонных артерий, значительно больше, чем рекомендуемые 5–10 с. В результате этих исследований появились рекомендации о том, что определение каротидного пульса должно выполняться только медицинскими работниками, а критерием для начала компрессии грудной клетки должны быть признаки отсутствия кровообращения, включающие отсутствие движений, кашля, дыхания, появление паралитического мидриаза. Время, которое отводится на их определение, — 10 с. Компрессию грудной клетки следует проводить с частотой 100 в 1 мин как у взрослых, так и у детей при положении рук на грудине на 2 поперечных пальца выше мечевидного отростка, строго по средней линии.
При комбинации вентиляции легких способом изо рта в рот с непрямым массажем сердца рекомендовано соотношение 15 компрессий грудной клетки на 2 вдоха.
Госпитальный этап
На госпитальном этапе рекомендуется придерживаться приведенного алгоритма ACLS.
Дефибрилляция
У взрослых пациентов аритмиями, приводящими к остановке кровообращения, наиболее часто являются фибрилляция желудочков и желудочковая тахикардия без пульса. Под желудочковой тахикардией без пульса понимают длительный пароксизм желудочковой тахикардии с выраженными нарушениями гемодинамики, вплоть до аритмического шока, в отличие от желудочковой тахикардии с пульсом, к которой относятся все другие кратковременные или длительные пароксизмы желудочковой тахикардии без нарушений гемодинамики).
Мероприятия, улучшающие отдаленную выживаемость после указанных состояний — это прежде всего дефибрилляция и последующая сердечно-легочная реанимация. Успех проводимой дефибрилляции прямо пропорционален времени ее начала. Разряды следует наносить группами по 3, с энергией 200–200–360 Дж (раньше рекомендовали режим — 200–300–360 Дж). Для проведения 3 последовательных кардиоверсий дается 1 (!) мин.
Вентиляция
Трахеальная интубация до настоящего времени является наиболее оптимальным способом вентиляции. ИВЛ без нее вызывает высокий риск осложнений: перерастяжение желудка, регургитацию, легочную аспирацию. Рекомендуемый ранее объем одного вдувания составлял, как правило, 800–1200 мл каждые 1–1,5 с. Недавно было установлено, что для вентиляции достаточно применения меньших объемов, так как продукция СО2 во время остановки сердца крайне незначительна. Исходя из этих рекомендаций — это объем 10 мл/кг массы тела (700–1000 мл) или 7 мл/кг массы тела (400–600 мл), если к воздуху добавляется кислород. Если ИВЛ проводится путем интубации, то при ее проведении нет необходимости синхронизации с компрессией грудной клетки, так как непрерывная компрессия лучше обеспечивает коронарную перфузию. Исследования, посвященые оценке эффективности предложенных в последнее десятилетие новых методов специализированного реанимационного комплекса, показали что такие способы, как активная компрессия-декомпрессия с использованием кардионасоса, вставленная абдоминальная компрессия (сжатие живота сразу после сжимания грудной клетки), кашлевая аутореанимация, не доказали преимущества перед традиционными способами реанимации. В то же время ускорение сжатий (до 100 в мин), а также одновременная компрессия грудной клетки и вдувание воздуха в легкие (через интубационную трубку) доказали свое достоверное влияние на повышение выживаемости и включены в современные алгоритмы сердечно-легочной реанимации. В первом случае повышение частоты компрессии грудной клетки ассоциируется с увеличением искусственного кровотока, во втором — рост внутрилегочного давления приводит к более активному поступлению крови из легких в системное кровообращение.
Прекардиальный удар
Одноразовый прекардиальный удар (наносится кулаком в область нижней трети грудины) может проводиться медицинскими работниками, если фибрилляция случается при свидетелях или фиксируется на мониторе (то есть фибрилляциа желудочков документирована или проведена клиническая оценка ситуации профессионалом, как отвечающая классическому описанию фибрилляции желудочков). При внезапной остановке кровообращения, которая длится более 30 с, прекардиальный удар неэффективен!
Доступ к сосудам
Центральная вена — оптимальный путь быстрого введения лекарственных препаратов в центральное кровообращение. Катетеризация периферической вены быстрее, проще, безопаснее, однако такой путь введения препарата, без сомнения, менее эффективен. Введение лекарственных препаратов в этом случае должно осуществляться струйно в 10–20 мл 0,9% раствора натрия хлорида. Конечности с катетеризированной веной в этом случае необходимо придать приподнятое положение. При невозможности обеспечить венозный доступ рекомендуется эндотрахеальное введение лекарственных препаратов. Препарат, который вводится (например эпинефрин) в повышенной в 2–3 раза дозе, разводят в 10 мл раствора натрия хлорида, вводят через интубационную трубку или транстрахеально через иглу. Для обеспечения быстрого всасывания препарата после его введения в эндотрахеальную трубку несколько раз нагнетают воздух, стимулируя образование аэрозоля.
Специфическая медикаментозная терапия
Вазопрессоры. Эпинефрин улучшает кровообращение по коронарным, церебральным сосудам во время непрямого массажа сердца, обеспечивая тем самым так называемую централизацию кровообращения. Кроме того, эпинефрин способствует переводу мелковолновой фибрилляции желудочков в крупноволновую, которую легче прекратить с помощью кардиоверсии. Относительно дозирования препарата мнения были разные. В экспериментах на животных по улучшению коронарного и церебрального кровотока доказана эффективность эпинефрина в высоких дозах по сравнению со стандартными. Но сегодня в проведенных исследованиях клинических доказательств этого факта по отношению к людям не получено. Установлено, что повышение частоты восстановления спонтанной циркуляции во время работы с высокими дозами эпинефрина не выявлен рост выживаемости пациентов с внезапной остановкой кровообращения. Поэтому показания, интервал между введенными дозами эпинефрина, как и дозы, остаются прежними: 1 мг эпинефрина каждые 3 мин. Обратим внимание, что при условии восстановления рефрактерной фибрилляции желудочков реанимационные мероприятия состоят из чередования повторных дефибрилляций, введения эпинефрина, проведения основных реанимационных (комплекс первичной быстрой сердечно-легочной реанимации) и дополнительных специализированных мероприятий (повторное использование лекарственных антиаритмических средств). Вышеупомянутые действия продолжаются до восстановления сердечной деятельности или развития стойкой асистолии.
По данным литературы, в эксперименте вазопрессин (40 Ед) занимает ведущее место среди других препаратов, применяющихся для восстановления коронарной перфузии. На сегодня вазопрессин рассматривается как возможная альтернатива эпинефрина.
Амиодарон. Считается препаратом выбора у пациентов с фибрилляцией желудочков/желудочковой тахикардией, рефрактерных к трем начальным разрядам дефибриллятора. 300 мг, разведенные в 20 мл 5% раствора глюкозы, введенные болюсно, являются стартовой дозой. Дополнительно рекомендуют обеспечить инфузию данным препаратом 1 мг/мин на протяжении 6 ч, а затем со скоростью 0,5 мг/мин. На этом фоне возможно дополнительное введение 150 мг амиодарона (в таком же разведении), если фибрилляции желудочков/желудочковая тахикардия повторяются, вплоть до достижения максимальной дозы — 2 мг. Лидокаин или прокаинамид в настоящее время могут рассматриваться как альтернатива амиодарону только при его недоступности, но не должны (!) вводиться вместе с ним. При одновременном введении 2 (тем более 3) упомянутых антиаритмических препаратов существует реальная угроза как потенцирования сердечной слабости, так и проявления их проаритмического действия. Кроме того, необходимо помнить о нежелательном сочетании амиодарона с другими препаратами (табл. 6.31).
Таблица 6.31
Нежелательные взаимодействия амиодарона с другими препаратами
| Препарат | Растворитель | Амиодарон | Ппримечание |
| Аминофиллин | 5% раствор глюкозы | 4 мг/мл | Преципитация |
| Цефамандол | 5% раствор глюкозы | 4 мг/мл | Преципитация |
| Цефазолин | 5% раствор глюкозы | 4 мг/мл | Преципитация |
| Мезлоциллин | 5% раствор глюкозы | 4 мг/мл | Преципитация |
| Гепарин | 5% раствор глюкозы | 4 мг/мл | Преципитация |
| Натрия гидрокарбонат | 5% раствор глюкозы | 4 мг/мл | Преципитация |
Насыщающая инфузия
Начальная быстрая: растворить 150 мг в 100 мл 5% раствора глюкозы, вводить медленно на протяжении 15 мин (15 мг/мин).
Примечание: в случае остановки сердца вследствие стойкой к электроимпульсной терапии фибрилляции желудочков/трепетания желудочков с отсутствием пульса начальная доза должна составлять 300 мг внутривенно струйно, согласно указаниям АСLC 2000 г.).
Поливиниловая1 или стеклянная емкость.
Последующая медленная: растворить 900 мг в 500 мл 5% раствора глюкозы, вводить медленно со скоростью 33,3 мл/ч (1 мг/мин) на протяжении последующих 6 ч.
Стеклянная1 или полиолефиновая емкость.
Поддерживающая инфузия.
Уменьшить скорость до 0,5 мг/мин, вводить со скоростью 16,6 мл/ч на протяжении оставшихся 18 ч.
Дополнительная инфузия
Растворить 150 мг в 100 мл 5% раствора глюкозы, вводить медленно на протяжении 10 мин (15 мг/мин).
Поливиниловая1 или стеклянная2 емкость.
- Во время внутривенного введения амиодарона следует применять инфузионный насос, рекомендуется использование встроенного фильтра;
- сохранять ампулы в картонной упаковке до момента приготовления раствора с целью защиты от попадания света;
- приготовленный раствор не следует хранить дольше 24 ч;
- использование концентрации более 3 мг/мл в 5% растворе глюкозы приводит к повышению риска возникновения флебитов периферических вен.
Для инфузии продолжительностью более 1 ч концентрация амиодарона не должна превышать 2 мг/мл, если инфузия не проводится через центральный катетер.
Установлено, что для внутривенного введения амиодарона непригодны пластиковые емкости, включая поливиниловые трубки (эффект прилипания к пластиковой стенке). Степень этого процесса увеличивается при инфузии амиодарона в более высоких концентрациях и при меньшей скорости введения.
После первых 24 ч необходимо придерживаться скорости поддерживаемой инфузии 0,5 мг/мин (720 мл за 24 ч) при концентрации 1–6 мг/мл. Препарат в концентрации, превышающей 2 мг/мл, следует вводить в центральный катетер. Возможность проведения инфузии более 3 нед не изучали. Переход на пероральный прием рекомендуется осуществлять как можно быстрее.
Лидокаин вводят в дозе 80 мг внутривенно струйно, затем проводят инфузию препарата со скоростью 2 мг/мин. Болюсное введение прокаинамида в настоящее время не рассматривается, рекомендуется инфузия препарата — 30 мг/мин до достижения общей дозы — 17 мг/кг. Необходимость такой относительно медленной инфузии делает введение прокаинамида менее значимым. Магния сульфат (8 ммоль) рекомендуется при рефрактерной фибрилляции желудочков, особенно если подозревается гипомагниемия у пациентов, длительно получающих тиазидные или петлевые диуретики (салуретики), а также при полиморфной веретенообразной желудочковой тахикардии (типа пируэт). Бретилия тозилат в настоящее время использовать не рекомендуется. Также нет данных об эффективном применении блокаторов β-адренорецепторов (пропранолола) с целью купирования желудочковой тахиаритмии.
Потери меньше 10% на протяжении 2 ч.
Антиаритмические средства, использующиеся при рефрактерной фибрилляции желудочков, по эффективности могут быть расположены в таком порядке: амиодарон, лидокаин, прокаинамид. Подтверждена эффективность атропина в лечении гемодинамически значимых брадиаритмий. В то же время рекомендации относительно кратности введения препарата несколько изменились: в связи с возможными побочными эффектами предлагается ограничить его введение однократной дозой 3 мг внутривенно. Эта доза достаточна для блокирования вагусной активности у взрослых пациентов. Алгоритм действий врача при развитии остановки кровообращения в связи с асистолией или электромеханической диссоциацией в предыдущих рекомендациях предлагал введение атропина каждые 3 мин по 1 мг внутривенно до достижения общей дозы 0,4 мг/кг. Нетрудно подсчитать, что представленная методика «растягивала» среднюю общую дозу атропина на 10 мин, в то же время предложенный протокол предусматривает ее полное введение уже в первые минуты реанимации.
Возможные обратимые причины неэффективности сердечно-легочной реанимации
- гипоксия;
- гиповолемия;
- гипотермия;
- напряженный пневмоторакс;
- тампонада сердца;
- тромбоэмболическая или механическая обструкция;
- токсические или терапевтические эффекты при передозировке лекарственных средств;
- гипер/гипокалиемия, гипокальциемия, ацидоз (определение этих состояний и их коррекция возможны только при контроле кислотно-основного состояния по показателям сыворотки крови).
Каждая из этих причин требует проведения специальной коррекции.
До настоящего времени сохранилось рутинное и ошибочное частое использование во время остановки кровообращения хлористого кальция и гидрокарбоната натрия. Отказ от применения хлорида кальция обусловлен документированным увеличением количества реперфузионных осложнений, развитием кальциевой перегрузки и контрактуры кардиомиоцитов. Этот препарат показан только (!) при реанимации пациентов с передозировкой блокаторов медленных кальциевых каналов и при наличии исходной гиперкалиемии. Препарат вводится в дозе 500–1000 мг внутривенно струйно медленно в виде 5–10% раствора.
Подтверждается нецелесообразность и потенциальный вред раннего (с первых минут реанимации) и бесконтрольного (невозможность определения показателей кислотно-основного состояния) введения гидрокарбоната натрия. Организм значительно хуже адаптирован к алкалозу, чем к умеренному ацидозу, который, к тому же, сразу после остановки кровообращения имеет респираторный характер и может быть с успехом корригирован с помощью ИВЛ. Переход к метаболическому ацидозу отмечают через 10–15 мин с момента начала сердечно-легочной реанимации, а необходимость введения раствора гидрокарбоната натрия актуальна при снижении pH до уровня 7,1–7,2 и ниже. При длительной остановке кровообращения (в течение 15–20 мин) и отсутствии интубации трахеи, а соответственно недостаточной эффективности ИВЛ развитие гипоксического лактацидоза является противопоказанием для введения бикарбоната натрия. В условиях неэффективной ИВЛ на фоне введения гидрокарбоната натрия отмечают усиление ацидоза внутри клетки за счет накопления двуокиси углерода, которая интенсивно образуется в процессе расщепления натрия гидрокарбоната при отсутствии дыхания. СО2 легко проникает через клеточную мембрану, тогда как гидроксильная группа задерживается.
Опыт современной медицины подтверждает, что четкое немедленное и осмысленное проведение комплекса неотложных лечебных мероприятий (выполнение разработанных алгоритмов предоставления реанимационной помощи при внезапной сердечной смерти) дает шанс для спасения человеческой жизни.
АВТОМАТИЧЕСКИЕ ВНЕШНИЕ ДЕФИБРИЛЛЯТОРЫ И ДЕФИБРИЛЛЯТОРЫ-КАРДИОВЕРТЕРЫ: ЗНАЧЕНИЕ И ПЕРСПЕКТИВЫ ШИРОКОГО ПРИМЕНЕНИЯ
Своевременная дефибрилляция (разряд, электрошок) — это дефибрилляция, осуществленная в течение первых 5 мин от начала кардиальной катастрофы. Каждая минута задержки снижает шанс на выживание на 10–15%. После 7–10 мин с момента появления фибрилляции вернуть пациента к жизни становится практически невозможным (рис. 6.2).
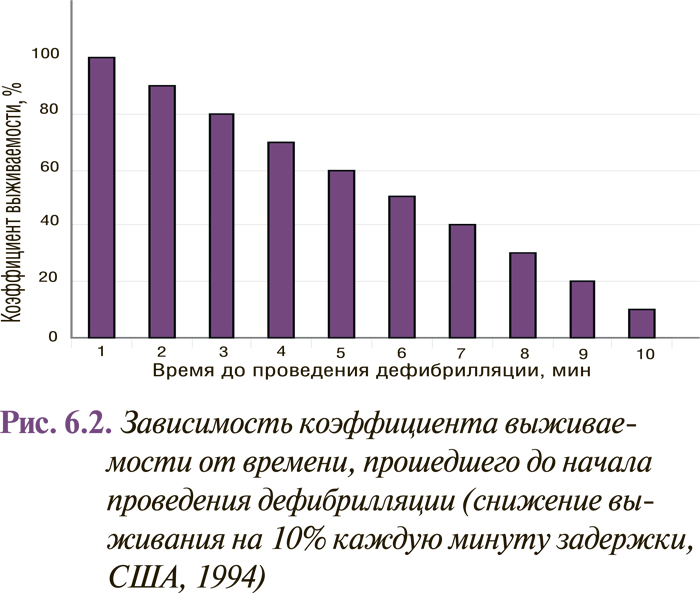
Согласно морфологическим данным при внезапной сердечной смерти в сердце отсутствуют несовместимые с жизнью морфологические нарушения. Поэтому своевременное проведение реанимационных мероприятий, в первую очередь дефибрилляции (на протяжении первых 5 мин), может способствовать возвращению к жизни.
Учитывая подтвержденный практический опыт США и стран Европы, проведение своевременной дефибрилляции за пределами лечебного учреждения можно обеспечить только при наличии в общественных местах (аэропорты, вокзалы, школы, высшие учебные заведения, аудитории, предприятия, государственные учреждения и т.п.) автоматических внешних дефибрилляторов. Пользоваться этими приборами может любой человек, прошедший короткий курс обучения (продолжительность 2 ч), даже ребенок.
ВНЕДРЕНИЕ АВТОМАТИЧЕСКИХ ВНЕШНИХ ДЕФИБРИЛЛЯТОРОВ В СТРАНАХ ЕВРОПЫ И США
АНА с 2001 г. рекомендует обязательное размещение автоматических внешних дефибрилляторов в публичных общественных местах, учреждениях, офисах, предприятиях. Европейский союз кардиологов и Европейский совет реаниматологов в 2002 г. совместно подтвердили основную роль автоматического внешнего дефибриллятора в решении проблемы внезапной сердечной смерти. В странах Европы разработаны и реализуются программы внедрения автоматических внешних дефибрилляторов, обучение дефибрилляции и приемам сердечно-легочной реанимации немедицинского персонала — людей, не имеющих медицинского образования, которые могут оказаться возле потенциальной жертвы внезапной остановки сердца. Правительствами стран Европы и Америки провозглашено решение проблемы внезапной сердечной смерти стратегически важной задачей 2002–2005 гг. Подтверждением этому является разработка и законодательное утверждение правительствами ряда стран Европы и США рекомендаций относительно оснащения автоматическими внешними дефибрилляторами различных учереждений и общественных мест. В мае 2004 г. Федеральные агентства органов самоуправления (США) приказали установить на всех внутренних авиалиниях автоматические внешние дефибрилляторы. С декабря 2004 г. ни один международный самолет любой страны без дефибриллятора на борту не имеет права приземлиться на территории США. Согласно Рекомендациям АНА (American Heart Association) 40% патрульных полицейских машин в США оснащено автоматическими внешними дефибрилляторами. Каждый автомобиль скорой помощи, парамедиков, спасателей оснащенные автоматическими внешними дефибрилляторами. С 2002 г. автоматические внешние дефибрилляторы обязательно устанавливаются в каждой государственной школе штата Нью-Йорк. В США более 50% государственных учреждений оснащены автоматическими внешними дефибрилляторами.
Правительство Англии выступило с инициативой реализации программы установления автоматических внешних дефибрилляторов в общественных местах и обучение персонала их эффективному использованию. Оборудование запланировано установить в залах торговых центров, железнодорожных и автовокзалов, аэропортов, отелей, концертных залах, школах. По мнению британских экспертов, инициатива правительства позволит сохранить тысячи жизней в течение ближайших 10 лет. В Венгрии все частные врачи имеют автоматические внешние дефибрилляторы. Принят закон относительно оснащения автоматическими внешними дефибрилляторами каждого здания всех лечебных учреждений. В Германии все большие предприятия оснащены автоматическими внешними дефибрилляторами.
Статистические данные выживаемости пациентов с внезапной кардиальной смертью за пределами медицинских учреждений*.
В учреждениях и публичных местах без оснащения автоматических внешних дефибрилляторов — 5%.
В учреждениях, оснащенных автоматическими внешними дефибрилляторами: местах для отдыха (концертные залы, казино, рестораны и др.) — 74%, на борту самолетов и в аэропортах — 40–60%, на рабочих местах (в офисах, министерствах, ведомствах и др.) — 52%.
Согласно табл. 6.32 среднее время прибытия скорой помощи в такой экономически развитой стране, как США, 8–12 мин. Таким образом, только наличие автоматических внешних дефибрилляторов может спасти от внезапной сердечной смерти.
*По данным информации компании «Cardiac Science» (США).
Таблица 6.32
Время реакции и процент выживаемости
| Вид первой помощи | Время до первого разряда, мин | Доля выживаемости, % |
| Традиционная скорая помощь | 10 | <10 |
| Пожарные службы | 6 | 40 |
| Полиция | 5 | 50 |
| Дефибрилляция на месте | 3 | >70 |
Американские эксперты считают реальным спасение 15 тыс. жизней в год из 20 млн населения страны при достаточном оснащении автоматическими внешними дефибрилляторами публичных общественных мест и немедицинских учреждений, а также при широком оснащении и дооснащении медицинских учреждений.
Таким образом, в Украине ориентировочный прогноз спасения жизней при возникновении внезапной сердечной смерти в общественных местах может составлять около 30–50 тыс. человек в год, при достаточном оснащении автоматическими внешними дефибрилляторами общественных мест, учреждений и медицинских учреждений.
Современные автоматические внешние дефибрилляторы
Соединение детального изучения патогенетических механизмов внезапной сердечной смерти и возможностей современных медицинских технологий позволяет принципиально решать проблему внезапной сердечной смерти.
Современные передовые возможности дефибрилляции в виде автоматических внешних дефибрилляторов 3-го поколения (типы «FirstSave AED G3», «PowerHeart AED G3» и «PowerHeart AED G3 pro», «PowerHeart CRM»), которые проверены в клинических и практических условиях США и странах Европы, зарегистрированы в Украине.
Современные возможности автоматических внешних дефибрилляторов:
- 98% — эффективность первого разряда (осуществленного в первые минуты кардиальной катастрофы);
- портативность, защита от ударов, падений, вибрации — неограниченные возможности использования дефибрилляторов в любых экстремальных ситуациях;
- постоянная готовность к использованию — отсутствие необходимости постоянной подзарядки прибора, система и индикация автоматического ежедневного самоконтроля;
- бифазная форма разряда обеспечивает наиболее эффективную и наименее травматическую дефибрилляцию;
- автоматический выбор мощности разряда в зависимости от импеданса тканей пациента, его массы и роста, то есть выбирается максимально эффективный и наиболее безопасный разряд, наиболее эффективно влияющий на сердце;
- простота и комфортность использования — управление прибором осуществляется с помощью одной кнопки;
- голосовые подсказки действий для персонала — минимизация ошибок и оптимизация осуществления успешной дефибрилляции;
- интегрированные электроды — электроды на клеевой основе, с низким уровнем переходного сопротивления позволяют осуществлять индивидуально эффективную свободную дефибрилляцию (руки персонала освобождаются для осуществления других дополнительных манипуляций, необходимых для проведения успешной реанимации);
- электроды неполяризованные — не нужно терять время на решение вопроса: «куда накладывать электроды?». Прибор самостоятельно устанавливает расположение и поляризацию электродов;
- возможность визуализации, архивации, протоколирования всех событий дефибрилляции в цифровом формате на компьютере;
- возможность проведения прибором полной автоматической самостоятельной дефибрилляции (при ее необходимости) без участия персонала;
- безопасность использования, так как осуществить несанкционированный разряд невозможно, поскольку при наличии нормального ритма сердца дефибриллятор не активирует (блокирует) кнопку разряда.
Лица, которые наиболее вероятно могут оказаться рядом с потенциальной жертвой внезапной сердечной смерти, — родственники, милиционеры, служба охраны, работники ГАИ, водители, работники супермаркетов, школ, офисов, банков, отелей, пожарные, бортпроводники, официанты, другие специалисты. Они должны быть обучены использованию автоматических внешних дефибрилляторов. Существуют разработанные методики обучения по использованию: тренировочные дефибрилляторы, муляжи, дистанционные имитаторы моделирования сердечного ритма, видеоматериалы, инструкции и др.
Рекомендованные направления применения внешних дефибрилляторов
- Амбулатории семейных врачей, фельдшерско-акушерские пункты, приемные отделения, травмпункты, рентгенологические кабинеты, операционные и другие медицинские учреждения и кареты скорой медицинской помощи (оптимально из расчета 1 дефибриллятор на каждый корпус и/ или этаж и каждую карету скорой медпомощи).
- Школы, высшие учебные заведения, другие учебные заведения (оптимально из расчета: 1 дефибриллятор на каждый этаж и/или на каждый корпус).
- Министерства и ведомства, офисы, банки и др. (оптимально из расчета: 1 дефибриллятор на 100 лиц).
- Стоматологические кабинеты и поликлиники государственного и частного секторов.
- Аэропорты, железнодорожные и автовокзалы, станции метрополитена (оптимально из расчета: расстояние между дефибрилляторами — не больше 100 м).
- Самолеты международных и внутренних авиарейсов.
- Поезда железнодорожного транспорта и метрополитена (каждый).
- Автобусы международного и междугородных направлений (каждый).
- Коммерческие, пассажирские и военные корабли и пароходы (каждый).
- Все учреждения отдыха, отели и др.
- Пожарно-спасательная служба (оптимально из расчета: 1–2 единицы на каждую выездную бригаду).
- Общественные и государственные учреждения, торговые центры (из расчета: 1 дефибриллятор на 1000 человеко/посещений в день).
- Объекты повышенной опасности (нефтеперерабатывающие предприятия, атомные электростанции, взрывоопасные предприятия, составы и прочие).
Оснащение автоматическими дефибрилляторами-кардиовертерами реанимационных, кардиореанимационных отделений и палат интенсивной терапии
Проблема внезапной сердечной смерти от фибрилляции желудочков в лечебных учреждениях является актуальной. По статистике выживаемость пациентов при возникновении фибрилляции желудочков во время нахождения пациентов в лечебных учреждениях США составляет только 10–15% при использовании обычных технологий внешней дефибрилляции и при достаточном оснащении медицинских учреждений.
Эту проблему можно решить с помощью внедрения в практику приборов ухода за пациентами, которые постоянно осуществляют мониторирование ЭКГ пациента и в случае необходимости (при возникновении фибрилляции желудочков или стойкой желудочковой тахикардии) самостоятельно автоматически выполняют дефибрилляцию без участия медицинского персонала на протяжении первых 30-40 с с момента возникновения фибрилляции.
Эффективность первого разряда дефибрилляции, выполненного на протяжении 1-й минуты фибрилляции, составляет 98%. Дефибриллятор-кардиовертер имеет функцию проведения 5 (серии) разрядов на протяжении 1 мин, если предыдущие разряды были неэффективными. Такая функция прибора значительно повышает эффективность дефибрилляции на протяжении 1-й минуты внезапной сердечной смерти.
В дефибрилляторе-кардиовертере объединены 3 важные функции:
- Функция дефибриллятора-монитора.
- Функция внешнего водителя ритма.
- Функция автоматического внешнего дефибриллятора.
Наличие функции автоматического кардиовертера в дефибрилляторе-кардиовертере позволяет автоматически провести дефибрилляцию без участия медицинского персонала на протяжении 30–40 с после возникновения у пациента фибрилляции желудочков.
Проведенные исследования позволили установить, что в условиях стационара средний временной промежуток до момента проведения первого разряда дефибрилляции медицинским персоналом обычным дефибриллятором-монитором составляет 3–4 мин. Необходимо учитывать, что первый разряд, выполненный в такой срок, уже является эффективным только на 50–60%. Поэтому для успешной дефибрилляции в таком случае необходимо проведение дополнительных 3–5 разрядов. При таком продолжительном процессе реанимации возникает необходимость проведения интубации пациента, внешнего массажа сердца, искусственной вентиляции легких. Такой длительный период реанимации часто приводит к появлению у пациента неврологических осложнений (вплоть до развития декортикации). Таким образом, проведение дефибрилляции в первые (1–2) минуты фибрилляции значительно повышает шансы на выживание пациента.
Опыт использования автоматических дефибрилляторов-кардиовертеров в клиниках США и Европы свидетельствует, что достаточное оснащение лечебных учреждений дефибрилляторами-кардиовертерами позволяет значительно снизить смертность от фибрилляции желудочков в медицинских учреждениях. Так, использование таких дефибрилляторов-кардиовертеров в медицинском центре Маймонидес в г. Нью-Йорк привело к существенному повышению выживаемости пациентов с фибрилляцией желудочков и стойкой желудочковой тахикардией (с 15 до 90%).
Нуждается в разработке программа широкого проведения обучения пользованию автоматическими внешними дефибрилляторами лиц, которые могут оказаться возле больного с эпизодом внезапной сердечной смерти — родственники, милиция, пожарные, служба охраны, работники ГАИ, водители, работники супермаркетов, вокзалов, школ, офисов, банков, отелей, бортпроводники, официанты, другие специалисты. Необходимо рекомендовать постепенное и реальное, исходя из экономических возможностей, оснащение автоматическими дефибрилляторами общественных мест и дефибрилляторами-кардиовертерами стационаров.
ЗАКЛЮЧЕНИЕ
На протяжении последних лет впервые на основании изучения патогенетических механизмов внезапной сердечной смерти благодаря установлению наиболее информативных критериев риска и развития современных медицинских технологий зародилось новое направление современной кардиологии — первичная профилактика внезапной сердечной смерти. Частота возникновения внезапной сердечной смерти стала одной из первичных конечных точек наибольших исследований по лечению кардиологических заболеваний, в частности ИМ и СН. Отмечен значительный прогресс в установлении механизмов формирования внезапной сердечной смерти у лиц без очевидных признаков нарушений структурно-функционального состояния миокарда. На протяжении последнего десятилетия проведено большое количество контролируемых исследований, позволивших установить место антиаритмических препаратов, устройств, в которых доказано, в частности, преимущество блокаторов β-адренорецепторов, амиодарона и автоматических внутренних искусственных кардиовертеров-дефибрилляторов в первичной и вторичной профилактике внезапной сердечной смерти у пациентов с кардиологическими заболеваниями, прежде всего с ИМ и СН. Была значительно усовершенствована стратегия лечения желудочковых аритмий на основании тщательной индивидуализированной оценки клинико-гемодинамического и прогностического значения нарушений ритма, сравнения потенциальной пользы лечения и вероятного риска кардиальных и экстракардиальных побочных эффектов, данных относительно способности антиаритмических препаратов улучшать долговременный прогноз выживаемости больных и вызывать опасное аритмогенное действие.
Однако, несмотря на эти выдающиеся достижения экспериментальной и клинической медицины, реальный уровень познания проблемы оставляет целый ряд нерешенных вопросов. Возможности оценки риска и профилактики внезапной сердечной смерти у пациентов со структурными сердечными заболеваниями и при первичных электрических заболеваниях сердца отличаются, в значительной мере зависят от уровня общественного развития и медицинских технологий, существующих в разных странах. Эти рекомендации являются документом, согласованным ведущими исследователями нашего государства, известными специалистами в области кардиологии и организаторами здравоохранения. Они предназначены для использования практикующими врачами и как пособие в учебном процессе в высших медицинских учебных заведениях.
1Потери меньше 10% на протяжении 2 ч.
2Использование пустого стеклянного флакона для приготовления раствора амиодарона не рекомендуется, поскольку несовместимость с буфером, который находился во флаконе, может вызвать преципитацию.
ЛИТЕРАТУРА
- Abella B.S., Alvarado J.P., Myklebust H. et al. (2005) Quality of cardiopulmonary resuscitation during in-hospital cardiac arrest. JAMA; 293, 305-310.
- Abella B.S., Sandbo N., Vassilatos P. et al. (2005) Chest compression rates during cardiopulmonary resuscitation are suboptimal: a prospective study during in-hospital cardiac arrest. Circulation; 111, 428-434.
- Aguiar C., Ferreira J., Seabra-Gomes R. (2002) Prognostic value of continuous ST-segment monitoring in patients with non-ST-segment elevation acute coronary syndromes. Ann. Noninvasive Electrocardiol., 7 (1): 29-39.
- American Heart Association (2004) Heart Disease and Stroke Statistics-2005 Update. Dallas, Tex: American Heart Association.
- American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care (2005) Circulation; 112, IV-1-IV-203.
- Cappato R. (1999) Secondary prevention of sudden death: the Dutch study, the antiarrhythmics versus implantable defibrillator trial, the cardiac arrest study Hamburg and the Canadian implantable defibrillator study (review). Am. J. Cardiol., Mar 11, 83 (5B): 68D-73D.
- Chevalier P., Kirkorian G., Touboul P. (2002) Arrhythmic sudden cardiac death due to coronary artery spasm. Card. Electrophysiol. Rev., 6 (1-2): 104-106.
- Chiang W.C., Chen W.J., Chen S.Y. et al. (2005) Better adherence to the guidelines during cardiopulmonary resuscitation through the provision of audioprompts. Resuscitation; 64, 297-301.
- Cohen M., Stinett S.S., Weatherley B.D. et al. (2000) Predictors of recurrent ischemic events and death in unstable coronary artery disease after treatment with combination antithrombotic therapy. Am. Heart J.,139: 962-970.
- de Vries W., van Alem A.P, de Vos R. et al. (2005) Trained first-responders with an automated external defibrillator: how do they perform in real resuscitation attempt? Resuscitation; 64, 157-161.
- Elliott P.M., Poloniecki J., Dickie S. et al. (2000) Sudden death in hypertrophic cardiomyopathy: identification of high risk patients. J. Am. Coll. Cardiol., 36: 2212-2218.
- Florenciano-Sanchez R., Castillo-Moreno J.A., Molina-Laborda E. et al. (2001) The exercise test that indicates a low risk of events. Differences in prognostic significance between patients with chronic stable angina and patients with unstable angina. J. Am. Coll. Cardiol., 38(7): 1974-1979.
- Goldstein M.R. (2001) Sudden death due to cardiac arrhythmias. N. Engl. J. Med., 15:1473-1482.
- Hajbaghery M.A., Mousavi G., Akbari H. (2005) Factors influencing survival after inhospital cardiopulmonary resuscitation.Resuscitation; 66, 317-321.
- Hazinski M.F., Idris A.H., Kerber R.E. et al. (2005) Lay rescuer automated external defibrillator («public access defibrillation») programs: lessons learned from an international multicenter trial: advisory statement from the American Heart Association Emergency Cardiovascular Committee; the Council on Cardiopulmonary, Perioperative, and Critical Care; and the Council on Clinical Cardiology. Circulation; 111, 3336-3340.
- Herlitz J., Aune S., Beng A. et al. (2005) Very high survival among patients defibrillated at an early stage after in-hospital ventricular fibrillation on wards with and without monitoring facilities. Resuscitation; 66, 159-166.
- Hohnloser S.H., Klingenheben T., Zabel M. (1999) Identification of patients after myocardial infarction at risk of life-threatening arrhythmias. Eur. Heart J.,1 (Supplement C): C11-C20.
- Huikuri H.V., Castellanos A., Myerburg R.J. (2001) Sudden death due to cardiac arrhythmias. N. Engl. J. Med., 15, № 345 (20): 1473-1482.
- Jouven X., Desnos M., Guerot C. et al. (1999) Predicting Sudden Death in the Population. The Paris Prospective Study I. Circulation, 99: 1978-1983.
- Lanza G.A., Guido V., Galeazzi M.M. et al. (1998) Prognostic role of heart rate variability in patients with a recent acute myocardial infarction. Am. J. Cardiol., 82: 1323-1328.
- Lombardi F. (2001) Arrhythmia risk stratification in patients with heart failure: prognostic evaluation of arrhythmia risk. Ital. Heart J., 2 (12 Suppl): 1284-1290.
- Mark Estes N.A. 3rd, Homoud M.K., Link M.S. et al. (2002) Assessment of risk for sudden cardiac death. Curr. Probl. Cardiol., Jun, 27 (6): 246-266.
- Moncrieff J., McGavigan A.D., Dunn (2002) Arrhythmias, sudden death and syncope in hypertensive cardiovascular disease. FG. Card Electrophysiol Rev., 6 (1-2): 36-41.
- Monsieurs K.G., Vogels C., Bossaert L.L. et al. (2005) A study comparing the usability of fully automated automatic versus semi-automatic defibrillation by untrained nursing students.Resuscitation; 64, 41—47.
- Priori S.G., Aliot E., Blomstrom-Lundqvist C. et al. (2001) Task force on sudden cardiac death of the European Society of cardiology. Eur. Heart J., 22: 1374-1450.
- Rea T.D., Shah S., Kudenchuk P.J. et al. (2005) Automated external defibrillators: to what extent does the algorithm delay CPR? Ann Emerg Med; 46, 132-141.
- Runquist L, Hendrix G. (2001) Survival and prognosis following sudden cardiac death. J S C Med. Assoc., 97(10): 439-441.
- Sabatine M.S., McCabe C.H., Morrow D.A. et al. (2002) Identification of patients at high risk for death and cardiac ischemic events after hospital discharge. Am. Heart J., 143 (6): 966-970.
- Saeed M., Homoud M.K., Wang P.J. (2001) Role of invasive electrophysiologic testing in risk stratification for sudden cardiac death. J. Invasive Cardiol., 11: 758-762.
- Snyder D., Morgan C. (2004) Wide variation in cardiopulmonary resuscitation interruption intervals among commercially available automated external defibrillators may affect survival despite high defibrillation efficacy. Crit Care Med; 32, S 421-424.
- Spirito P., Bellone P., Harris K.M. et al. (2000) Magnitude of left ventricular hypertrophy and risk of sudden death in hypertrophic cardiomyopathy. N. Engl. J. Med., 342: 1778-1785.
- Whitfield R., Colquhoun M., Chamberlain D. et al. (2005) The Department of Health National Defibrillator Programme: analysis of downloads from 250 deployments of public access defibrillators. Resuscitation; 64, 269-277.
- Wik L., Kramer-Johansen J., Myklebust H. et al. (2005) Quality of cardiopulmonary resuscitation during out-of-hospital cardiac arrest. JAMA; 293, 299-304.
- Wong S.H., Mulvihill N.T., Norton M. (2001) Assessing the risk of sudden cardiac death. Heart, 86 (6): 624-625.
- Zareba W.J. (2001) New electrocardiographic indices of risk stratification. Electrocardiol., 34 (4): 332-339.
- Zheng Z.J., Croft J.B., Giles W.H. et al. (2001) Sudden cardiac death in the United States, 1989 to 1998. Circulation, 30; 104 (18): 2158-2163.