Приобретенные пороки сердца представляют собой возникшие вследствие различных причин структурные аномалии и деформации клапанов сердца и субклапанного аппарата, нарушающие внутрисердечную и системную гемодинамику, предрасполагающие к развитию острой или хронической недостаточности кровообращения.
Этиология
Порок сердца возникает вследствие различных патологических процессов. Ревматизм является основным этиологическим фактором митрального стеноза (85%), значительно реже поражает аортальный клапан (26%), может быть причиной различных комбинаций стеноза и недостаточности аортального или митрального клапанов сердца. Изолированная митральная недостаточность, аортальный стеноз и аортальная недостаточность часто бывают неревматического происхождения и вызываются дегенеративными изменениями. К развитию приобретенных пороков сердца могут также приводить инфекционный эндокардит, атеросклероз, сепсис, сифилис, травмы, в незначительной доле случаев — системная красная волчанка (эндокардит Либмана — Сакса), системная склеродермия, ревматоидный артрит с висцеральными поражениями.
Классификация
Данная классификация приобретенных пороков сердца принята на VI Конгрессе кардиологов Украины (Киев, 2000). После нозологических единиц приведена их рубрика по МКБ-10.
Митральный стеноз:
- Ревматический I05.0
- Неревматический I34.2 (с уточнением этиологии)
Митральная недостаточность:
- Ревматическая I05.1
- Неревматическая I34.0 (с уточнением этиологии)
Комбинированный ревматический митральный порок (ревматический митральный стеноз с недостаточностью I05.2):
- С преобладанием стеноза
- С преобладанием недостаточности
- Без явного преобладания
Пролапс митрального клапана I34.1
Аортальный стеноз:
- Ревматический I06.0
- Неревматический I35.0 (с уточнением этиологии)
Аортальная недостаточность:
- Ревматическая I06.1
- Неревматическая I35.1 (с уточнением этиологии)
Комбинированный аортальный порок:
- Ревматический аортальный стеноз с недостаточностью I06.2
- Неревматический аортальный (клапанный) стеноз с недостаточностью I35.2 (с уточнением этиологии)
- С преобладанием стеноза
- С преобладанием недостаточности
- Без явного преобладания
Трикуспидальный стеноз:
- Ревматический I07.0
- Неревматический I36.0 (с уточнением этиологии)
Трикуспидальная недостаточность:
- Ревматическая I07.1
- Неревматическая I36.1 (с уточнением этиологии)
Комбинированный трикуспидальный порок:
- Ревматический трикуспидальный стеноз с недостаточностью I07.2
- Неревматический трикуспидальный стеноз с недостаточностью I36.2 (с уточнением этиологии)
Клапанный стеноз ЛА I37.0
Недостаточность клапана ЛА I37.1
Комбинированный порок клапана ЛА (стеноз ЛА с недостаточностью клапана I37.2)
Сочетанные пороки сердца:
- Митрально-аортальный I08.0
- Митрально-трикуспидальный I08.1
- Аортально-трикуспидальный I08.2
- Сочетанное поражение митрального, аортального и трехстворчатого клапанов I08.3
Порок сердца считают «комбинированным» при наличии стеноза и недостаточности одного клапана и «сочетанным» при поражении нескольких клапанов. При наличии нескольких пороков их перечисляют, первым указывая порок, выраженность которого больше.
Степени кальциноза клапанов:
I + Отдельные глыбки кальция в толще комиссур или створок
II ++ Значительное обызвествление створок и комиссур без вовлечения клапанного кольца
III +++ Массивный кальциноз клапана с переходом на фиброзное кольцо, а иногда на стенку аорты и миокард желудочков
В диагнозе также необходимо указывать этиологию порока (ревматизм, инфекционный эндокардит, дегенеративные изменения), стадию СН.
Для больных, перенесших операцию на клапанах сердца, следует обозначить имевшийся ранее порок, указать дату оперативного лечения, характер осложнений.
ЭхоКГ является стандартным методом диагностики для оценки структуры и функции клапана. Согласно приказу МЗ Украины № 436 в перечень услуг обязательного ассортимента входит оперативное лечение порока сердца, круглогодичная пенициллинопрофилактика при ревматической этиологии и лечение СН в зависимости от типа (систолическая или диастолическая).
МИТРАЛЬНЫЙ СТЕНОЗ
Этиология
Митральный стеноз — наиболее частый ревматический порок сердца, возникает вследствие длительно протекающего ревматического эндокардита. Порок обычно формируется в молодом возрасте и чаще (80%) у женщин. Редко сужение митрального отверстия может возникать при карциноидном синдроме, системной красной волчанке, ревматоидном артрите, в 13% случаев причиной являются дегенеративные изменения клапана.
Классификация
По степени тяжести выделяют незначительный митральный стеноз (максимальный градиент давления 7–11 мм рт. ст., площадь отверстия >2 см2), умеренный (максимальный градиент давления 12–20 мм рт. ст., площадь отверстия 2–1 см2), значительный (максимальный градиент давления >20 мм рт. ст., площадь отверстия <1 см2).
Патологическая анатомия
В основе порока лежат кальцинация и утолщение створок клапана, в патологический процесс также вовлечены фиброзное кольцо, хорды и сосочковые мышцы. Сужение отверстия возникает вначале вследствие склеивания соприкасающихся краев створок с образованием комиссур, в дальнейшем распространяется к середине отверстия, постепенно его суживая. Параллельно происходят фиброзные изменения структур клапанного аппарата, склерозируется и теряет свою эластичность фиброзное кольцо. При длительном существовании порока происходит обызвествление клапана.
Патологическая физиология
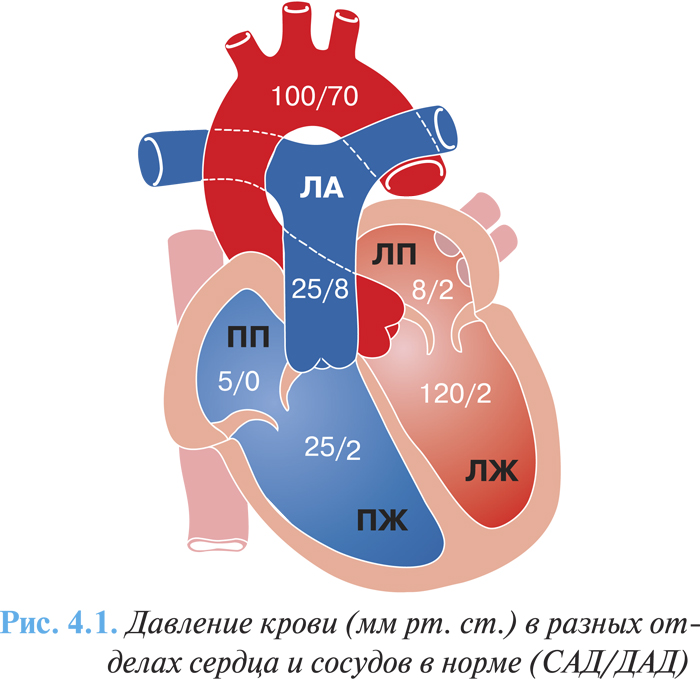
«Критическая площадь», при которой начинаются заметные гемодинамические расстройства, составляет 1–1,5 см2. Сопротивление кровотоку, создаваемое суженным митральным отверстием («первый барьер»), приводит в действие компенсаторные механизмы, обеспечивающие достаточную производительность сердца. Из-за повышения градиента давления между левым предсердием и ЛЖ компенсаторно возрастает давление в левом предсердии (рис. 4.1), миокард предсердия гипертрофируется, полость его расширяется. При давлении в левом предсердии выше определенного уровня возникает рефлекторное сужение мелких ЛА на прекапиллярном уровне («второй барьер») — рефлекс Китаева, что предохраняет капиллярную сеть легких от переполнения кровью. Высокое давление в ЛА (до 80 мм рт. ст. и выше) приводит к компенсаторной гипертрофии, а затем и дилатации ПЖ, в нем повышается диастолическое давление, возникает правожелудочковая недостаточность и относительная недостаточность трехстворчатого клапана.
Клиническая картина
Зависит от стадии заболевания, состояния компенсации кровообращения. Порок обычно клинически в покое не проявляется, если площадь митрального отверстия превышает 1,5 см2. При компенсаторной гиперфункции левого предсердия больные обычно жалоб не предъявляют, могут выполнять значительную физическую нагрузку.
При повышении давления в малом круге кровообращения появляются жалобы на одышку и ощущение сердцебиения при физической нагрузке. При резком повышении давления в капиллярах развиваются приступы сердечной астмы, возникает сухой или с отделением небольшого количества слизистой мокроты кашель, часто с примесью крови (кровохарканье). При высокой легочной гипертензии у больных отмечают слабость, повышенную утомляемость.
При выраженном стенозе и нарастании симптомов легочной гипертензии наблюдается типичное facies mitralis: «митральный» румянец на щеках на фоне бледной кожи лица, цианоз губ, кончика носа, ушных раковин.
При осмотре область сердца в нижней части грудины часто выбухает и пульсирует вследствие образования «сердечного горба», обусловленного усиленными ударами ПЖ о переднюю грудную стенку. В области верхушки сердца или несколько латеральнее определяется диастолическое дрожание — «кошачье мурлыканье».
Аускультативно митральный стеноз диагностируют на основании характерной мелодии тонов сердца (ритм перепела) — усиленный (хлопающий) I тон на верхушке сердца и тон (щелчок) открытия митрального клапана, появляющийся через 0,08–0,11 с после II тона. Характерным является диастолический шум, который может возникать в различные периоды диастолы. Протодиастолический шум низкий, рокочущий (его пальпаторным эквивалентом является «кошачье мурлыканье»), различной продолжительности, интенсивность его постепенно снижается. Пресистолический шум обычно короткий, грубого, скребущего тембра, имеет нарастающий характер, заканчивается хлопающим I тоном.
Диагностика
На ЭКГ по мере прогрессирования порока появляются признаки перегрузки левого предсердия (P mitrale), гипертрофии ПЖ: увеличенная амплитуда зубцов комплекса QRS в сочетании с измененной конечной частью желудочкового комплекса (уплощение, инверсия зубца Т, снижение сегмента ST) в соответствующих отведениях. Часто регистрируют нарушения ритма сердца (фибрилляция, трепетание предсердий).
На рентгенограмме определяется увеличение левого предсердия и ПЖ, кальцификация митрального клапана, перераспределение легочного сосудистого кровотока к верхним отделам легких, расширение ЛА.
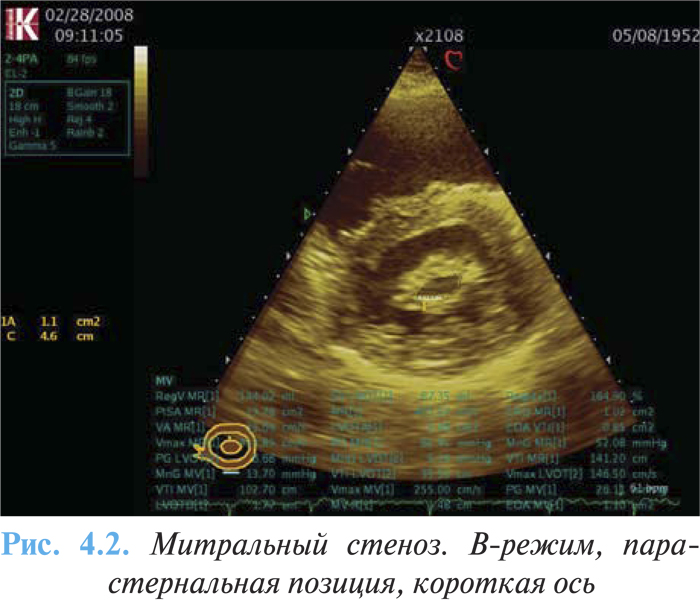
ЭхоКГ и допплерография являются основными методами оценки тяжести порока и морфологических изменений клапана (утолщение, фиброз, кальциноз (рис. 4.2), нарушение движения створок), функциональных параметров (градиент давления, давление в ЛА, наличие и тяжесть сопутствующей митральной регургитации, функция ПЖ и ЛЖ), размера левого предсердия, а также расчета площади митрального отверстия. При эхоКГ в М-режиме отмечают однонаправленное (П-образное) движение передней и задней створок митрального клапана вперед (рис. 4.3), снижение скорости раннего диастолического прикрытия передней створки митрального клапана (до 1 см/с), уменьшение амплитуды открытия створки митрального клапана, увеличение полости левого предсердия (переднезадний размер может увеличиваться до 70 мм);

Трансэзофагеальную эхоКГ проводят для исключения тромбоза левого предсердия перед проведением комиссуротомии или после эпизода эмболии.
У больных с умеренным или тяжелым митральным стенозом можно проводить стресс-эхоКГ, которая позволяет объективно оценить функциональную способность сердца и величину трансмитрального градиента в покое и при нагрузке и зачастую выявить легочную гипертензию при нагрузке. Значения среднего трансмитрального градиента при нагрузке 20 мм рт. ст. и более и максимального систолического давления в ПЖ 60 мм рт. ст. и более свидетельствуют о наличии гемодинамически значимого митрального стеноза. У больных, которые не могут выполнять пробы с физической нагрузкой, проводят эхоКГ-исследование с добутамином. Средний трансмитральный градиент свыше 18 мм рт. ст. на пике инфузии добутамина позволяет выявить пациентов с риском развития сердечно-сосудистых осложнений.
Катетеризация полостей сердца играет в диагностике вспомогательную роль и проводится в том случае, когда клинические данные противоречат результатам эхоКГ. Полное гемодинамическое и ангиографическое исследование при митральном стенозе включает катетеризацию правых и левых отделов сердца для определения давления во всех четырех его камерах; особенно важно измерение диастолического градиента на митральном клапане. Коронарную ангиографию проводят у пациентов старшего возраста при наличии факторов риска развития ИБС.
Течение
Течение процесса определяется степенью выраженности стеноза, наличием легочной гипертензии и состоянием сократительной способности миокарда ПЖ. Митральный стеноз у большинства пациентов неуклонно прогрессирует, скорость уменьшения площади митрального отверстия составляет 0,09–0,32 см2/год. После появления симптомов СН при проведении медикаментозного лечения по прошествии 5 лет умирают 50% больных.
Выделяют 5 стадий митрального стеноза.
I стадия — полной компенсации. Гемодинамические нарушения обусловлены незначительным сужением митрального отверстия (площадь его составляет 2–2,5 см2), давление в левом предсердии повышено до 10–15 мм рт. ст. Клинические проявления минимальны: жалобы отсутствуют, трудоспособность не ограничена.
На ЭКГ — признаки перегрузки левого предсердия (Р mitrale), рентгенологически определяется незначительное увеличение левого предсердия и диаметра ЛА.
Хирургическое лечение не показано.
II стадия — легочного застоя. Характеризуется сужением митрального отверстия до 1,5–2 см2, давление в левом предсердии повышается до 2030 мм рт. ст. Клинические симптомы: одышка при физической нагрузке, признаки гипертензии в малом круге с нередким развитием осложнений, трудоспособность ограничена, правожелудочковой декомпенсации нет. Аускультативно определяются типичные признаки митрального стеноза, акцент II тона над ЛА. На ЭКГ — Р mitrale, признаки гипертрофии ПЖ. На эхоКГ — однонаправленное П-образное движение створок митрального клапана. При рентгенологическом исследовании — увеличение левого предсердия, ЛА, усиление легочного рисунка, застойные явления в легких. Нарушение кровообращения соответствует I стадии СН. Показания к оперативному лечению относительные.
III стадия — правожелудочковой недостаточности. Площадь митрального отверстия составляет 1–1,5 см2. Характеризуется стойкой гипертензией в малом круге кровообращения с образованием «второго барьера», усилением работы ПЖ и развитием его недостаточности. Склерозирование легочных сосудов, уменьшение легочного кровотока обусловливает урежение или исчезновение приступов сердечной астмы и отека легких. Дистрофические изменения в паренхиматозных органах выражены умеренно.
Клинические симптомы: выраженная одышка, бледность кожных покровов, цианоз, непереносимость физических нагрузок, признаки правожелудочковой декомпенсации, повышение венозного давления, увеличение печени, значительное расширение правых отделов сердца. На ЭКГ выражен митральный зубец Р, признаки гипертрофии ПЖ, может определяться фибрилляция предсердий. Рентгенологически — выраженное увеличение ЛА, левого предсердия, расширение ПЖ и правого предсердия.
Показания к операции абсолютные.
IV стадия — дистрофическая. Площадь митрального отверстия менее 1 см2. Характеризуется выраженным нарушением кровообращения в большом и малом круге. Повышается венозное давление, появляется застой крови в печени, сосудах нижних конечностей, отеки. При эхоКГ размеры сердца значительно увеличены за счет предсердий и ПЖ, определяется относительная недостаточность трехстворчатого клапана, выявляют кальциноз митрального клапана, тромбоз левого предсердия. Рентгенологически — дальнейшее увеличение сердечной тени, усиление легочного рисунка, корни легких расширены.
Медикаментозное лечение дает незначительный и кратковременный эффект.
Возможно проведение операции, но она ненадолго продлевает жизнь.
V стадия — терминальная. Клиника соответствует III стадии СН. Характеризуется тяжелыми нарушениями кровообращения с необратимыми дегенеративными изменениями внутренних органов (печени, почек) и асцитом, атрофией мышечной системы. На ЭКГ — глубокие дистрофические изменения миокарда, различные нарушения ритма сердца. Рентгенологически определяется кардиомегалия, высокое стояние диафрагмы, выраженный застой в легких, часто выпот в плевральной полости. Медикаментозное лечение неэффективно. Оперативное лечение не показано.
Лечение
Медикаментозная терапия направлена на лечение и предотвращение осложнений. Необходимо профилактическое назначение антибиотиков перед стоматологическими и другими вмешательствами для снижения риска развития инфекционного эндокардита. У пациентов молодого возраста с острой ревматической лихорадкой в анамнезе высок риск развития рецидива, поэтому профилактическую антибиотикотерапию им проводят постоянно до достижения взрослого возраста.
Применение диуретиков или органических нитратов пролонгированного действия позволяет временно уменьшать выраженность одышки. Блокаторы β-адренорецепторов или блокаторы кальциевых каналов, снижающие ЧСС, способны значительно повысить толерантность к физическим нагрузкам за счет удлинения диастолы и времени наполнения ЛЖ.
Показанием для назначения антикоагулянтов является фибрилляция предсердий, у пациентов с синусовым ритмом они показаны в случае больших размеров левого предсердия (>50 мм), наличия спонтанного эхо-контрастирования при проведении трансэзофагеальной эхоКГ, тромбоэмболий в анамнезе и наличии тромба в левом предсердии.
Перед проведением электрической кардиоверсии, если продолжительность фибрилляции предсердий составила >48 ч, необходимо применение антикоагулянтов в течение 3–4 нед до и 4 нед после кардиоверсии. Проведение кардиоверсии до операции не показано у больных с тяжелым митральным стенозом, поскольку она не восстанавливает синусовый ритм на длительный период.
Митральный стеноз наиболее успешно корригируется хирургическими методами (вальвулопластика или эндопротезирование клапана).
Митральная комиссуротомия проводится у больных с выраженным митральным стенозом при наличии симптомов, ограничивающих физическую активность и снижающих трудоспособность.
Чрескожная митральная комиссуротомия показана больным с площадью отверстия <1,5 см2:
- у пациентов с симптоматикой и оптимальными клиническими характеристиками;
- у пациентов с симптоматикой при наличии противопоказаний или высокого риска оперативного вмешательства;
- как начальное вмешательство у пациентов с симптоматикой при неблагоприятном анатомическом состоянии клапана, но с оптимальными клиническими характеристиками;
- у бессимптомных пациентов с оптимальными клиническими характеристиками и высоким риском развития тромбоэмболических осложнений или декомпенсации гемодинамики (тромбоэмболии в анамнезе, наличие спонтанного контрастирования в левом предсердии, недавно перенесенная или пароксизмальная фибрилляция предсердий, систолическое давление в ЛА в покое >50 мм рт. ст., необходимость в проведении внесердечного хирургического вмешательства, планирование беременности).
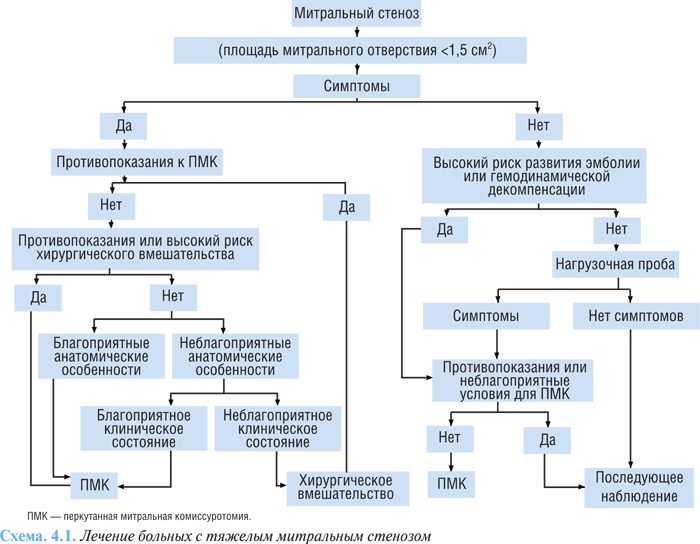
Алгоритм лечения больных с тяжелым митральным стенозом представлен на схеме 4.1.
Противоказаниями для чрескожной митральной комиссуротомии являются:
- площадь митрального отверстия >1,5 см2;
- тромб в левом предсердии;
- умеренная и тяжелая митральная регургитация;
- тяжелая или бикомиссуральная кальцификация;
- тяжелое сопутствующее поражение аортального клапана или тяжелый комбинированный стеноз и недостаточность трехстворчатого клапана;
- сопутствующая ИБС, требующая проведения АКШ.
Улучшение состояния больных после выполнения митральной комиссуротомии наступает в 70–89% случаев. Неэффективность вмешательства обычно обусловлена поздним направлением больных к хирургу, выраженными морфологическими изменениями сердца и других внутренних органов.
При наличии противопоказаний к проведению чрескожной митральной комиссуротомии единственным альтернативным методом лечения является полномастштабное хирургическое вмешательство.
МИТРАЛЬНАЯ НЕДОСТАТОЧНОСТЬ
Этиология
Снижение распространенности ревматической лихорадки и увеличение продолжительности жизни в индустриальных странах изменили причины возникновения этого порока, в связи с чем сегодня в Европе доминирует дегенеративная митральная недостаточность (61%) над ревматической (14%). Другими причинами возникновения порока являются инфекционный эндокардит, системные заболевания соединительной ткани (системная красная волчанка, системная склеродермия), ИБС.
Классификация
По степени тяжести митральную недостаточность разделяют на начальную (объем регургитации <30 мл за сокращение, фракция регургитации <30%, эффективная площадь отверстия регургитации <0,20 см2); умеренную (объем регургитации 30–59 мл за сокращение, фракция регургитации 30–49%, эффективная площадь отверстия регургитации 0,20–0,39 см2); тяжелую степень (объем регургитации ≥60 мл за сокращение, фракция регургитации ≥50%, эффективная площадь отверстия регургитации ≥0,40 см2).
Патологическая анатомия
В результате патологического процесса образуются краевые дефекты, скручивание краев створок клапана, створки не смыкаются в систолу ЛЖ. Укорочение и спаивание хорд приводят к ограничению подвижности створок (чаще задней). Для митральной недостаточности вследствие инфекционного эндокардита характерна краевая узурация створок клапана или центральная их перфорация. Часто выявляют отрыв хорд, на концах разрыва могут быть свежие или кальцинированные вегетации.
Патологическая физиология
Гемодинамические нарушения при митральной недостаточности обусловлены возвратом части крови из ЛЖ в левое предсердие, что вызывает перегрузку объемом левого предсердия и ЛЖ, которая зависит от объема регургитации. Порок длительное время компенсируется мощным ЛЖ, в дальнейшем развивается дилатация левого предсердия, и оно начинает функционировать как полость с низким сопротивлением. Со временем по не до конца установленным причинам ЛЖ прогрессивно расширяется, повышается диастолическое давление и снижается ФВ. Повышается давление заклинивания в легочных капиллярах и развивается легочная гипертензия и дисфункция ПЖ. С декомпенсацией последнего развивается относительная недостаточность трехстворчатого клапана и появляются признаки правосердечной недостаточности. Длительные нарушения кровообращения приводят к стойким изменениям в легких, печени, почках и других органах.
Клиническая картина
В фазе компенсации порок может быть выявлен случайно при медицинском осмотре. При снижении сократительной функции ЛЖ и повышении давления в малом круге кровообращения возникают одышка при физической нагрузке и сердцебиение. При нарастании застойных явлений в малом круге (капиллярах) и нарастании симптомов правожелудочковой недостаточности появляются отеки на ногах и боль в правом подреберье, могут возникать приступы сердечной астмы и одышка в покое.
Больных часто беспокоит ноющая, давящая, колющая боль в области сердца, не всегда связанная с физической нагрузкой.
При значительной регургитации слева от грудины наблюдается сердечный горб, определяется усиленный и разлитой верхушечный толчок, локализующийся в пятом межреберье кнаружи от среднеключичной линии.
Аускультативно определяется ослабление или полное отсутствие I тона сердца, часто над ЛА выслушивается расщепление II тона, на верхушке сердца определяется глухой III тон. Акцент II тона над ЛА обычно выражен умеренно и возникает при развитии застойных явлений в малом круге кровообращения.
Наиболее характерен систолический шум, который хорошо выслушивается на верхушке сердца, проводится в левую подмышечную область и вдоль левого края грудины, интенсивность его варьирует в широких пределах и обычно обусловлена выраженностью клапанного дефекта. Тембр шума различный — мягкий, дующий или грубый, что может сочетаться с пальпаторно ощутимым систолическим дрожанием на верхушке. Систолический шум может занимать часть систолы или всю систолу (пансистолический шум).
Диагностика
На ЭКГ при выраженной недостаточности митрального клапана отмечают признаки гипертрофии левого предсердия и ЛЖ в виде увеличенной амплитуды зубцов комплекса QRS, чаще в сочетании с измененной конечной частью желудочкового комплекса (уплощение, инверсия зубца Т, снижение сегмента ST) в соответствующих отведениях. При развитии легочной гипертензии появляются признаки гипертрофии ПЖ и правого предсердия. Фибрилляцию предсердий выявляют у 30–35% больных.
При рентгенологическом исследовании в переднезадней проекции сердце увеличено в размерах, больше влево, талия отсутствует за счет значительного увеличения левого предсердия, которое может достигать гигантских размеров и выступать за правый контур сердца в виде добавочной тени.
ЭхоКГ является принципиально важным исследованием и должна включать оценку механизмов возникновения порока, морфологию клапана и его функцию, тяжесть митральной регургитации, функцию ПЖ и ЛЖ. ЛЖ может быть нормальных размеров или дилатирован в зависимости от тяжести и длительности митральной регургитации, левое предсердие дилатировано, особенно значительно при наличии фибрилляции предсердий.
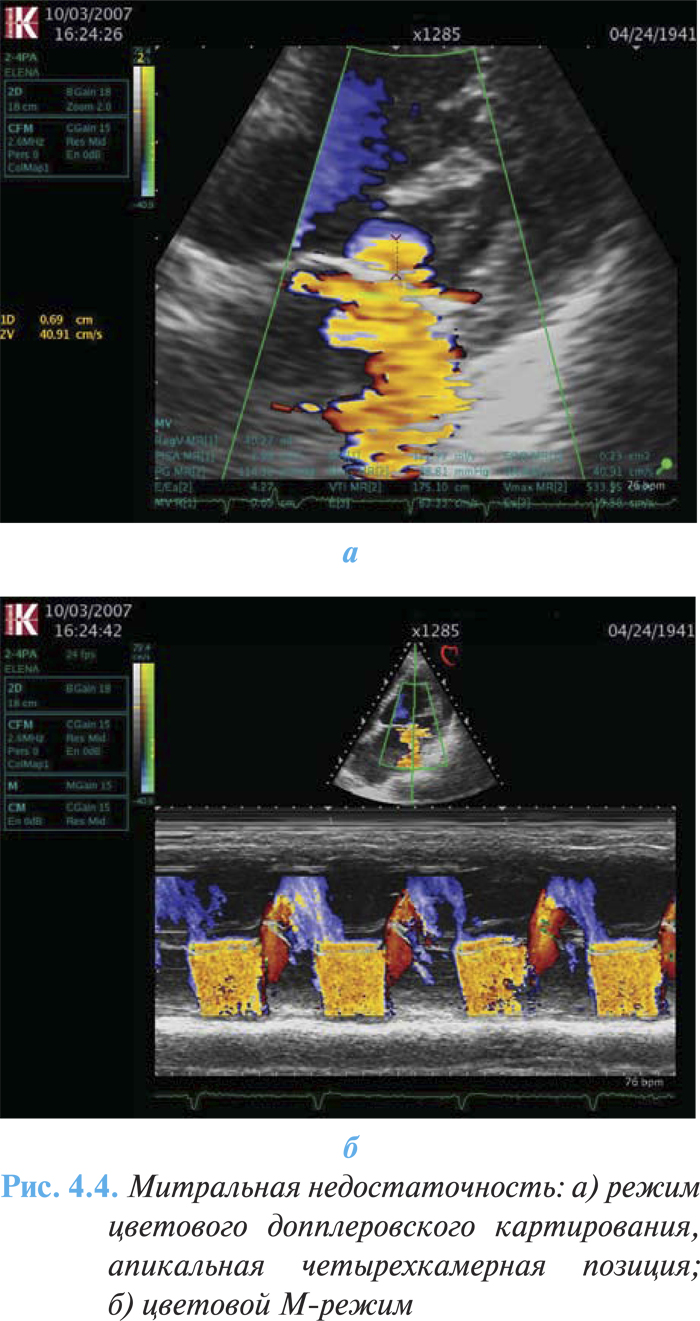
При допплеровской эхоКГ возможна оценка степени выраженности митральной регургитации. Прямой признак порока — турбулентный систолический поток крови в полости левого предсердия, коррелирующий с выраженностью регургитации (рис. 4.4а, б).
Тяжесть митральной регургитации оценивают полуколичественным методом, основанным на величине (длина, площадь) потока регургитации или количественным методом с расчетом объема и фракции регургитации и эффективной площади отверстия регургитации.
Разработаны эхоКГ-критерии тяжелой органической митральной недостаточности. К специфическим признакам относят следующие:
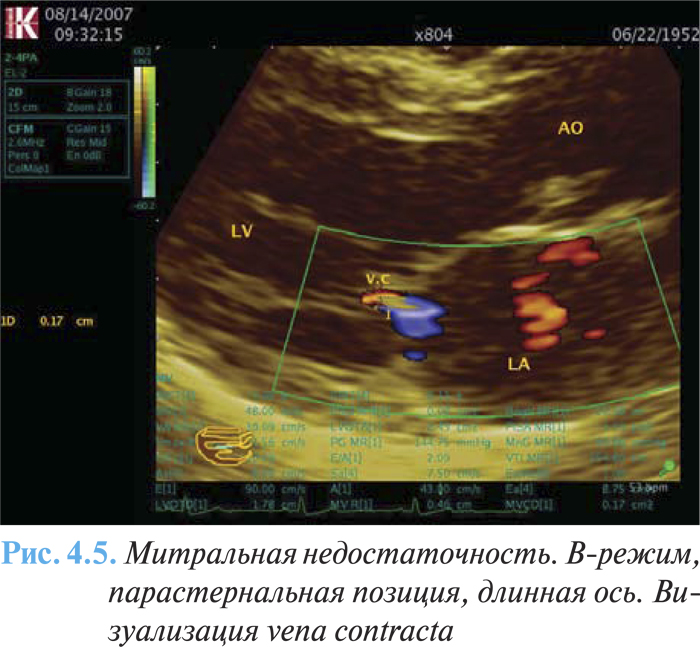
- размер vena contracta ≥0,7 см с большим центральным потоком митральной регургитации площадью >40% левого предсердия или пристеночным потоком любого размера, циркулирующим в левом предсердии (рис. 4.5);
- широкая конвергенция потока (радиус ≥0,9 см);
- систолический обратный ток в легочных венах;
- патологическая подвижность митрального клапана или разрыв папиллярной мышцы.
К дополнительным признакам тяжелой митральной недостаточности относят следующие:
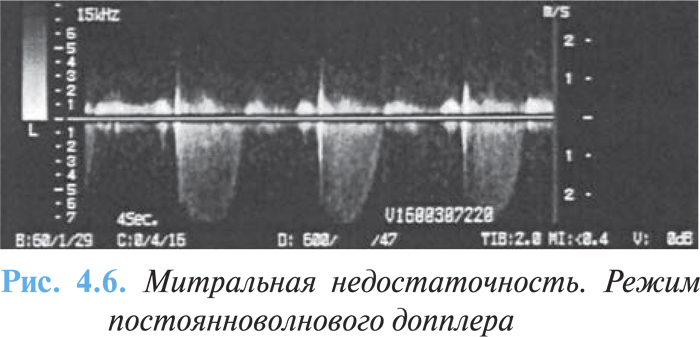
- интенсивный треугольный поток митральной недостаточности при постоянноволновой допплерографии (рис. 4.6);
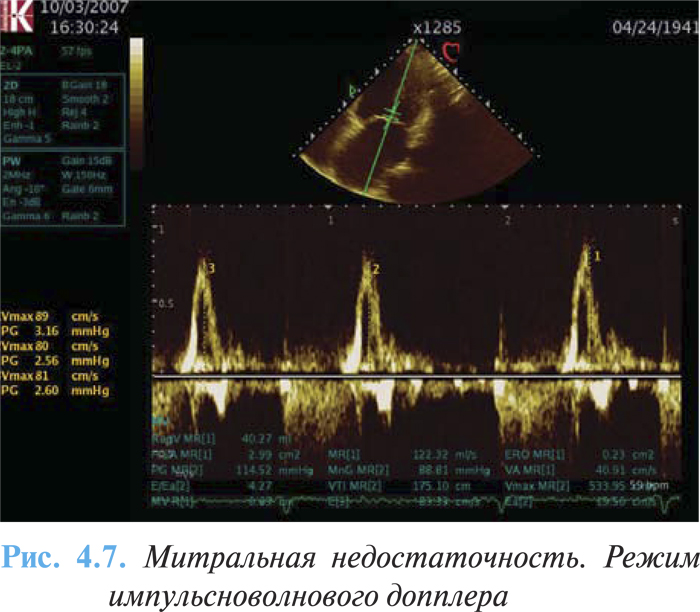
- превалирование пика Е трансмитрального потока (Е >1,2 м/с) (рис 4.7);
- увеличение размера левого предсердия и ЛЖ (особенно при нормальной функции последнего).
Количественные критерии тяжелой митральной недостаточности включают величину объема регургитации ≥60 мл за сокращение, фракцию регургитации ≥50%, эффективную площадь отверстия регургитации ≥0,40 см2.
Чреспищеводную эхоКГ проводят перед оперативным вмешательством для точного определения характера повреждения клапана, а также интраоперационной оценки необходимости дополнительной коррекции. В случае недостаточной информативности трансторакальной эхоКГ уточняют диаметр левого предсердия и ЛЖ, ФВ, систолическое давление в ЛА, тяжесть митральной регургитации.
Стресс-эхоКГ используют для оценки функционального значения митральной регургитации, особенно у бессимптомных больных, а также для выявления скрытой дисфункции ЛЖ.
При катетеризации полостей сердца определяют повышенное давление в ЛА. На кривой легочно-капиллярного давления видна характерная картина в виде увеличения волны V более 15 мм рт. ст. с быстрым и крутым падением после нее. При проведении вентрикулографии можно наблюдать, как контрастное вещество в систолу ЛЖ заполняет полость левого предсердия. Интенсивность контрастирования последнего зависит от степени недостаточности митрального клапана.
Течение
Выделяют 5 стадий течения митральной недостаточности.
I стадия — компенсации. Характеризуется минимальной регургитацией крови через митральное отверстие, нарушения гемодинамики практически отсутствуют. Клинически выявляется небольшой систолический шум на верхушке сердца, незначительное увеличение левого предсердия. По данным эхоКГ отмечается незначительная регургитация на митральном клапане. Оперативное лечение не показано.
II стадия — субкомпенсации. Обратный ток крови в левое предсердие увеличивается, нарушения гемодинамики приводят к его дилатации и ГЛЖ, что эффективно компенсирует нарушения гемодинамики. Физическая активность ограничена незначительно, одышка возникает лишь при значительной физической нагрузке. Отмечается систолический шум средней интенсивности на верхушке сердца. На ЭКГ отклонение электрической оси влево, в некоторых случаях — признаки перегрузки левых отделов сердца. При рентгенологическом исследовании отмечается увеличение и усиление пульсации левых отделов сердца. При эхоКГ умеренная регургитация на митральном клапане. Оперативное лечение не показано.
III стадия — правожелудочковой декомпенсации, наступает при значительной регургитации крови в левое предсердие. Периодически возникает декомпенсация сердечной деятельности, устраняемая медикаментозной терапией. При физической нагрузке возникает одышка. Грубый систолический шум на верхушке сердца, иррадиирующий в подмышечную область.
На ЭКГ — признаки ГЛЖ. При рентгенологическом исследовании выявляется значительное увеличение левых отделов сердца, усиление их пульсации — симптом «коромысла». При эхоКГ значительная регургитация на митральном клапане. Показано хирургическое лечение.
IV стадия — дистрофическая, характеризуется появлением правожелудочковой недостаточности. При осмотре отмечается усиление верхушечного толчка, пульсация венозных сосудов на шее. При аускультации, кроме грубого систолического шума митральной недостаточности, нередко отмечаются различные шумы, возникающие вследствие дилатации фиброзных колец, появления недостаточности трехстворчатого клапана. На ЭКГ — признаки ГЛЖ или обоих желудочков, фибрилляция предсердий, экстрасистолическая аритмия. При рентгенологическом исследовании — значительное расширение сердца, застой крови в малом круге кровообращения. Нарушения функции почек и печени. Трудоспособность утрачена. Показано хирургическое лечение.
V стадия — терминальная, клинически соответствует III стадии СН. Дистрофическая стадия нарушения кровообращения с тяжелыми необратимыми изменениями внутренних органов (печени, почек), асцитом. Хирургическое лечение не проводится.
Предикторами плохого прогноза являются клинические симптомы, возраст, наличие фибрилляции предсердий, тяжелая степень митральной регургитации, дилатация левого предсердия и ЛЖ, низкая ФВ, прогрессирование легочной гипертензии.
Лечение
Всем больным показано профилактическое применение антибиотиков перед проведением стоматологических или других оперативных вмешательств для снижения риска развития инфекционного эндокардита.
Основополагающим является лечение основного заболевания у пациентов с ИБС или инфекционным эндокардитом.
Показаниями для назначения антикоагулянтов является постоянная или пароксизмальная форма фибрилляции предсердий. У больных с синусовым ритмом их назначение показано в случае указаний на тромбоэмболические эпизоды в анамнезе или при наличии тромба в левом предсердии, а также в течение первых 3 мес после хирургического восстановления клапана (значение показателя МНО следует поддерживать в пределах 2,0–3,0).
В настоящее время нет доказательств эффективности применения вазодилататоров, включая ингибиторы АПФ, у пациентов без признаков СН, поэтому их применение у этих больных не рекомендуется. С другой стороны, при наличии СН ингибиторы АПФ показаны в случае значительной митральной недостаточности и выраженной клинической симптоматики при противопоказаниях к оперативному вмешательству или при наличии резидуальных симптомов после оперативного лечения, обычно в результате нарушенной функции ЛЖ.
Развивающуюся СН лечат общепринятыми методами, по показаниям назначают мочегонные препараты, блокаторы β-адренорецепторов и спиронолактон.
Основными целями хирургического вмешательства являются уменьшение выраженности клинической симптоматики, сохранение функции ЛЖ, предупреждение/уменьшение выраженности легочной гипертензии и дисфункции ПЖ, поддержание и/или восстановление синусового ритма.
Показаниями к проведению реконструктивных операций являются пороки без грубых изменений створок, хорд, сосочковых мышц и при отсутствии кальциноза клапанов. При тяжелой митральной недостаточности восстановление клапана — оптимальный хирургический подход. Лучшие результаты у больных с ФВ более 60% и величиной конечно-систолического размера менее 45 мм до операции.
В случаях невозможности восстановления клапана предпочтительно проводить замену клапана механическим или биологическим протезом с сохранением естественного аппарата митрального клапана.
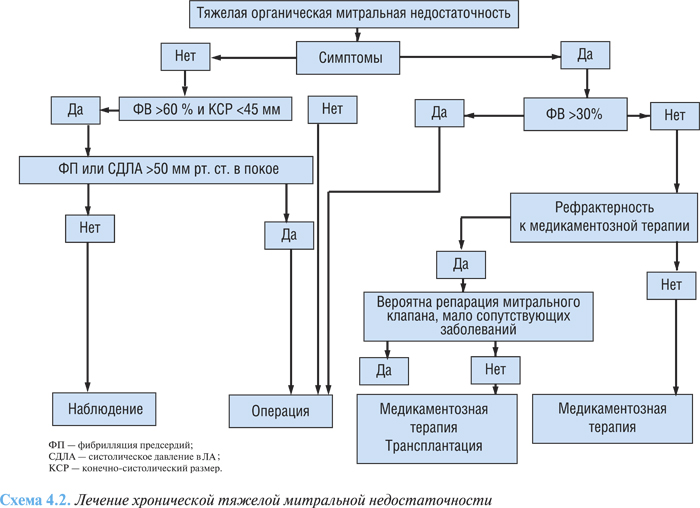
Алгоритм лечения тяжелой митральной недостаточности представлен на схеме 4.2. Протезирование митрального клапана у большинства пациентов обеспечивает продление жизни, а также восстановление трудоспособности в послеоперационный период.
В отношении хирургического лечения бессимптомных больных нет единого мнения, поскольку отсутствуют результаты рандомизированных исследований по данному вопросу. У отдельных групп бессимптомных пациентов с тяжелой митральной недостаточностью хирургическое лечение показано при наличии признаков дисфункции ЛЖ (величина ФВ не более 60% и/или конечно-систолического размера более 45 мм), у больных с фибрилляцией предсердий и сохраненной функцией ЛЖ, с сохраненной функцией ЛЖ и легочной гипертензией.
АОРТАЛЬНЫЙ СТЕНОЗ
Эпидемиология
В настоящее время аортальный стеноз является наиболее часто выявляемым приобретенным пороком сердца в Европе и Северной Америке. Наиболее часто диагностируют кальцинирующий аортальный стеноз (2–7%) в популяции старше 65 лет, чаще у мужчин.
Этиология
Среди этиологических факторов стеноза устья в настоящее время редко (11%) определяют ревматизм. В развитых странах у пациентов старшего возраста наиболее частой причиной порока является дегенеративный кальцинирующий процесс на аортальном клапане (82%). У ⅓ больных с двустворчатым аортальным клапаном прогрессирует фиброз створок вследствие повреждения ткани клапана и ускорения атерогенных процессов, что приводит к возникновению аортального стеноза. Повышенный уровень холестерина, дислипидемия, курение, возраст могут ускорять фиброзные процессы и развитие аортального стеноза.
Классификация
По степени тяжести выделяют незначительный аортальный стеноз (площадь отверстия >1,8 см2, максимальный градиент давления 10–35 мм рт. ст.), умеренный (площадь отверстия 1,2–0,75 см2, максимальный градиент давления 36–65 мм рт. ст.), тяжелый (площадь отверстия <0,75 см2, максимальный градиент давления >65 мм рт. ст.).
Патологическая анатомия
Створки аортального клапана утолщаются и уплощаются вследствие появления фиброзных наложений на желудочковой стороне клапана, а также разрастания ткани клапана вследствие механического раздражения интенсивным кровотоком. Свободные края створок спаиваются, что приводит к постепенному сужению аортального отверстия, которое начинается у места прикрепления клапанных листков к фиброзному кольцу и распространяется к центру. Вследствие завихрения тока крови по обе стороны клапанов на желудочковой поверхности клапана происходит отложение пластин фибрина, которые фиксируются на комиссурах, образуя мостики, связывающие створки клапана между собой и стенкой аорты. В дальнейшем пластины организуются и образуется фиброзная ткань. В тканях клапана развиваются дегенеративные процессы, завершающиеся кальцинозом, который может распространяться на прилежащие структуры — межжелудочковую перегородку, переднюю створку митрального клапана, стенку ЛЖ.
Стенозированное отверстие может иметь треугольную, щелевидную или округлую форму и располагается чаще эксцентрично.
Миокард ЛЖ гипертрофирован, в нем развиваются дистрофические изменения — белковое и жировое перерождение мышечных волокон, а в дальнейшем — диффузный и очаговый склероз. Вследствие гипертрофии миокарда масса сердца может достигать 1200 г и более.
При уменьшении площади отверстия до 0,8–1 см2 возникают гемодинамические проявления порока и регистрируется систолический градиент давления между аортой и ЛЖ. Выраженные нарушения гемодинамики с градиентом до 100 мм рт. ст. и выше отмечают при стенозировании отверстия до 0,5–0,6 см2 (величина градиента обратно пропорциональна площади устья аорты).
Компенсация при аортальном стенозе осуществляется преимущественно за счет изометрической гиперфункции и ГЛЖ, удлинения фазы изгнания. Степень выраженности ГЛЖ пропорциональна тяжести стеноза и длительности заболевания. В дальнейшем полость ЛЖ расширяется, возникает вначале тоногенная, а затем миогенная дилатация.
Появление застоя и гипертензии в малом круге кровообращения относится к поздним признакам порока, правые отделы сердца вовлекаются в патологический процесс при «митрализации» порока и развитии легочной гипертензии.
Клиническая картина
При небольших анатомических изменениях аортального клапана пациенты не предъявляют жалоб и многие годы сохраняют достаточно высокую трудоспособность, могут выполнять работу, сопряженную с большими физическими нагрузками, и даже заниматься спортом. Иногда первым признаком порока может быть СН.
Гемодинамические нарушения сопровождаются повышенной утомляемостью, обусловленной централизацией кровообращения. Эта же причина вызывает головокружение и обмороки. Часто (35%) отмечают боль стенокардического характера. С декомпенсацией порока ведущими становятся жалобы на одышку при физической нагрузке. Неадекватная физическая нагрузка может спровоцировать отек легких. Появление приступов сердечной астмы в сочетании с приступами стенокардии рассматривают как прогностически неблагоприятный признак.
При осмотре отмечают бледность кожных покровов. При выраженном аортальном стенозе пульс малый и медленный, систолическое и пульсовое давление снижено. Верхушечный толчок мощный, разлитой, приподнимающий, смещен вниз и влево. В области рукоятки грудины приложенная ладонь ощущает выраженное систолическое дрожание. Перкуторные границы относительной сердечной тупости смещены влево и вниз (до 20 мм и более).
Аускультативно во втором межреберье справа от грудины определяется ослабление II тона, а также систолический шум, проводящийся во все точки сердца, на сосуды шеи, преимущественно вправо и на спину, пик его во второй половине систолы. Иногда шум выслушивается на расстоянии (дистанционный шум). Исчезновение II аортального тона специфично для выраженного порока.
Диагностика
На ЭКГ по мере прогрессирования порока определяются признаки ГЛЖ в виде увеличенной амплитуды зубцов комплекса QRS в соответствующих отведениях, чаще в сочетании с измененной конечной частью желудочкового комплекса. В поздних стадиях порока могут отмечаться высокие расщепленные зубцы РІ и РІІ и низкие зубцы РІІІ. Нередко регистрируются различной степени нарушения предсердно-желудочковой проводимости: от удлинения интервала P–Q до полной AV-блокады.
Рентгенологическое исследование имеет важное значение: на ранних этапах выявляется умеренное расширение сердца влево и удлинение дуги ЛЖ с закруглением верхушки. При длительном течении порока и выраженном стенозе сердце имеет типичную аортальную конфигурацию. При развитии относительной недостаточности митрального клапана отмечается увеличение размеров левого предсердия и появление рентгенологических признаков застоя в малом круге кровообращения.
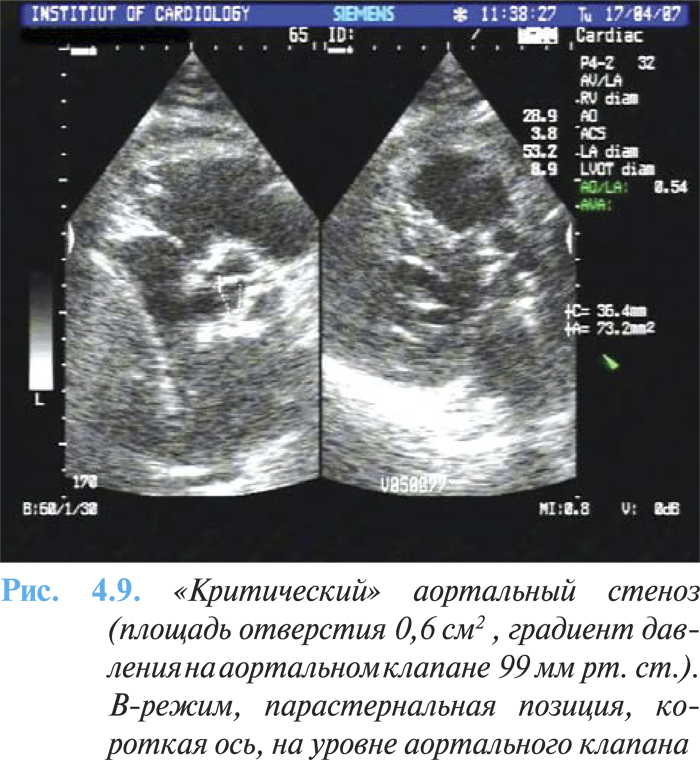
ЭхоКГ имеет основное диагностическое значение, с ее помощью верифицируют порок, оценивают степень кальцификации клапана, гипертрофии миокарда (массу ЛЖ) и функцию ЛЖ (рис. 4.8а, б). При двухмерной эхоКГ выявляется утолщение и кальцификация створок аортального клапана с уменьшением их подвижности. Методом допплерографии возможно точно оценить тяжесть порока, величину систолического градиента и площадь аортального отверстия, поскольку величина трансклапанного градиента давления зависит от кровотока. Также определяются признаки диастолической дисфункции по типу нарушения релаксации ЛЖ. Величина стенозирования менее 1 см2 расценивается как тяжелый порок (рис. 4.9).
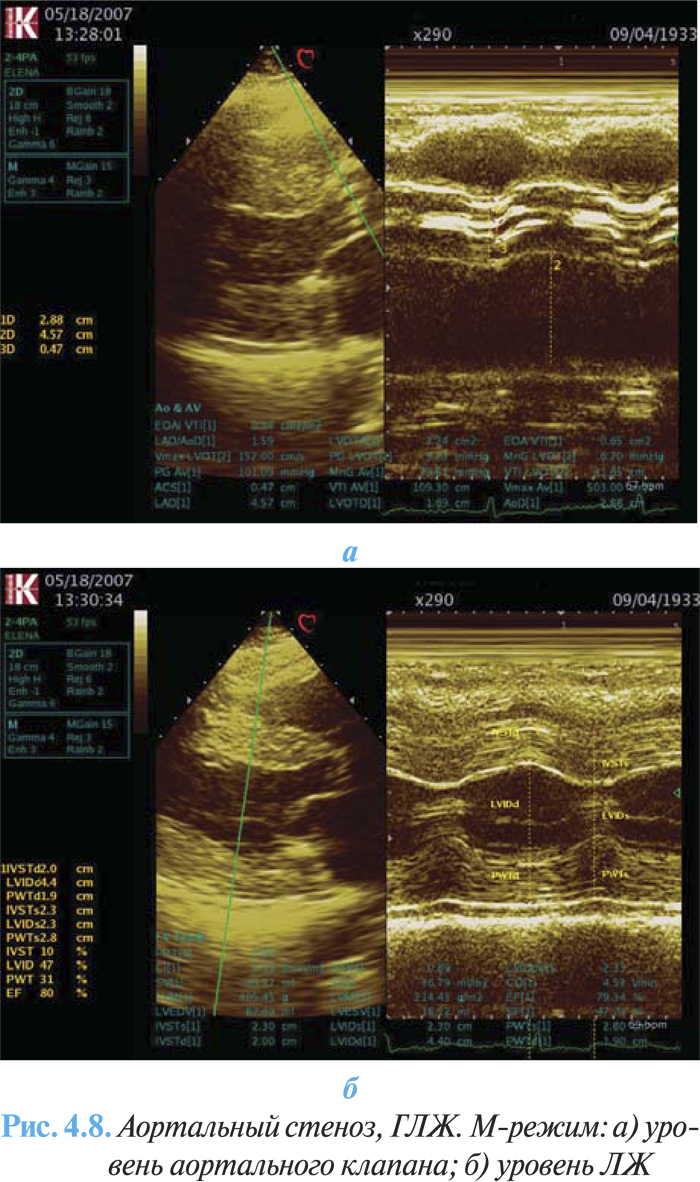
Катетеризация правых отделов позволяет определить давление в левом предсердии, ПЖ и в ЛА, что дает представление о степени компенсации порока. Ретроградная катетеризация ЛЖ позволяет по систолическому градиенту между ЛЖ и аортой определить степень стенозирования аортального отверстия.
Нагрузочные тесты противопоказаны у симптомных больных, но применяются для выявления симптомов и стратификации риска у бессимптомных пациентов с тяжелым аортальным стенозом.
При необходимости для оценки восходящей аорты проводят КТ или МРТ.
Течение
Выделяют 5 стадий аортального стеноза.
I стадия — полной компенсации. Жалоб нет, порок выявляют лишь при аускультации. На эхоКГ определяется небольшой максимальный градиент систолического давления на аортальном клапане (до 35 мм рт. ст.). Хирургическое лечение не показано.
II стадия — скрытой СН. Больные жалуются на повышенную утомляемость, одышку при физической нагрузке, головокружение. Кроме аускультативных признаков аортального стеноза выявляют рентгенологические и электрокардиографические признаки ГЛЖ. При эхоКГ-исследовании определяется умеренный градиент систолического давления на аортальном клапане (до 65 мм рт. ст.). Показано хирургическое лечение.
III стадия — относительной коронарной недостаточности. Пациенты жалуются на боль стенокардического характера, прогрессирующую одышку, головокружение и обмороки после физических нагрузок. Определяется отчетливое увеличение размеров сердца, преимущественно за счет ЛЖ. На ЭКГ — выраженные признаки ГЛЖ, гипоксии миокарда. При эхоКГ определяется максимальный градиент систолического давления выше 65 мм рт. ст. Показано хирургическое лечение.
IV стадия — выраженной левожелудочковой недостаточности. Жалобы аналогичны таковым при III стадии, но более выраженные. Периодически возникают приступы пароксизмальной одышки ночью, сердечной астмы, появляются отек легких, увеличение печени. На ЭКГ — признаки нарушения коронарного кровообращения, часто фибрилляция предсердий. При проведении эхоКГ на фоне значительного ухудшения показателей сократительной функции ЛЖ определяется значительный градиент систолического давления на аортальном клапане, часто кальциноз клапана. При рентгенологическом исследовании определяется увеличение ЛЖ и других отделов сердца, а также застойные явления в легких.
Постельный режим и консервативная терапия способствуют временному улучшению состояния отдельных больных. Хирургическое лечение в большинстве случаев невозможно, вопрос решается индивидуально.
V стадия — терминальная, характеризуется прогрессирующей недостаточностью ЛЖ и ПЖ. Резко выражены все субъективные и объективные признаки порока. Состояние больного крайне тяжелое, лечение неэффективно, хирургическое лечение не проводят.
Лечение
Прогрессирование дегенеративного аортального стеноза является активным процессом, имеющим много сходного с атеросклерозом, в связи с чем рекомендуются подходы, аналогичные таковым для вторичной профилактики атеросклероза.
Несмотря на то что несколько ретроспективных сообщений показали положительный эффект статинов и ингибиторов АПФ, эти данные противоречивы и их недостаточно для внесения в рекомендации.
Специфических консервативных методов лечения аортального стеноза нет. При невозможности оперативного лечения развивающуюся СН лечат с применением диуретиков, сердечных гликозидов, ингибиторов АПФ или антагонистов рецепторов ангиотензина II. Блокаторы β-адренорецепторов назначать этим пациентам не следует. При сопутствующей АГ дозу антигипертензивных препаратов следует осторожно титровать во избежание гипотензии.
Для поддержания синусового ритма применяют антиаритмические препараты.
Всем больным с аортальным стенозом показана медикаментозная профилактика эндокардита.
Радикальное лечение аортального стеноза — хирургическое, абсолютных противопоказаний к операции нет, исключая терминальную стадию СН. Алгоритм лечения тяжелого аортального стеноза представлен на схеме 4.3.
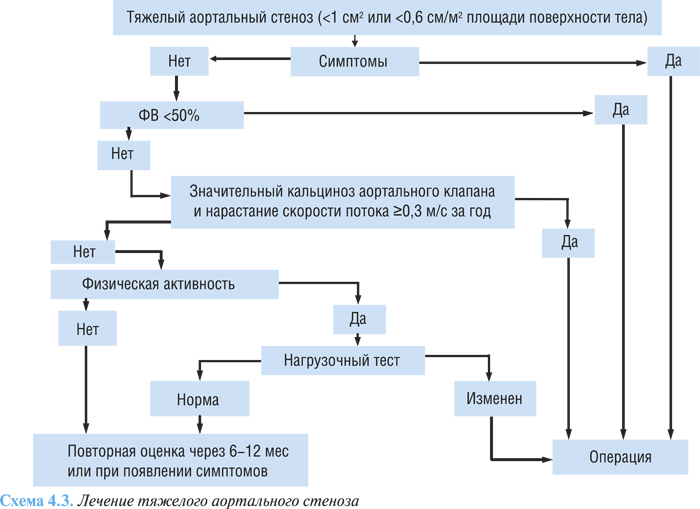
Баллонная вальвулопластика имеет ограниченное значение у взрослых пациентов из-за низкой эффективности, а также высокого уровня осложнений (более 10%), рестенозов и клинического ухудшения у большинства пациентов в течение 6–12 мес после вмешательства.
Целесообразность перкутанной замены клапана на ранних стадиях нуждается в дальнейшем изучении для оценки ее эффективности. В отношении терапии бессимптомных больных с тяжелым аортальным стенозом нет единого мнения.
При своевременно проведенной операции отдаленные результаты хорошие.
Прогноз
Средняя продолжительность жизни после появления выраженных симптомов СН не превышает 1 года. Считается, что при появлении обмороков, стенокардии или левожелудочковой недостаточности продолжительность жизни ограничивается 2–4 годами. Смерть наступает от хронической недостаточности кровообращения, а также внезапно вследствие коронарной недостаточности или фибрилляции желудочков (14–18% случаев), не всегда удается устранить у больного отек легких.
Недавно определены предикторы прогрессирования и плохого прогноза аортального стеноза у бессимптомных пациентов, среди которых к клиническим относят старший возраст и наличие факторов риска атеросклероза, к эхоКГ-предикторам относят кальцификацию клапана, максимальную скорость потока, ФВ ЛЖ, прогрессирование гемодинамических расстройств и увеличение градиента при нагрузках, а также появление симптомов при проведении нагрузочных тестов.
АОРТАЛЬНАЯ НЕДОСТАТОЧНОСТЬ
Эпидемиология
Частота выявления пороков сердца в значительной степени зависит от методов исследования, используемых для диагностики. Общая распространенность аортальной недостаточности составляла 4,9% во Фремингемском исследовании и 10% в строгом исследовании сердца, из них аортальная недостаточность средней или тяжелой степени составляла 0,5 и 2,7% соответственно. Распространенность данного порока увеличивается с возрастом, при этом клинические проявления тяжелой аортальной недостаточности чаще отмечают у мужчин, чем у женщин.
Этиология
Наиболее частая причина в последнее время связана с заболеванием (аневризмой) восходящей аорты и двустворчатым аортальным клапаном, в 50% причиной являются дегенеративные изменения аортального клапана. Более редкими причинами могут быть ревматизм (15%), атеросклероз, инфекционный эндокардит (8%).
Классификация
По степени тяжести выделяют начальную аортальную недостаточность (объем регургитации <30 мл за сокращение, фракция регургитации <30%, эффективная площадь отверстия регургитации <10 см2), умеренную (объем регургитации 30–59 мл за сокращение, фракция регургитации 30–49%, эффективная площадь отверстия регургитации 0,10–0,29 см2), тяжелую аортальную недостаточность (объем регургитации >60 мл за сокращение, фракция регургитации >50%, эффективная площадь отверстия регургитации >0,30 см2).
Патологическая анатомия
Морфологические изменения выявляют преимущественно в соединительной ткани клапана аорты: створки укорачиваются и деформируются, края их утолщаются, свободный край может подворачиваться, створка часто провисает. Все эти изменения приводят к несмыканию створок в диастолу.
При инфекционном эндокардите недостаточность клапана возникает вследствие перфорации, разрыва створок или разрушения их свободного края. После острого инфекционного процесса деформация может продолжаться вследствие рубцового сморщивания и обызвествления.
ЛЖ увеличен, отмечается ГЛЖ и дилатация полости, масса сердца достигает 1000–1300 г. При гистологическом исследовании выявляют воспалительные и дегенеративные изменения.
Патологическая физиология
Недостаточность аортального клапана характеризуется значительными нарушениями центральной и периферической гемодинамики, которые обусловлены регургитацией крови в ЛЖ во время диастолы, что ведет к его объемной перегрузке и повышению диастолического растяжения миокарда с последующим увеличением силы его сокращения.
Необходимое капиллярное давление поддерживается за счет укорочения диастолического периода. В поддержании компенсации кровообращения имеет значение активное изменение тонуса периферических сосудов: преходящее его снижение в систолу и повышение в диастолу ЛЖ. Обратный ток крови в ЛЖ резко увеличивает объем выполняемой им работы. Вначале ЛЖ увеличивается, затем гипертрофируется, масса миокарда его может увеличиваться втрое. Истощение функциональных резервов приводит к повышению диастолического давления в ЛЖ, его дилатации и к относительной недостаточности митрального клапана с последующей легочной гипертензией.
Клиническая картина
Во многом зависит от темпов формирования и величины дефекта клапана. В фазе компенсации субъективные ощущения обычно отсутствуют. Постепенно прогрессирующий порок протекает благоприятно даже при значительной величине аортальной регургитации. При быстром развитии больших дефектов симптоматика стремительно прогрессирует и приводит к СН.
Некоторые больные ощущают сердцебиение, головокружение. Приблизительно у 50% больных с недостаточностью аортального клапана атеросклеротической или сифилитической этиологии ведущим симптомом бывает стенокардия. Одышка возникает вначале при значительной физической нагрузке, а затем по мере развития левожелудочковой недостаточности — в покое и напоминает сердечную астму. Иногда течение внезапно осложняется отеком легких вследствие левожелудочковой недостаточности.
Для выраженной недостаточности аортального клапана характерны периферические симптомы, обусловленные большими перепадами давления в сосудистом русле: бледность кожных покровов, пульсация сонных («пляска каротид»), височных и плечевых артерий, синхронное сотрясение головы (симптом Мюссе), пульсирующее сужение зрачков (симптом Ландольфи), капиллярный пульс — ритмичное изменение интенсивности окраски небного язычка и миндалин (симптом Мюллера), ногтевого ложа (симптом Квинке).
При осмотре определяется высокий и скорый пульс (пульс Корригана), усиленный и разлитой верхушечный толчок, границы сердца расширены влево и вниз. Над крупными сосудами выслушивается двойной тон Траубе, при надавливании стетоскопом на подвздошную артерию в области пупартовой связки возникает двойной шум Дюрозье. САД чаще повышено до 160–180 мм рт. ст., а ДАД резко снижено — до 50–30 мм рт. ст.
Аускультативно выявляют основной характерный признак: диастолический шум, который начинается сразу за II тоном, нередко заглушая его, постепенно ослабевает к концу диастолы. При перфорации створок шум приобретает звенящий, «музыкальный» оттенок. С развитием СН признаки порока становятся менее выраженными, интенсивность и длительность диастолического шума уменьшается.
Диагностика
На ЭКГ при выраженной аортальной недостаточности отмечаются отклонение электрической оси сердца влево, признаки ГЛЖ в виде увеличенной амплитуды зубцов комплекса QRS в соответствующих отведениях, чаще в сочетании с измененной конечной частью желудочкового комплекса (уплощение, инверсия зубца Т, снижение сегмента ST) . Иногда отмечается удлинение интервала P–Q, свидетельствующее о нарушении AV-проводимости.
Рентгенологическое исследование выявляет увеличение сердца: ЛЖ массивный, удлиненный, с закругленной верхушкой. Восходящая часть аорты расширена, выступает по правому контуру тени сердца, по левому контуру определяется расширенная дуга аорты. Сердце приобретает аортальную конфигурацию.
ЭхоКГ и допплерография являются важными методами в установлении диагноза и оценке степени тяжести аортальной недостаточности. Метод позволяет оценить этиологию и механизмы возникновения аортальной регургитации, описать морфологию клапана, а также состояние и размеры аорты на 4 различных уровнях (кольцо, синус Вальсальвы, синотубулярное соединение и восходящая аорта), оценить ФВ ЛЖ, размеры и степень ГЛЖ. Для диагностики и определения тяжести порока используют цветовую и постоянноволновую допплерографию, с помощью которой можно визуализировать поток аортальной регургитации (рис. 4.10.).
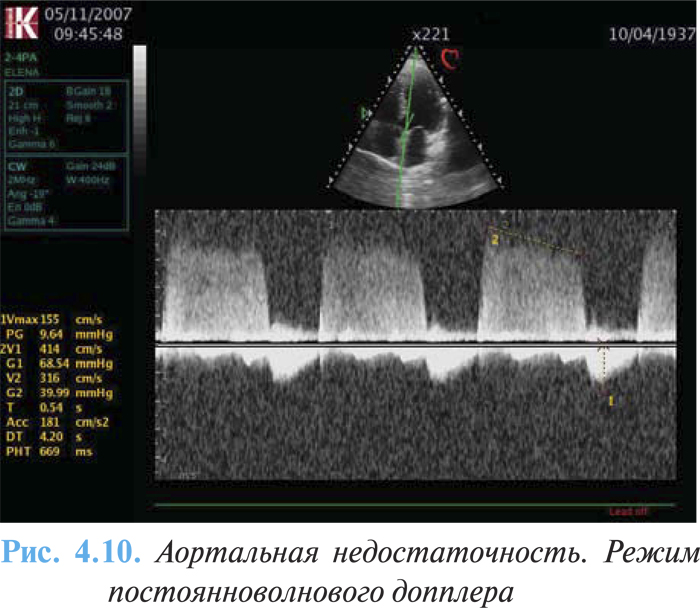
Чреспищеводную эхоКГ применяют для более четкой оценки морфологии клапана и восходящей аорты, особенно перед планируемым хирургическим вмешательством.
Разработаны эхоКГ-критерии тяжелой аортальной недостаточности. К специфическим признакам относят следующие:
- центральный поток составляет не менее 65% выносящего тракта ЛЖ;
- размер vena contracta >0,6 см (рис. 4.11).
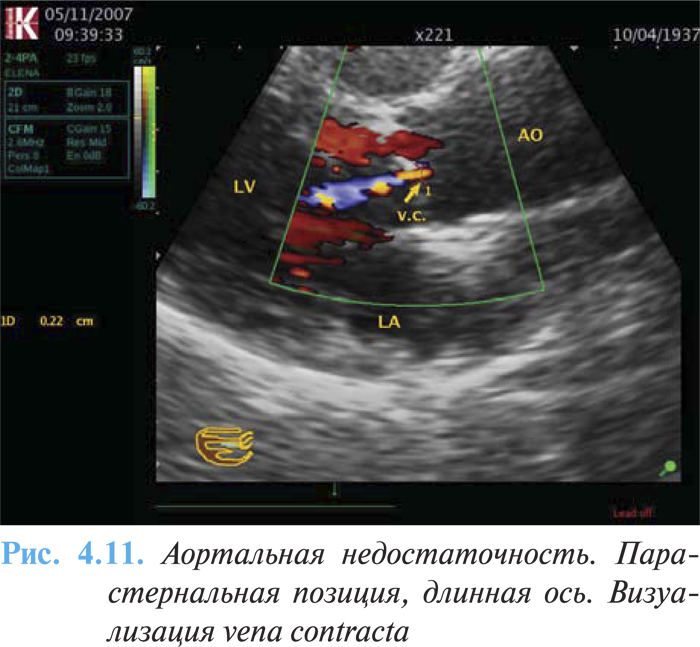
К вероятным признакам тяжелой аортальной недостаточности относят следующие:
- время полуспада давления <200 мс;
- голодиастолический аортальный поток в нисходящую аорту;
- умеренное или значимое расширение ЛЖ. Количественные критерии тяжелой аортальной недостаточности включают величину объема регургитации не менее 60 мл за сокращение, фракцию регургитации не менее 50%, эффективную площадь отверстия регургитации не менее 0,30 см2 (рис. 4.12).
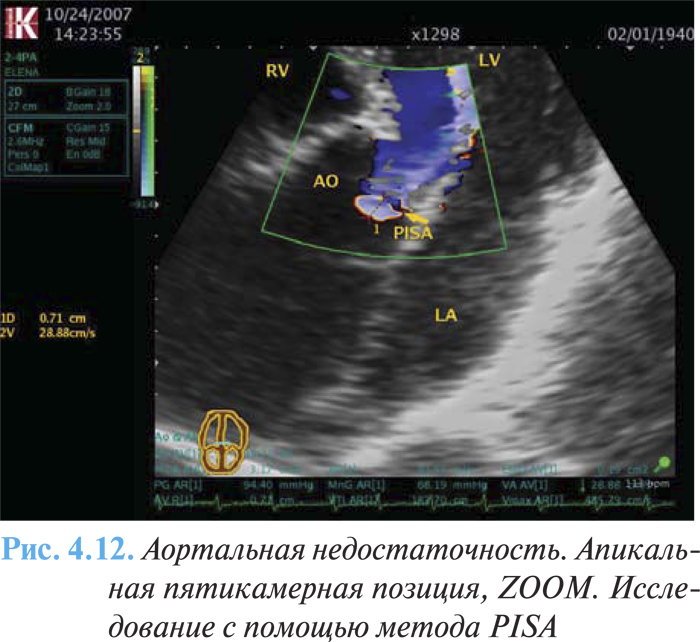
В настоящее время клиническое решение не базируется на изменении ФВ при нагрузках, ни на данных стресс-эхоКГ, поскольку эти параметры не могут быть адекватно оценены.
Катетеризация правых отделов позволяет определить уровень легочно-капиллярного давления и волну регургитации. Катетеризация левых отделов сердца позволяет выявить увеличение амплитуды пульсового давления. При аортографии определяется выраженная регургитация из аорты в ЛЖ. Ангиографию коронарных артерий до протезирования аортального клапана проводят у пациентов с высоким риском развития ИБС.
При необходимости больным можно проводить МРТ для определения степени тяжести регургитации и функции ЛЖ, особенно при недостаточной визуализации при эхоКГ. МРТ или КТ рекомендуется проводить для оценки аорты при признаках ее расширения, выявленных при эхоКГ, особенно при наличии двустворчатого аортального клапана или синдроме Марфана.
Течение
Выделяют 5 стадий недостаточности аортального клапана.
I стадия — компенсации, характеризуется начальными симптомами порока при отсутствии жалоб. При эхоКГ определяется незначительная регургитация на аортальном клапане. Хирургическое лечение не показано.
II стадия — скрытой СН. Отмечается умеренное снижение работоспособности при выраженных клинических признаках порока. Определяются характерные физикальные данные порока, повышение пульсового давления. На ЭКГ — признаки умеренной ГЛЖ. При рентгенологическом исследовании умеренное увеличение и усиление пульсации ЛЖ. При эхоКГ определяется умеренная регургитация на аортальном клапане. Хирургическое лечение не показано.
III стадия — субкомпенсации, отмечаются значительное снижение физической активности, приступы ангинозной боли. Усиленная пульсация сонных артерий, минимальное АД обычно составляет менее половины максимального. На ЭКГ — признаки выраженной гипоксии миокарда и ГЛЖ. При рентгенологическом исследовании отмечают дилатацию и усиленную пульсацию ЛЖ и аорты. При эхоКГ определяется значительная регургитация на аортальном клапане. Показано хирургическое лечение.
IV стадия — декомпенсации. Проявляется выраженной одышкой и приступами ангинозной боли при небольшой физической нагрузке, определяется значительная дилатация сердца, часто обусловливающая относительную митральную недостаточность, дальнейшее ухудшение функции миокарда, прогрессирование коронарной недостаточности. Выраженные расстройства кровообращения, проявляющиеся сердечной астмой, увеличением печени и др. Применение медикаментозной терапии и постельный режим способствуют лишь временному улучшению состояния больных. Показано хирургическое лечение.
V стадия — терминальная, клинически соответствует III стадии СН и характеризуется прогрессирующей недостаточностью ЛЖ и ПЖ, глубокими дегенеративными изменениями внутренних органов (периферические отеки, асцит, трофические нарушения). Медикаментозное лечение неэффективно. Хирургическое лечение не проводят.
Лечение
Специфических консервативных методов лечения аортальной недостаточности нет, развивающуюся СН лечат, используя общепринятые методы. Препаратами выбора при противопоказаниях к хирургическому лечению или персистирующей послеоперационной дисфункции ЛЖ являются ингибиторы АПФ.
У бессимптомных больных с АГ показаны вазодилататоры (ингибиторы АПФ или дигидропиридиновые антагонисты кальциевых каналов). Роль вазодилататоров у бессимптомных пациентов без гипертензии для отсрочки оперативного вмешательства не доказана.
При тяжелой аортальной недостаточности блокаторы β-адренорецепторов назначают с большой осторожностью, поскольку удлинение диастолы увеличивает объем регургитации, однако их можно использовать у пациентов с выраженной дисфункцией ЛЖ.
У больных с синдромом Марфана блокаторы β-адренорецепторов замедляют прогрессирование дилатации аорты, а также показаны после оперативного вмешательства.
У больных необходимо проводить профилактику антибиотиками перед инвазивными процедурами.
На хирургическое лечение следует направлять всех пациентов с симптомной аортальной недостаточностью. Цель оперативного вмешательства — улучшение выживаемости, уменьшение выраженности симптоматики, предупреждение развития послеоперационной СН и аортальных осложнений у больных с аневризмой аорты. Абсолютных противопоказаний к операции нет, исключая терминальные стадии СН. При своевременно проведенной операции отдаленные результаты хорошие.
Показания для оперативного вмешательства при тяжелой аортальной недостаточности:
- симптомные больные (одышка, II–IV ФК по NYHA или стенокардия);
- бессимптомные больные с ФВ ЛЖ в покое не более 50%;
- больные, у которых проводят АКШ или операцию на восходящей аорте или на другом клапане;
- бессимптомные больные с ФВ ЛЖ в покое более 50% с выраженной дилатацией ЛЖ (конечно-диастолический размер более 70 мм или конечно-систолический размер более 50 мм).
Алгоритм лечения аортальной недостаточности представлен на схеме 4.4.
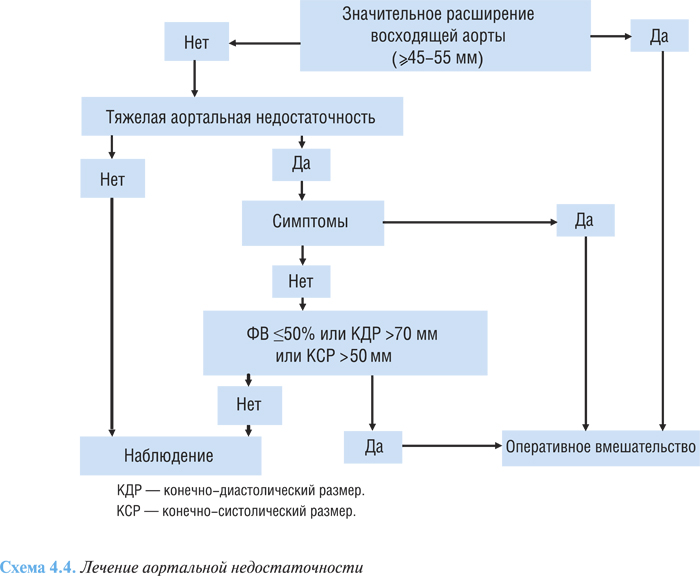
Вне зависимости от тяжести аортальной недостаточности операция показана больным с максимальным диаметром корня аорты не менее 45 мм с синдромом Марфана, не менее 50 мм с двустворчатым аортальным клапаном и не менее 55 мм у всех других больных.
Прогноз
В среднем от времени появления субъективных симптомов до летального исхода проходит 6,5 года. Быстро формируется СН у больных с отрывом створки или обширными разрушениями клапана при инфекционном эндокардите, средняя продолжительность жизни этих больных не превышает 1 года. Более благоприятно протекает недостаточность аортального клапана атеросклеротической этиологии, редко приводящая к большим дефектам створок клапана.
ТРИКУСПИДАЛЬНЫЙ СТЕНОЗ
Этиология
Наиболее частой причиной приобретенного порока трехстворчатого клапана являются ревматизм (более 90%) и карциноидный синдром (10–50%). Среди других причин можно назвать травмы, опухоли правого предсердия и инфекционный эндокардит (у инъекционных наркоманов).
Патологическая анатомия
Морфологически отмечают склероз створок, фиброзного кольца, сухожильных хорд и верхушек сосочковых мышц. При ревматическом поражении трехстворчатого клапана происходит утолщение и укорочение створок, сращение комиссур.
Патологическая физиология
При стенозе отверстия трехстворчатого клапана перемещение крови из правого предсердия в ПЖ происходит при наличии градиента давления между ними, увеличивающемся на вдохе, или при нагрузках и уменьшающемся на выдохе. Компенсация кровообращения в известных пределах происходит за счет расширения и гипертрофии правого предсердия. В дальнейшем относительно слабое правое предсердие быстро дилатирует, когда среднее давление в правом предсердии превышает 10 мм рт. ст., развивается застой в большом круге кровообращения с вовлечением органов брюшной полости. Раннее развитие застоя в венах большого круга кровообращения, характерное для стеноза отверстия трехстворчатого клапана, контрастирует с отсутствием ортопноэ и легочного застоя.
Клиническая картина и диагностика
Особенных жалоб больные не предъявляют, часто возникает одышка. При осмотре отмечают набухшие яремные вены — один из первых признаков трикуспидального стеноза. В большинстве случаев явно выражена пресистолическая пульсация шейных вен. Венозное давление резко повышено, отмечают артериальную гипотензию.
Аускультативно определяется характерный низкоамплитудный диастолический шум, наиболее интенсивный в конце диастолы.
На ЭКГ характерными признаками порока являются гипертрофия правого предсердия (высокий зубец Р во II и III отведениях и aVF) с нерезко выраженной гипертрофией ПЖ, возможны неспецифические изменения конечной части желудочкового комплекса (уплощение, инверсия зубца Т, снижение сегмента ST) в грудных отведениях. Часто наблюдается фибрилляция предсердий.
При рентгенологическом исследовании определяют увеличение размеров правого предсердия.
При эхоКГ-исследовании определяется типичная картина стеноза отверстия с наличием градиента диастолического давления между ПЖ и правым предсердием. Не существует градаций тяжести порока. Величина среднего градиента давления более 5 мм рт. ст. считается клинически значимой, при площади отверстия <2,0 см2 диагностируют тяжелую степень трикуспидального стеноза. Можно определить морфологию клапана и подклапанного аппарата, а также степень сопутствующей трикуспидальной регургитации. Створки часто утолщены со сниженной мобильностью вследствие воспалительного процесса вдоль комиссур.
При катетеризации правых отделов сердца сердечный выброс снижен, давление в ПЖ и ЛА нормальное или сниженное. Основным гемодинамическим признаком порока является градиент диастолического давления между ПЖ и правым предсердием.
Лечение
Специфических консервативных методов терапии нет, развивающуюся СН лечат, используя общепринятые методы. Лечение направлено на уменьшение застоя в большом круге кровообращения, увеличение наполнения ПЖ. Эффективность диуретиков ограничена.
Необходимо проведение профилактики возникновения инфекционного эндокардита.
Хирургическое лечение проводят в условиях искусственного кровообращения, используя пластику и протезирование клапана. Протезирование трехстворчатого клапана проводят только при грубых изменениях створок и подклапанных структур, обусловливающих тяжелый стеноз. Предпочтение отдают биологическим протезам по сравнению с механическими из-за высокого риска развития тромбоза.
Прогноз
Период компенсации порока обычно непродолжительный. Рано присоединяется фибрилляция предсердий, еще больше нарушающая гемодинамику. Трикуспидальный стеноз относят к наиболее неблагоприятно протекающим приобретенным порокам сердца.
ТРИКУСПИДАЛЬНАЯ НЕДОСТАТОЧНОСТЬ
Этиология
Причиной порока может быть любое повреждение аппарата клапана, включая патологию кольца, створок, хорд и папиллярных мышц. Наиболее часто недостаточность трехстворчатого клапана обусловлена правожелудочковой недостаточностью вследствие легочной гипертензии, возникающей из-за левожелудочковой недостаточности. Причинами также могут быть ревматизм, карциноид, инфекционный эндокардит, миксоматоз, травмы.
Патологическая анатомия
Для органической недостаточности трехстворчатого клапана характерно значительное расширение фиброзного кольца за счет области передней и задней створок и соответствующих комиссур. Часть фиброзного кольца, соответствующая основанию перегородочной створки, не дилатируется и является единым целым с перегородочной частью межжелудочковой перегородки. Относительная недостаточность характеризуется отсутствием фиброзных изменений, отмечается лишь утолщение краев створок, вызванное постоянным воздействием волны регургитации.
Патологическая физиология
Регургитация крови из ПЖ в правое предсердие относительно быстро ведет к дилатации правого предсердия без существенной его гипертрофии. Компенсация порока осуществляется подобно митральной недостаточности, однако компенсирующие возможности правого предсердия меньше, поэтому рано формируются венозная гипертензия и венозный застой с депонированием крови в печени и других органах брюшной полости.
Недостаточность трехстворчатого клапана с большим объемом регургитации создает в систолу волну обратного тока, которая приводит к систолической пульсации яремных вен и печени.
Среднее давление в полости правого предсердия повышено в 2–3 раза и более. Как и при недостаточности митрального клапана, вследствие большей податливости к растяжению сердечной мышцы, чем фиброзного кольца, возможно появление относительного стеноза с небольшим градиентом диастолического давления между правым предсердием и ПЖ, манифестирующего слабым диастолическим шумом.
Клиническая картина
Типичны жалобы на одышку, слабость, сердцебиение, тяжесть в правом подреберье. Если порок формируется у больного с ранее имевшимся митральным стенозом, застойные явления в малом круге кровообращения уменьшаются, одышка ослабевает, больной легче переносит горизонтальное положение.
При осмотре отмечают систолическую пульсацию шейных вен, обусловленную обратным током крови из ПЖ, набухание шейных вен в положении лежа, выраженную пульсацию в эпигастрии, в области печени.
Аускультативно определяется систолический шум средней интенсивности, усиливающийся ко II тону и определяющийся у основания мечевидного отростка, слева у нижнего края грудины, шум усиливается на вдохе (симптом Риверо — Корвалло).
Диагностика
На ЭКГ определяются признаки гипертрофии ПЖ в виде увеличенной амплитуды зубцов комплекса QRS в соответствующих отведениях в сочетании с измененной конечной частью желудочкового комплекса (уплощение, инверсия зубца Т, снижение сегмента ST) в тех же отведениях, увеличение зубца Р в отведениях II, III и aVF. Может определяться фибрилляция предсердий.
Рентгенологически определяются расширение верхней полой вены, преобладающее увеличение правых отделов сердца, закругление их контуров во всех проекциях, увеличение правого предсердия и ПЖ во второй косой проекции.
ЭхоКГ-исследование выявляет структурные нарушения клапана, наличие вегетаций, позволяет оценить увеличение размеров и функцию ПЖ, несмотря на определенные ограничения. Допплерография позволяет полуколичественно оценить тяжесть регургитации, измерить максимальное систолическое давление в ПЖ путем измерения максимальной скорости потока регургитации на трехстворчатом клапане.
Разработаны эхокардиографические критерии тяжелой трикуспидальной недостаточности. К специфическим признакам относят следующие:
- размер vena contracta >0,7 см;
- широкая конвергенция потока (радиус конвергенции >0,9 см для центрального потока);
- систолический обратный поток в печеночных венах.
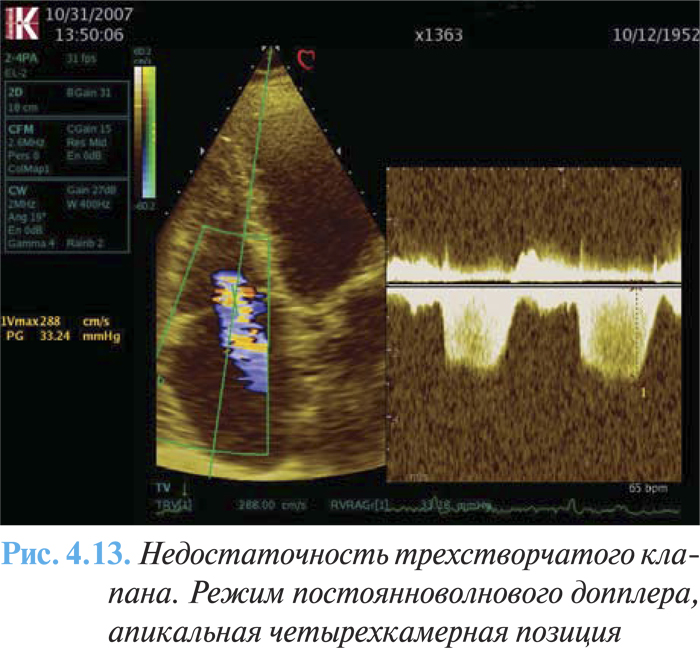
К дополнительным признакам тяжелой трикуспидальной недостаточности относят следующие:
- интенсивный треугольный поток трикуспидальной регургитации в режиме постоянноволнового допплера (рис. 4.13);
- дилатация полой вены и вариабельность ее диаметра на вдохе менее 50%;
- превалирование пика Е транстрикуспидального потока;
- дилатация правого предсердия и ПЖ.
О наличии и выраженности трикуспидальной недостаточности можно судить по кривым давления в правом предсердии при катетеризации сердца.
Проведение МРТ показано для получения дополнительной информации о размерах и функции ПЖ.
Течение органической трикуспидальной недостаточности, как правило, быстро прогрессирующее, рефрактерное к терапии. Наиболее тяжело протекает органическая трикуспидальная недостаточность, которая присоединяется к сформированному митральному пороку, поскольку быстро нарастают нарушения кровообращения. Осложнениями порока часто бывают фибрилляция предсердий, тромбирование полости правого предсердия с ТЭЛА, иногда желудочно-кишечные кровотечения.
Лечение
Специфических консервативных методов лечения нет, пациентов с развивающейся СН лечат, используя общепринятые методы. Диуретики уменьшают симптомы застоя. По показаниям назначают периферические вазодилататоры, блокаторы β-адренорецепторов, антикоагулянты. Лечение направлено на уменьшение застоя в большом круге кровообращения, уменьшение объема выброса из ПЖ, коррекцию метаболизма миокарда и гомеостаза.
ЛИТЕРАТУРА
- Бешляга В.М., Кнышов Г.В., Зиньковский М.Ф. и др. (2000) Оценка степени нарушения гемодинамики и определение показаний к оперативному лечению больных с дискретным субаортальным стенозом, установленным по данным эхокардиографии. Укр. кардіол. журн., 3: 61-65.
- Дзяк Г.В., Писаревська О.В. (1998) Діагностична цінність деяких імунологічних показників у хворих, оперованих з приводу набутих вад серця. Укр. кардіол. журн., 7-8: 53-56.
- Кнышов Г.В., Бендет Я.А. (1997) Приобретенные пороки сердца. Институт сердечно-сосудистой хирургии, Киев, 280 с.
- Коваленко В.М., Лутай М.І., Сіренко Ю.М. (ред.) (2007) Серцево-судинні захворювання. Класифікація, стандарти діагностики та лікування кардіологічних хворих. Київ, 121 с.
- Коваленко В.Н., Несукай Е.Г. (2001) Некоронарогенные болезни сердца. Практич. руководство. Морион, Киев, 480 с.
- Коваленко В.Н., Несукай Е.Г. (2001) Некоронарогенные болезни сердца. Практич. руководство. Морион, Киев, 480 с.
- Шиллер Н., Осипов М.А. (2005) Клиническая эхокардиография. 2-е изд. Практика, Москва, 344 с.
- Alpert J.S., Dalen J.E., Rahimtoola S.H. (2000) Valvular Heart Disease. 3rd ed. Williams&Wilkins, Lippincott, USA. 478 p.
- Babu, A.N., Kymes, S.M., Carpenter F.S.M. (2003) Eponyms and the Diagnosis of Aortic Regurgitation: What Says the Evidence? Ann. Intern. Med., 138: 736-742.
- Bermejo J., Odreman R., Feij oo J. et al. (2003) Clinical efficacy of Doppler-echocardiographic indices of aortic valve stenosis: a comparative test-based analysis of outcome. J. Am. Coll. Cardiol., 41: 142-151.
- Carabello B.A. (2005) Modern management of mitral stenosis. Circulation., 112: 432-437.
- Cowell S.J., Newby D.E., Prescott R.J. et al. (2005) A randomized trial of intensive lipid-lowering therapy in calcific aortic stenosis. N. Engl. J. Med.,. 352: 2389-2397.
- Das P., Rimington H., Chambers J. (2005) Exercise testing to stratify risk in aortic stenosis. Eur. Heart J., 26: 1309-1313.
- Enriquez-Sarano M., Avierinos J.F., Messika-Zeitoun D. et al. (2005) Quantitative determinants of the outcome of asymptomatic mitral regurgitation. N. Engl. J. Med., 352: 875-883.
- Evangelista A., Tornos P., Sambola A. et al. (2005) Long-term vasodilator therapy in patients with severe aortic regurgitation. N. Engl. J. Med., 353: 1342-1349.
- Fann J.I., Ingels N.B.Jr, Miller D.C. (2003) Pathophysiology of Mitral Valve Disease. Card. Surg. Adult., 2: 901-931.
- Galderisi M., Mondillo S. Echocardiography in clinical practice (2007) One Way S.r.l., 120 p.
- Garcia D., Pibarot P., Landry C. et al. (2004) Estimation of aortic valve effective orifice area by Doppler echocardiography: effects of valve inflow shape and flow rate. J. Am. Soc. Echocardiogr., 17: 756-765.
- Glockner J.F., Johnston D.L, McGee K.P. (2003) Evaluation of Cardiac Valvular Disease with MR Imaging: Qualitative and Quantitative Techniques. Radiographics, 23: 5-9.
- Lung B., Gohlke-Barwolf C., Tornos P. et al. (2002) Recommendations on the management of the asymptomatic patient with valvular heart disease. Eur. Heart J., 23: 1253-1266.
- Lung B., Baron G., Butchart E. G. et al. (2003) A prospective survey of patients with valvular heart disease in Europe: the Euro heart Survey on Valvular Heart Disease. Eur. Heart J., 24: 1231-1240.
- Messika-Zeitoun D., Yiu S.F., Cormier B. et al. (2003) Sequential assessment of mitral valve area during diastole using color M-mode flow convergence analysis: new insights into mitral stenosis physiology. Eur. Heart J., 24: 1244-1253.
- Monin J.L., Dehant P., Roiron C. et al. (2005) Functional assessment of mitral regurgitation by transthoracic echocardiography using standardized imaging planes diagnostic accuracy and outcome implications. J. Amer. Coll. Cardiol., 46: 302-309.
- Monmeneu Menadas J.V., Marin Ortuno F., Reyes Gomis F. et al. (2002) Beta-blockade and exercise capacity in patients with mitral stenosis in sinus rhythm. J. Heart Valve. Dis., 11: 199-203.
- Otto C.M. (2004) Aortic stenosis: even mild disease is significant. Eur. Heart J., 25: 185-187.
- Rosenhek R., Klaar U., Schemper M. et al. (2004) Mild and moderate aortic stenosis. Natural history and risk stratification by echocardiography. Eur. Heart J., 25: 199-205.
- Tarasoutchi F., Grinberg M., Spina G.S. et al. (2003) Ten-year clinical laboratory follow-up after application of a symptom-based therapeutic strategy to patients with severe chronic aortic regurgitation of predominant rheumatic etiology. J. Am. Coll. Cardiol., 41: 1316-1324.
- Topol E.J. (Ed.) (2007) Textbook of cardiovascular medicine. 3th ed. Williams &Wilkins, Lippincott, 1628 p.
- Vahanian A., Baumgartner H., Bax J. et al. (2007) Guidelines on the management of valvular heart disease. The task force on the management of valvular heart disease of European society of cardiology. Eur. Heart J., 28: 230-268.
- Zamorano J., Cordeiro P., Sugeng L. et al. (2004) Real-time three-dimensional echocardiography for rheumatic mitral valve stenosis evaluation: an accurate and novel approach. J. Amer. Coll. Cardiol., 43: 2091-2096.
- Zoghbi W.A., Enriques-Sarano M., Foster E. et al. (2003) American Society of Echocardiography: recommendations for evaluation of the severity of native valvular regurgitation with two-dimensional and Doppler echocardiography. Eur. J. Echocardiography, 4: 237-261.