Опухоли сердца — редкие заболевания с полиморфной клинической картиной. Первое упоминание об опухоли сердца относится к 1559 г., когда M.R. Columbus при патологоанатомическом исследовании выявил новообразование в ЛЖ.
Эпидемиология
Данные по распространенности наиболее часто выявляемых первичных опухолей сердца приведены в табл. 14.1. Редкое развитие опухолей сердца объясняется особенностями метаболизма миокарда, кровотоком внутри сердца и ограниченностью лимфооттока.
Таблица 14.1
Наиболее часто выявляемые первичные опухоли сердца
| Опухоль | Распространенность,% |
| Доброкачественные: | |
| миксома | 24–50 |
| липома | 8 |
| папиллярная фиброэластома | 8 |
| рабдомиома | 7–20 |
| фиброма | 3 |
| гемангиома | 3 |
| тератома | 3 |
| мезотелиома АV-узла | 2 |
| Злокачественные: | |
| ангиосаркома | 33 |
| рабдомиосаркома | 20 |
| мезотелиома | 4 |
| фибросаркома | 10 |
| лимфома | 1 |
Классификация
Общепринятой классификации опухолей сердца не существует. Новообразования сердца подразделяют на первичные (0,1%) и вторичные (6%). Первичные опухоли подразделяют на доброкачественные (75%) и злокачественные (25%). Наиболее часто выявляемые опухоли сердца см. в табл. 14.1.
Клиническая картина
Обусловлена поражением миокарда и перикарда. При поражении миокарда часто регистрируют нарушения сердечного ритма и проводимости: синусовая тахикардия, экстрасистолическая аритмия, пароксизмальная форма фибрилляции предсердий, полная AV-блокада сердца. Поражения перикарда могут проявляться экссудативным или констриктивным перикардитом, тампонадой сердца.
Возникновение СН в большинстве случаев обусловлено как внутриполостными образованиями, вызывающими гемодинамические нарушения в связи с изменением притока крови или оттока ее из пораженных камер сердца, так и обширным неопластическим поражением самого миокарда, приводящем к нарушению насосной функции сердца.
Прижизненная диагностика опухолей сердца чрезвычайно трудна в связи с отсутствием патогномоничных признаков, а также с возможностью их бессимптомного течения.
ПЕРВИЧНЫЕ ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ
МИКСОМА СЕРДЦА
Определение
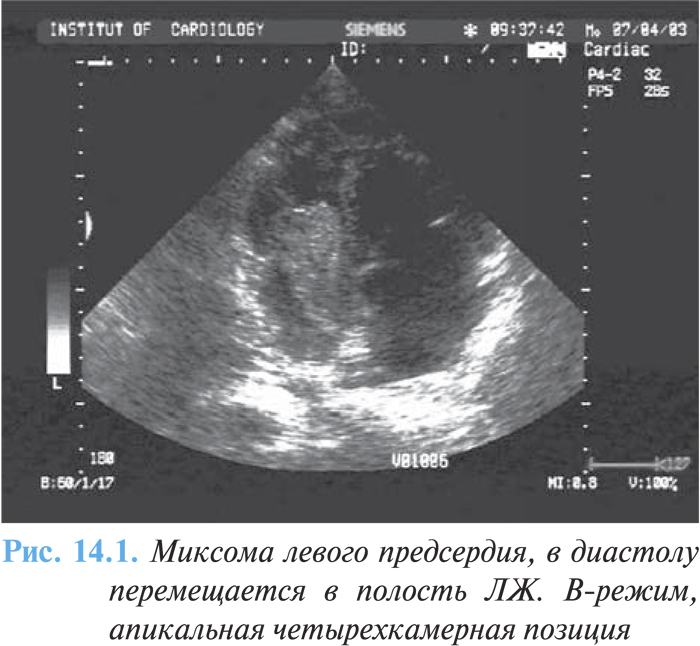
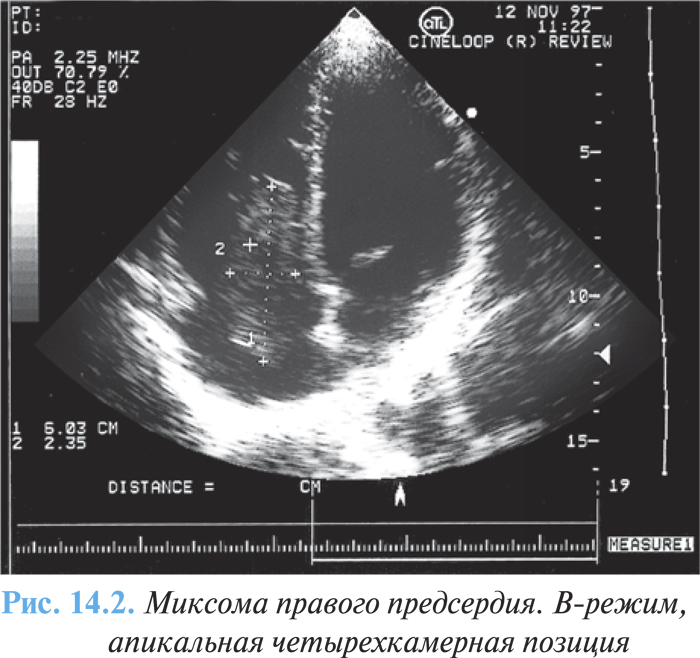
Миксома сердца — первичная внутриполостная гистологически доброкачественная опухоль, наиболее часто локализующаяся в полости левого (75%) (рис. 14.1) или правого (20%) (рис. 14.2) предсердия, крайне редко — в желудочках сердца.
Эпидемиология
Отмечают у пациентов любого возраста, наиболее часто в возрасте 30–60 лет. Результаты анализа данных 1195 больных, прооперированных по поводу миксомы, свидетельствуют, что новообразование чаще развивается у женщин (67%), чем у мужчин (33%).
Этиология
Этиология миксомы неясна. Предполагают, что клетки опухоли развиваются из эмбриональной мукоидной ткани или эндотелия с последующей миксоматозной дегенерацией. Менее 5% миксом составляют компонент миксомного комплекса — аутосомно-доминантного синдрома, известного как синдром Карни, включающего миксому сердца и внесердечные проявления: патологическую пигментацию кожи, кальцифицирующие тестикулярные опухоли, кожные миксомы, пигментную гиперплазию коркового слоя надпочечников, опухоли щитовидной железы.
Патологическая анатомия
Миксома — солитарное, реже множественное новообразование округлой или овальной формы, не распространяющееся далее субэндокардиальных слоев сердца. Макроскопически миксомы имеют две разновидности: полупрозрачная, бесцветная желатинозная по консистенции, фиксированная к стенке сердца более или менее широким основанием; или округлая плотная масса, свисающая на ножке (80%). Внешний вид опухоли напоминает полип или виноградную гроздь диаметром от 5 мм до 8–12 см с крупно- или мелкозернистой поверхностью, ее масса может достигать 250 г. Поверхность опухоли блестящая, капсула отчетливо выражена. Цвет может варьировать от зеленовато-серого до желтовато-коричневого, опухоль желеобразной или значительно реже эластической консистенции. В самой опухоли могут быть выявлены дистрофические изменения — некрозы, кровоизлияния, реже происходит обызвествление.
Гистологическое строение миксомы неоднородно. Основная субстанция (матрикс) представлена аморфным оксифильным веществом, в котором рассеяны клетки опухоли веретенообразной формы с круглым или овальным ядром, четким ядрышком, иногда образующие синцитиальные группы, формируя сигарообразные и кольцевидные структуры или тесно окружающие сосуды капиллярного типа. Опухолевые клетки по ультраструктуре напоминают эндотелиальные и могут участвовать в формировании сосудов. Гистологически часто выявляется фиброзное утолщение эндокарда, створок AV клапанов и нижней части предсердия, что обусловлено отложением фибрина на поверхности эндокарда и увеличением количества коллагеновых и эластических волокон в связи с постоянным трением тела опухоли об эндокард. При выраженном кальцинозе миксомы отмечается деструкция створок AV клапанов.
Патологическая физиология
Миксома левого предсердия суживает митральное отверстие, обусловливает обструкцию легочных вен, что приводит к легочной венозной и АГ, а также к вторичной правожелудочковой СН.
Если миксома пролабирует в ЛЖ, то в раннюю систолу она движется от желудочка к предсердию, вызывая в последнем значительное повышение давления, в раннюю диастолу опухоль «проваливается» в полость желудочка, что способствует резкому снижению внутрипредсердного давления. Если опухоль не пролабирует и препятствует прохождению крови через AV отверстие в диастолу, то гемодинамика похожа на таковую при митральном или трикуспидальном стенозе с замедленным кровотоком через отверстие в диастолу.
Опухоль правого предсердия стенозирует правое AV отверстие, может затруднять отток из полых вен, что приводит к появлению системной венозной гипертензии.
Опухоль ЛЖ суживает его выходной тракт, имитируя обструктивную кардиомиопатию. Правожелудочковая миксома может стенозировать устье легочного ствола.
Клиническая картина
При аускультации в фазу ранней или средней диастолы выслушивается низкочастотный шум, называемый опухолевым хлопком (tumor plop), который возникает вследствие резкой остановки опухоли при ударе ее о стенку желудочка или фиброзное кольцо митрального клапана в начале диастолы. Миксома правого предсердия часто манифестирует эмболией ЛА, которая может быть причиной летального исхода. При обтурации кровотока на уровне трехстворчатого клапана возможны судороги и другие расстройства функции ЦНС или внезапная смерть.
Системные проявления, отмечающиеся у 90% больных, включают уменьшение массы тела, миалгию, мышечную слабость, артралгию, лихорадку, анемию, повышение СОЭ, количества лейкоцитов и концентрации IgG. Как правило, эти симптомы исчезают после удаления опухоли.
У 50% больных вследствие фрагментации опухоли развиваются системные эмболические осложнения. Эмболия коронарных артерий может приводить к острому ИМ. Первым признаком миксомы может быть эмболия периферических сосудов. Внутричерепная аневризма вследствие эмболизации возникает редко, но является серьезным осложнением. Природа этой аневризмы неясна, однако сообщалось о гистологической верификации миксомных клеток в стенке артерии.
Выделяют основные клинические симптомы, на основании которых можно заподозрить или диагностировать миксому сердца:
- внезапное появление клинических признаков порока сердца (шумов) у больного без ревматического анамнеза, которые изменяются при перемене положения тела (вследствие смещения опухоли относительно клапана);
- быстрое развитие сердечно-сосудистой недостаточности без видимых причин, резистентной к терапии;
- небольшая длительность заболевания по сравнению с ревматическими пороками сердца, прогрессирующее течение и неожиданные «ремиссии»;
- возникновение эмболий периферических сосудов или сосудов легких на фоне синусового ритма, особенно у людей молодого возраста;
- одышка или кратковременная потеря сознания, артериальная гипотензия, тахикардия, появляющаяся внезапно без видимых причин (возникают при обтурации миксомой клапанных отверстий);
- течение заболевания под маской инфекционного эндокардита: необъяснимая лихорадка, анемия, повышение СОЭ, несмотря на лечение антибиотиками.
Диагностика
Изменения ЭКГ развиваются у 20–40% больных, они неспецифичны, включают фибрилляцию или трепетание предсердий и блокаду левой ножки пучка Гиса. Степень выраженности изменений зависит от величины стеноза, обусловленного опухолью. При миксомах предсердий отмечают признаки гипертрофии предсердий, реже желудочков.
Особенностью рентгенологической картины при миксоме левого предсердия, если нарушения гемодинамики соответствуют митральному стенозу, является отсутствие выбухания ушка левого предсердия, полость левого предсердия расширена меньше, чем при митральном стенозе. При обызвествлении миксомы на рентгенограммах виден кальциноз.
Метод эхоКГ позволяет верифицировать диагноз. Опухоль левого предсердия вызывает появление «облачка» эхо-сигнала между створками митрального клапана в диастолу желудочков, в систолу он виден в полости левого предсердия (см. рис. 14.1). При линейном сканировании на протяжении сердечного цикла можно проследить движение «облачка» из левого предсердия в ЛЖ и обратно. Опухоль искажает характер кривой движения передней створки митрального клапана, вызывая деформацию диастолического движения, и приводит к смещению этой створки к межжелудочковой перегородке (рис. 14.3).
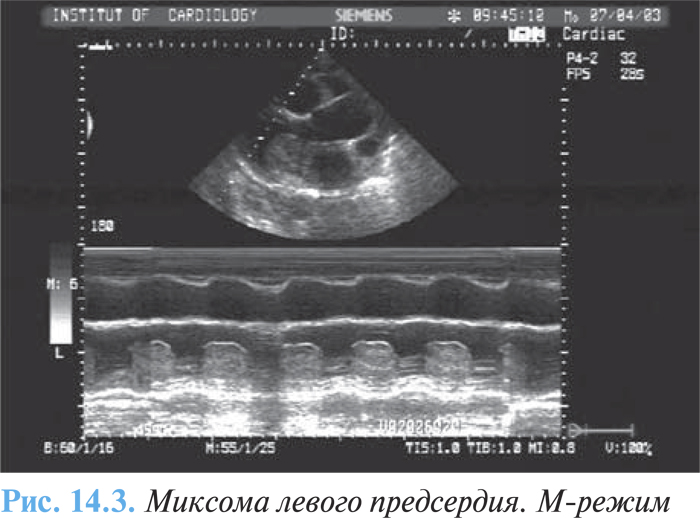
Плотная гладкая капсула миксомы дает четкие контуры отраженного эхо-сигнала, тогда как у опухолевых масс без оболочки смазанный контур. При двумерной эхоКГ миксома видна в полостях сердца в виде более светлого образования на темном фоне, движение опухоли визуализируется на протяжении всего сердечного цикла.
Ангиокардиография получила широкое распространение в диагностике миксом сердца. Характерным симптомом является стойкий дефект наполнения округлой формы с ровными и гладкими контурами, обтекаемый кровью с контрастом.
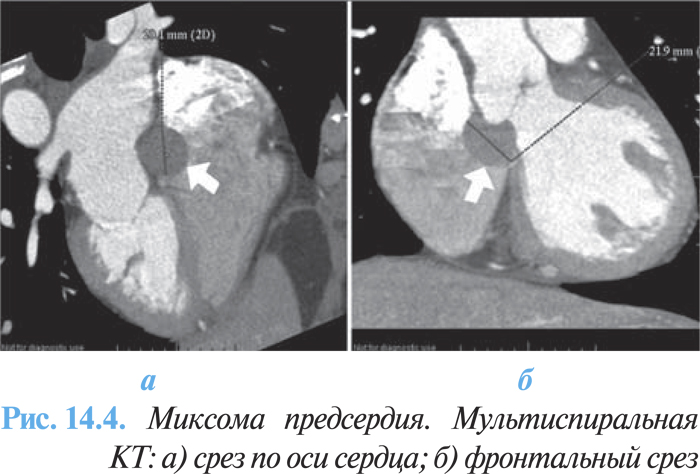
При невозможности установить точный диагноз с помощью эхоКГ проводят КТ или МРТ для определения краев опухоли и исключения опухолевой инфильтрации (рис. 14.4а, б).
Для подтверждения диагноза «миксома» необходимо гистологическое исследование всех хирургически удаленных эмболов.
Лечение
Хирургическое удаление миксомы является единственным радикальным методом лечения, отсрочку операции следует считать грубой ошибкой. У большинства оперированных пациентов наступает значительное улучшение состояния или полное выздоровление, госпитальная смертность минимальная.
Важной является идентификация близких родственников с документированным миксомным синдромом, поскольку эмболизация — основное осложнение миксом, особенно семейных опухолей.
Прогноз
Длительность заболевания миксомой различна. У больных со спорадическими опухолями благоприятный прогноз с 1% рецидивов, однако у около 10% с семейными миксомами отмечают рецидив опухоли или развитие другой опухоли иной локализации. При отсутствии лечения у 30% больных с миксомой наступает внезапная смерть, другие причины смерти — СН или эмболии.
ЛИПОМА СЕРДЦА
Определение
Липома сердца — доброкачественная опухоль, происходящая из жировой ткани, развивается в любом возрасте. Наиболее часто представляет собой солитарное образование, располагающееся в любом отделе сердца, но чаще в ЛЖ, правом предсердии или межжелудочковой перегородке.
Патологическая анатомия
Макроскопически характерна узловатая форма опухоли размером от 1 до 15 см в диаметре с четко выраженной капсулой. Масса липомы может достигать более 2 кг. Опухоль может располагаться внутримиокардиально (25%) или субэпикардиально (25%), но чаще субэндокардиально (50%). Микроскопически состоит из типичных жировых клеток и изредка содержит фиброзную ткань (фибролипома), мышечную ткань (миолипома), кровеносные сосуды. Характерны различные размеры жировых клеток и долек, наличие эмбриональных жировых клеток.
Некоторые исследователи выделяют патологию, называемую липоматозной гипертрофией межпредсердной перегородки, которая является скорее гиперплазией первичной жировой ткани, чем истинной неоплазмой. Представляет собой неинкапсулированную массу жировой ткани, расположенную под эндокардом межпредсердной перегородки. Образование имеет коричневую окраску, размеры от 1 до 8 см в диаметре, более часто расположено кпереди от овальной ямки со стороны правого предсердия, но также может распространяться на область AV-узла. Гистологически липоматозная гипертрофия межпредсердной перегородки представлена различным соотношением зрелых и эмбриональных жировых клеток, фиброзной тканью и очагами хронического воспаления, преимущественно в виде скопления лимфоцитов и плазматических клеток.
Клиническая картина
Обычно интрамуральные липомы бессимптомны, но могут быть выявлены нарушения ритма сердца, предсердно-желудочковой или внутрижелудочковой проводимости, признаки снижения сократительной способности сердца. Субэндокардиальные опухоли проявляются симптомами, соответствующими их локализации, в то время как субэпикардиальные опухоли могут вызывать сдавление сердца и выпот в перикард.
В случае образования липоматозной гипертрофии межпредсердной перегородки могут возникать нарушения ритма, застойная СН или внезапная смерть.
Прогноз
До 25% больных умирают внезапно, что связано с различными нарушениями ритма сердца.
ПАПИЛЛЯРНАЯ ФИБРОЭЛАСТОМА
Определение
Папиллярная фиброэластома — доброкачественная опухоль сердца, происходящая из эндокарда, может располагаться в любом отделе сердца, но наиболее часто поражает клапанный аппарат (рис. 14.5).
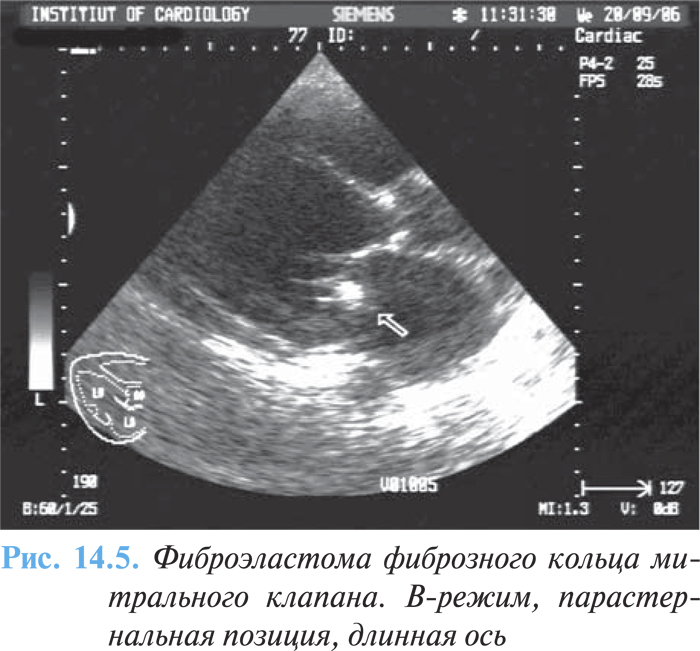
Патологическая анатомия
При микроскопическом исследовании выявляют множественные отростки к эндокарду или непосредственно к одному из клапанов сердца диаметром 3–4 см. У взрослых чаще поражается аортальный клапан. Гистологически опухоль покрыта эндотелием, который окружает центральную часть (сердцевину) опухоли, состоящую из плотной соединительной ткани, включающей матрикс из кислых мукополисахаридов, эластичные волокна и гладкомышечные клетки. Гистогенез опухоли неизвестен.
Прогноз
В большинстве случаев опухоль бессимптомна, ее случайно выявляют при аутопсии. В некоторых случаях наступает внезапная смерть.
РАБДОМИОМА СЕРДЦА
Определение
Рабдомиома — доброкачественная внутримышечная опухоль, развивается наиболее часто у детей в возрасте младше 15 лет. Рабдомиома может локализоваться в любом отделе сердца, исключая клапанный аппарат, наиболее часто — в желудочках, зачастую имеет внутриполостной характер роста.
Впервые описана F. Recklinghausen в 1862 г. В 30–50% случаев рабдомиома сопровождается туберозным склерозом коры головного мозга, а также множественными аденомами и аденофибролипомами почек и аденомами кожи.
Этиология
Этиология рабдомиомы до настоящего времени не установлена. Существуют предположения, что она происходит из миобластов или атипичных клеток Пуркинье или является признаком врожденного нарушения углеводного обмена.
Патологическая анатомия
Размеры опухоли могут варьировать от нескольких миллиметров до нескольких сантиметров. Рабдомиома имеет белесоватую или коричневатую окраску, четко отграничена от окружающих тканей, но не имеет капсулы, микроскопически состоит из клеток разнообразной формы с большим содержанием гликогена. Типичными для рабдомиомы являются паукообразные клетки с центрально расположенными круглыми ядрами и наличием в цитоплазме миофибрилл с поперечной исчерченностью (рис. 14.6).
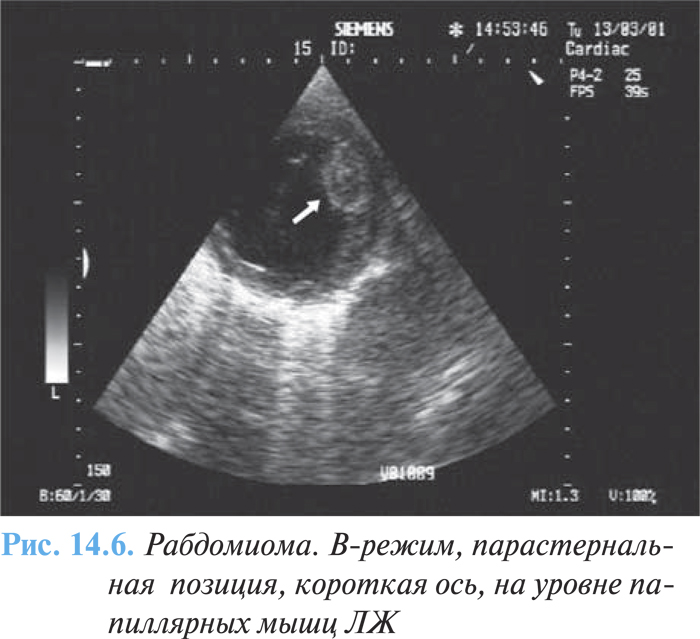
Прогноз
Прогноз неблагоприятный. Смерть чаще наступает внезапно.
ФИБРОМА СЕРДЦА
Определение
Фиброма — доброкачественная соединительнотканная опухоль, выявляемая у лиц обоего пола в любом возрасте. Фиброма может располагаться в разных отделах сердца, наиболее часто — в желудочках или межжелудочковой перегородке.
Патологическая анатомия
Как правило, представляет собой солитарное образование диаметром 3–10 см плотной консистенции серовато-белой окраски (рис. 14.7).
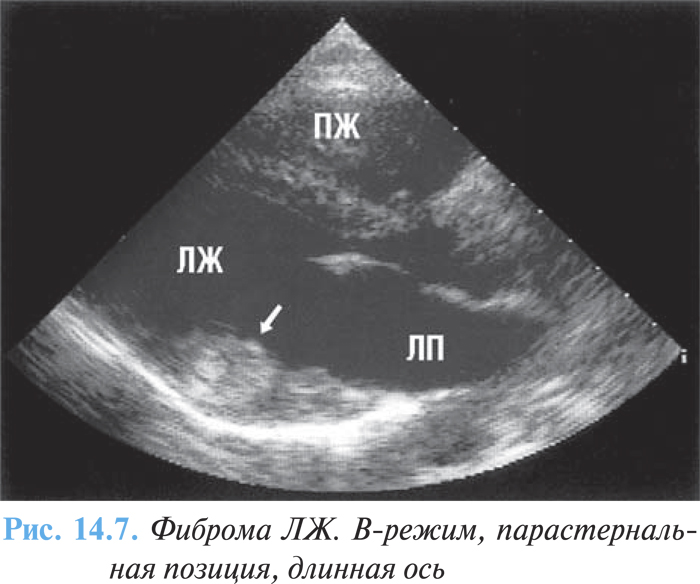
Опухоль четко отграничена от окружающих тканей, но не имеет капсулы, характеризуется инвазивным ростом. При микроскопическом исследовании центральная часть опухоли состоит из гиалинизированной фиброзной ткани с множественными очагами кальциноза и кистозной дегенерации, на периферии находятся веретенообразные клетки типа фибробластов с зернистой цитоплазмой и овальными ядрами с 1–2 ядрышками. Клетки располагаются между пучками коллагеновых волокон, имеющих различное направление.
Прогноз
При росте опухоли часто в патологический процесс вовлекается проводящая система сердца, что обусловливает высокую частоту случаев внезапной смерти.
ГЕМАНГИОМА СЕРДЦА
Определение
Гемангиома сердца — доброкачественная сосудистая опухоль, характеризующаяся внутриполостным, внутримышечным или эпикардиальным ростом. Опухоль может поражать любой отдел сердца.
Патологическая анатомия
Макроскопически гемангиома небольшого размера, имеет вид виноградной грозди или полиповидного разрастания сине-багрового цвета. На разрезе — губчатое строение.
Прогноз
Прогноз при гемангиомах не изучен, зависит от локализации и размера опухоли, в 50% случаев их выявляют случайно при аутопсии.
ТЕРАТОМА СЕРДЦА
Определение
Тератома — опухоль, содержащая элементы всех трех зародышевых листков. Внутрисердечная тератома представляет собой очень редкое заболевание, выявляют преимущественно у женщин.
Патологическая анатомия
Морфологически имеет грушевидную форму и может достигать до 15 см в диаметре. На разрезе поликистозное строение.
Прогноз
Не изучен, однако описаны возникновение рефрактерной СН и случаи внезапной смерти.
МЕЗОТЕЛИОМА AV-УЗЛА
Определение
Доброкачественная опухоль, избирательно поражающая AV-узел. Выявляют преимущественно у женщин в любом возрасте.
Патологическая анатомия
Гистогенез опухоли неясен. Макроскопически опухоль имеет вид множественных узелков, расположенных в области AV-узла, не имеет четких границ. Характерно отсутствие метастазов и прорастания опухолью трехстворчатого клапана и миокарда ПЖ.
Прогноз
Прогноз неблагоприятный, что обусловлено возникновением асистолии или фибрилляции желудочков на фоне полной поперечной блокады сердца.
ПЕРВИЧНЫЕ ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ
САРКОМА
Наиболее частой разновидностью первичных злокачественных опухолей является саркома, которая происходит из мезенхимы и поэтому может проявляться многообразием морфологических типов (см. табл. 1) и обусловливать сложность гистологической верификации. Саркома может возникнуть в любом возрасте, но наиболее часто — в 30–50 лет, одинаково часто у мужчин и женщин. Опухоль поражает преимущественно правые отделы сердца, исходя, как правило, из эндокарда или перикарда. Первичная саркома сердца может вызвать окклюзию клапанных отверстий и выходных отделов желудочков, сдавливать и прорастать коронарные сосуды, крупные артерии и вены. Отличается быстрым инвазивным ростом, прорастает все слои сердца и близлежащие органы, а также быстро и обширно метастазирует в легкие, средостение, трахеобронхиальные и ретроперитонеальные лимфатические узлы, надпочечники, мозг.
АНГИОСАРКОМА
Наиболее частая разновидность первичных злокачественных опухолей, у мужчин развивается в 2–3 раза чаще, чем у женщин. Опухоль может поражать любые отделы сердца, наиболее часто — правое предсердие.
Ангиосаркома макроскопически представляет собой плотное бугристое образование, инфильтрирующее ткани. На разрезе видны очаги некроза и кровооизлияний. Микроскопически определяются веретенообразные, полигональные или округлые клетки, образующие синцитий и складывающиеся в беспорядочно расположенные тяжи. Характерным является образование различных по размерам и форме сосудистых полостей, заполненных кровью и сообщающихся между собой. Между клетками опухоли находятся рыхлые сети аргирофильных волокон, напоминающие базальную мембрану.
РАБДОМИОСАРКОМА
Происходит из сердечной исчерченной мышечной ткани, развивается в любом возрасте, несколько чаще у мужчин.
Макроскопически рабдомиосаркома определяется как узел мягкой консистенции белого или бледно-розового цвета, расположенный в толще миокарда. На разрезе выявляют очаги кровоизлияний и некрозов. Микроскопически определяется различное соотношение мелких округлых или овальных, веретенообразных клеток. Важное диагностическое значение имеет их выраженный полиморфизм: могут напоминать теннисную ракетку, имея округлое тело с ядром и один толстый цитоплазматический отросток, или быть паукообразной формы с центрально расположенным ядром и крупными вакуолями гликогена по периферии. В цитоплазме определяют миофибриллы с поперечной исчерченностью. Клетки опухоли могут располагаться сплошными полями или формировать альвеолярные и пучковые структуры, заключенные в сеть аргирофильных и коллагеновых волокон.
ФИБРОСАРКОМА
Является мезенхимальной опухолью, возникает у лиц обоего пола в любом возрасте.
Макроскопически представляет собой четко ограниченный плотный узел белого или серовато-белого цвета либо имеет инфильтративный рост. Микроскопически выявляют фибробластоподобные клетки с различной степенью дифференцировки и коллагеновые волокна. Клетки расположены в виде переплетающихся пучков.
Другие первичные злокачественные опухоли, в том числе мезотелиома и лимфома, выявляются редко. Необходимы детальные исследования их морфологических и клинических особенностей.
Клиническая картина
Клиническая картина зависит от локализации опухоли и величины обструкции полостей сердца. Типичной является необъяснимая, быстро прогрессирующая СН с увеличением размеров сердца, выпотом в перикард (геморрагическим), тампонадой, болью в области грудной клетки, аритмиями, нарушениями проводимости, обструкцией полой вены и внезапной смертью.
Опухоли, ограниченные миокардом без распространения внутрь полости, могут некоторое время протекать бессимптомно или вызывать аритмии и нарушения проводимости.
Заподозрить наличие злокачественного новообразования можно по следующим симптомам:
- боль внутри грудной клетки является ранним и частым симптомом злокачественного поражения;
- наличие гемоперикарда при отсутствии травмы в анамнезе;
- необходимость проведения повторных перикардиоцентезов (цитологическое исследование эвакуированной жидкости обязательно);
- прогрессирование синдрома верхней полой вены при отсутствии тампонады сердца.
При распространении опухоли на перикардиальное пространство часто образуется геморрагический выпот в перикард, может возникнуть тампонада.
Саркома нередко вызывает симптомы правожелудочковой недостаточности вследствие обструкции правого предсердия, ПЖ, трехстворчатого клапана или клапана ЛА. Обструкция верхней полой вены может приводить к отеку лица и верхних конечностей, тогда как обструкция нижней полой вены вызывает застой во внутренних органах.
Диагностика
ЭхоКГ рассматривают как метод выбора в диагностике опухолей сердца, достаточный для выработки соответствующей хирургической тактики.
В последнее время все большее признание в диагностике приобретает метод КТ, отличающийся высокой чувствительностью и надежностью, позволяющий проводить топическую диагностику опухоли и определить место ее фиксации. Другим достоверным методом топической диагностики опухоли сердца является МРТ.
Лечение
Терапия злокачественных опухолей сердца чаще всего симптоматическая. Хирургическое лечение преобладающего большинства пациентов с первичными злокачественными новообразованиями сердца неэффективно в связи с тем, что к моменту диагностики отмечается значительное распространение опухоли как в пределах самого миокарда, так и на близлежащие органы и ткани. Чаще всего проводят лучевую терапию с системной химиотерапией или без нее, что позволяет временно уменьшить клиническую выраженность заболевания и в ряде случаев увеличить продолжительность жизни до 5 лет после начала лечения.
Прогноз
Прогноз неблагоприятный. При установлении диагноза «саркома сердца» у 80% больных уже имеются метастазы. Как правило, пациенты умирают в течение 6–12 мес после появления первых клинических симптомов.
ЛИТЕРАТУРА
- Кнышов Г.В., Витовский Р.М., Захарова В.П. (2005) Опухоли сердца, проблемы диагностики и хирургического лечения. Киев, 256 с.
- Коваленко В.Н., Несукай Е.Г. (2001) Некоронарогенные болезни сердца. Практ. руководство, Морион, Киев, 480 с.
- Моисеев С.В., Попова Е.Н., Фомин В.В. и др. (2005) Миксома левого предсердия и фиброзирующий альвеолит — случайное сочетание? Клин. мед., 6: 42-46.
- Оганов Р.Г., Фомина И.Г. (ред.) (2006) Болезни сердца: руководство для врачей. Литтерра, Москва, 1328 с.
- Фейгенбаум Х. (1999) Эхокардиография: Пер. с англ. под ред. В.В. Митькова. Видар, Москва, 512 с.
- Шиллер Н., Осипов М.А. (2005) Клиническая эхокардиография. 2-е изд. Практика, Москва, 344 с.
- Aoyama A., Isowa N., Chihara K. et al. (2005) Pericardial metastasis of myxoid liposarcoma causing cardiac tamponade. Jpn. J. Thorac. Cardiovasc. Surg., 53(193-195).
- Bley T.A., Zeiser R., Ghanem N.A. et al. (2005) High grade cardiac lymphoma vitality monitoring by gadolinium-enhanced magnetic resonance imaging (MRI). In Vivo, 19: 689-693.
- Burke A.P., Tazelaar H., Gomez Roman J.J. et al. (2004) Benign tumors of pluripotent mesenchyme. In: Travis W. (Ed.) Tumours of the lung, thymus, pleura and heart. Springer-Verlag, Lyon, p. 260-265.
- Burke A.P., Veinot J., Loire R. et al. (2004) Tumors of the heart: introduction. In: Travis W. (Ed.) Tumours of the lung, thymus, pleura and heart. Springer-Verlag, Lyon, p. 251-253.
- Butany J., Nair V., Naseemuddin A. et al. (2005) Cardiac tumours: diagnosis and management. Lancet Oncol., 6: 219-228.
- Galderisi M., Mondillo S. (2007) Echocardiography in clinical practice. One Way S.r.l., 120 p.
- Gowda R.M., Khan I.A. (2003) Clinical perspectives of primary cardiac lymphoma. Angiology, 54: 599-604.
- Grebenc M.L., Rosado-de-Christenson M.L., Green C.E. et al. (2002) Cardiac myxoma: imaging features in 83 patients. Radiographics, 22: 673-689.
- Ipek G., Erentug V., Bozbuga N. et al. (2005) Surgical management of cardiac myxoma. J. Card. Surg., 20: 300-304.
- Karaeren H., Ilgenli T.F., Celik T. et al. (2000) Papillary fibroelastoma of the mitral valve with systemic embolization. Echocardiography, 17: 165-167.
- Keeling I.M., Oberwalder P., Anelli-Monti M. et al. (2000) Cardiac myxomas: 24 years of experience in 49 patients. Eur. J. Cardiothorac. Surg., 22: 971-977.
- Mathur A., Airan B., Bhan A. et al. (2000) Non-myxomatous cardiac tumours: twenty-year experience. Indian Heart J., 52: 319-323.
- Mochizuki Y., Okamura Y., Iida H. et al. (1998) Interleukin-6 and «complex» cardiac myxoma. Ann. Thorac. Surg., 66: 931-933.
- Orlandi A., Ferlosio A., Angeloni C. et al. (2005) Cardiac tumours. Pathologica, 97: 115-123.
- Peters P.J., Reinhardt S. (2006) The echocardiographic evaluation of intracardiac masses: a review. J. Amer. Soc. Echocardiogr., 19: 230-240.
- Reynen K., Rein J., Wittekind C. et al. (1993) Surgical removal of a lipoma of the heart. Int. J. Cardiol., 40: 67-68.
- Shin M.S., Chung W.J., Koh K.K. et al. (2004) Protruding left atrial myxoma presented with congestive heart failure and transient ischemic attack. Clin. Cardiol., 27: 605.
- Topol E.J. (Ed.) (2007) Textbook of cardiovascular medicine. 3th ed. Lippincott Williams&Wilkins, 1628 p.
- Watson J.C., Stratakis C.A., Bryant-Greenwood P.K. et al.(2000) Neurosurgical implications of Carney complex. J. Neurosurg., 92: 413-418.
- Wiese T.H., Enzweiler C.N., Borges A.C. et al. (2001) Electron beam CT in the diagnosis of recurrent cardiac lipoma. AJR Amer. J. Roentgenol., 176: 1066-1068.
- Wilhite D.B., Quigley R.L. (2003) Occult cardiac lymphoma presenting with cardiac tamponade. Tex. Heart Inst. J., 30: 62-64.
- Yamamoto T., Nejima J., Ino T. et al. (2004) Case of massive left atrial lipoma occupying pericardial space. Jpn. Heart J., 45: 715-721.
- Yoon D.H., Roberts W. (2002) Sex distribution in cardiac myxomas. Amer. J. Cardiol., 90: 563-565.
- Yuda S., Nakatani S., Yutani C. et al. (2002) Trends in the clinical and morphological characteristics of cardiac myxoma: 20-year experience of a single tertiary referral center in Japan. Circ. J., 66: 1008-1013.