Форма выпуска
Состав и формула
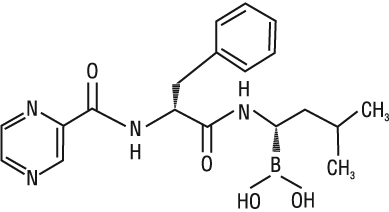
NLM: бороновая кислота, ((1R)-3-метил-1-(((2S)-1-оксо-3-фенил-2-((пиразинилкарбонил)амино)пропил)амино)бутил)-; бороновая кислота, (3-метил-1-((1-оксо-3-фенил-2-((пиразинилкарбонил)амино)пропил)амино)бутил)-, (S-(R*,S*))-; N-((1S)-1-бензил-2-(((1R)-1-(дигидроксиборанил)-3-метилбутил)амино)-2-оксоэтилпиразинкарбоксамид.
Фармакологические свойства
бортезомиб оказывает противоопухолевое действие. Обратимо ингибирует химотрипсиноподобную активность протеасомы 26S. Протеасома 26S — крупный белковый комплекс, присутствующей в ядре и цитоплазме всех эукариотических клеток. Эта протеасома — ключевой компонент, катализирующий расщепление основных белков, участвующих в управлении жизненным циклом клеток, регулирует их внутриклеточные концентрации. Кроме того, протеасомы избирательно уничтожают потенциально вредоносные аномальные или развернутые белки, которые при раке (особенно множественной миеломе) могут вырабатываться в повышенных количествах.
Так называемый убиквитин-протеасомный путь играет важную роль в регуляции уровня специфических белков, поддерживая таким образом гомеостаз внутри клеток млекопитающих. Ингибируя химотрипсиноподобное действие протеасомы 26S, бортезомиб вызывает торможение протеолиза, приводящего к сложному сигнальному каскаду внутри клетки, нарушение нормального клеточного гомеостаза и, возможно, апоптоз. Результаты экспериментов продемонстрировали, что бортезомиб цитотоксичен для большого количества типов опухолевых клеток in vitro. Он также вызывает задержку роста опухоли in vivo в неклинических моделях опухолей, включая множественную миелому.
После в/в введения дозы 1,3 мг/м2 максимальная концентрация бортезомиба составляла 509 нг/мл (109–1300 нг/мл) у пациентов со множественной миеломой и клиренсом креатинина в диапазоне 31–169 мл/мин. Период полувыведения бортезомиба после первой дозы — 9–15 ч при дозах от 1,45 до 2,0 мг/м2 у пациентов с поздними стадиями злокачественных опухолей.
Связывание с белками плазмы крови — в среднем 83% в диапазоне концентраций от 100 до 1000 нг/мл. В исследованиях in vitro с использованием микросом печени человека показано, что бортезомиб метаболизируется главным образом путем микросомального окисления с участием изоферментов CYP 3A4, CYP 2D6, CYP 2C19, CYP 2C9 и CYP 1А2 цитохрома Р450. Образующиеся метаболиты неактивны в отношении протеасомы 26S. В объединенной пробе плазмы крови, полученной через 10 и 30 мин после введения, уровень метаболитов был низким по сравнению с уровнем самого вещества. Путь элиминации бортезомиба у человека пока не охарактеризован.
Показания
бортезомиб применяется для лечения пациентов со множественной миеломой (ММ), которые ранее проходили как минимум два курса терапии и у которых болезнь прогрессировала со времени последнего курса лечения.
Применение
предназначен для в/в введения.
Рекомендуемая доза 1,3 мг/м2 в виде болюсной инъекции в течение 3–5 с 2 раза в неделю в течение 2 нед (в 1, 4, 8 и 11-й день) после 10-дневного перерыва (дни 12–21-й). Для длительной терапии — более 8 циклов — можно вводить препарат по стандартной схеме или в поддерживающем режиме — 1 раз в неделю в течение 4 нед (дни 1, 8, 15 и 22-й) после 13-дневного перерыва (дни 23–35-й). Между введением последовательных доз бортезомиба должно пройти не менее 72 ч.
Противопоказания
гиперчувствительность, в том числе к бору.
Побочные эффекты
по результатам проводившихся исследований с участием 228 пациентов со множественной миеломой, получавших бортезомиб в дозе 1,3 мг/м2 дважды в неделю в течение 2 нед с 10-дневным перерывом (продолжительность цикла лечения — 21 день) максимально в течение не более 8 циклов. Наиболее частыми побочными эффектами были астенические состояния, включая повышенную утомляемость, общую слабость, недомогание (65%), тошнота (64%), диарея (51%), снижение аппетита, включая анорексию (43%), запор (43%), тромбоцитопения (43%), периферическая нейропатия, включая периферическую сенсорную и обострение периферической нейропатии (37%), лихорадка (36%), рвота (36%), анемия (32%). По крайней мере у 14% пациентов отмечали как минимум один эпизод 4-й степени токсичности, наиболее общими среди них были тромбоцитопения (3%) и нейтропения (3%).
Наиболее общими тяжелыми побочными эффектами были лихорадка (7%), пневмония (7%), диарея (6%), рвота (5%), дегидратация (5%), тошнота (4%). Побочные эффекты, отмеченные исследователями как обусловленные приемом бортезомиба и вызвавшие прекращение терапии, были отмечены у 18% пациентов. Поводом к прекращению приема бортезомиба послужили периферическая нейропатия (5%), тромбоцитопения (4%), диарея (2%), повышенная утомляемость (2%).
Астенические состояния (повышенная утомляемость, общая слабость, недомогание). Астению отмечали у 65% пациентов в основном 1-й и 2-й степени выраженности. Первоначально повышенная утомляемость отмечалась наиболее часто в течение 1-го и 2-го циклов терапии пациентов. Прекратили лечение из-за возникновения повышенной утомляемости 2% пациентов.
Нарушения со стороны ЖКТ, отмечаемые у большинства пациентов, — тошнота, диарея, запор, рвота. Рвота и диарея были чаще всего тяжелыми. Прекратили лечение из-за расстройств со стороны ЖКТ у 5% больных. Снижение аппетита (анорексия) было отмечено как побочный эффект у 43% пациентов.
Тромбоцитопения при лечении бортезомибом определялась у 43% пациентов, она характеризовалась дозозависимым уменьшением количества тромбоцитов в период применения бортезомиба (с 1-го по 11-й день) и возвращалась к исходному уровню в период перерыва (дни с 12-го по 21-й) в каждом цикле. Количество тромбоцитов снижалось на 40% по сравнению с исходным. Значения числа тромбоцитов составляли менее 50 тыс. клеток/мкл и менее 10 тыс. клеток/мкл у 27 и 3% пациентов соответственно. Прекратили лечение из-за тромбоцитопении вне зависимости от степени ее выраженности у 4% больных.
Периферическая сенсорная нейропатия. Нейропатия, включая сенсорную и обострение периферической нейропатии, отмечалась в 37% случаев. Начальные проявления или обострение предшествующей нейропатии отмечалось на протяжении цикла лечения. Нейропатия была причиной отмены препарата в 6% случаев. У более чем 80% пациентов, участвовавших в исследовании, определялись признаки и симптомы периферической нейропатии по сравнению с исходным состоянием. Частота нейропатии составила 5% у людей без предшествующей нейропатии. Симптомы улучшались или возвращались к исходному уровню у некоторых пациентов после отмены препарата. Полную оценку зависимости развития этого вида токсичности от времени не проводили.
Лихорадка (>38 °C) отмечалась как побочный эффект у 36% пациентов.
Нейтропению определяли у 26% больных, при этом в 13% случаев она была умеренно выраженной и выраженной — в 3%. Частота фебрильной нейтропении составила <1%.
Гипотензия (включая сообщения об ортостатической гипотензии) отмечалась у 12% пациентов. Пациенты, у которых отмечалась ортостатическая гипотензия, не имели таковой в начале исследования, у половины больных была предшествующая гипертензия, у 1/3 — периферическая нейропатия. Дозы антигипертензивных препаратов могут быть скорректированы у пациентов, получающих бортезомиб. У 4% пациентов с гипотензией, включая ортостатическую, отмечались одновременно обморочные состояния.
Особые указания
бортезомиб может назначаться только врачом, имеющим опыт проведения противоопухолевой химиотерапии.
Периферическая нейропатия. При возникновении нейропатии в процессе лечения бортезомибом (см. ПОБОЧНЫЕ ДЕЙСТВИЯ), преимущественно сенсорной (хотя отмечались и другие случаи, в том числе смешанной сенсорно-моторной нейропатии), проводят поддерживающую терапию. У пациентов с предшествующими симптомами (нечувствительность, боль или жжение в руках или ногах) и/или признаками периферической нейропатии возможно обострение заболевания. Следует проводить наблюдение пациентов для своевременного выявления таких симптомов, как ощущение жжения, гиперестезия, гипестезия, парестезия, дискомфорт или нейропатическая боль. При появлении новых или усилении имеющихся симптомов нейропатии может потребоваться снижение дозы и изменение режима дозирования.
Гипотензия. Поскольку терапия бортезомибом сопровождается развитием ортостатической гипотензии, следует соблюдать осторожность при лечении пациентов, имевших в анамнезе эпизоды потери сознания, получающих гипотензивные лекарственные средства, а также у больных с обезвоживанием на фоне диареи или рвоты. При применении бортезомиба описано развитие или усиление имеющейся застойной сердечной недостаточности, к которой может предрасполагать задержка жидкости. До начала и во время каждого цикла терапии необходимо проводить анализ крови с определением лейкоцитарной формулы и количества тромбоцитов.
Тромбоцитопения обычно максимально выражена на 11-й день цикла, уровень тромбоцитов восстанавливается до исходного значения к следующему циклу. При уменьшении числа тромбоцитов менее 25 тыс./мкл терапию следует приостановить, при восстановлении — продолжить в уменьшенных дозах при тщательном сопоставлении возможной пользы и риска лечения. Имеются сообщения о гастроинтестинальных и интрацеребральных геморрагиях, ассоциированных с вызываемой бортезомибом тромбоцитопенией. Для лечения гематологической токсичности можно применять колониестимулирующие факторы, переливание тромбоцитарной и эритроцитарной массы. Для профилактики тошноты и рвоты применяют противорвотные препараты, при возникновении диареи — противодиарейные лекарственные средства, для профилактики или лечения обезвоживания — регидратационную терапию и поддержание водно-электролитного баланса. В связи с возможным развитием непроходимости кишечника следует проводить динамическое наблюдение больных с запорами. В связи с возможным развитием гиперурикемии, связанной с синдромом лизиса опухоли, во время терапии рекомендуется определять концентрацию мочевой кислоты и креатинина в сыворотке крови. Для профилактики гиперурикемии — обильное питье, при необходимости — назначение аллопуринола и подщелачивание мочи. При терапии больных с амилоидозом следует проявлять осторожность, так как неизвестно влияние угнетения активности протеасомы при заболеваниях, сопровождающихся повышением содержания белка. При работе с препаратом следует соблюдать общепринятые правила обращения с цитотоксическими препаратами.
Детский возраст: безопасность и эффективность применения у детей не установлены.
Исследование токсичности. Бортезомиб проявлял кластогенную активность (структурные хромосомные аберрации) в тесте in vitro на клетках яичника китайского хомячка. Не проявлял генотоксических свойств в тестах in vitro (тест Эймса) и in vivo (микроядерный тест у мышей). Оценка влияния бортезомиба на состояние репродуктивных тканей проведена в исследованиях общей токсичности. В 6-месячном токсикологическом исследовании у крыс определяли дегенеративные процессы в яичниках при дозах ≥0,3 мг/м2 (1/4 рекомендуемой клинической дозы) и дегенеративные изменения в яичках при дозе 1,2 мг/м2. Таким образом, бортезомиб может оказывать эффект на фертильность представителей обоих полов.
Применение в период беременности и кормления грудью. Назначать бортезомиб в период беременности можно лишь в том случае, если преимущества терапии превышают потенциальный риск для плода (адекватных и строго контролируемых исследований у беременных не проведено). Неизвестно, проникает ли бортезомиб через плаценту. В случае его применения при беременности или при планировании беременности необходимо предупредить пациентку о потенциальном риске для плода. Женщинам репродуктивного возраста во время терапии необходимо использовать эффективные методы контрацепции. Не известно, проникает ли бортезомиб в грудное молоко женщин. Поскольку многие лекарственные средства экскретируются в грудное молоко и могут оказывать серьезное неблагоприятное воздействие на детей, находящихся на грудном вскармливании, на время терапии бортезомибом необходимо прекратить кормление грудью.
Некоторые побочные эффекты (повышенная утомляемость, головокружение, ортостатическая гипотензия, нарушение зрения), могут сказаться на способности управлять автомобилем и выполнять деятельность, требующую повышенной концентрации внимания и быстроты психомоторных реакций, поэтому следует соблюдать особую осторожность.
Взаимодействия
в исследованиях in vitro на микросомах печени человека показано, что бортезомиб является субстратом для изоферментов цитохрома Р450 CYP 3A4, CYP 2D6, CYP 2C19, CYP 2C9, CYP 1A2. За состоянием пациентов, получающих одновременно бортезомиб и лекарственные средства, являющиеся ингибиторами или индукторами CYP 3A4, следует тщательно наблюдать ввиду возможности развития токсического действия или снижения эффективности терапии. Во время клинических испытаний сообщалось о гипогликемии и гипергликемии у пациентов с сахарным диабетом, принимавших пероральные гипогликемические средства. Пациентам, принимающим одновременно бортезомиб и пероральные гипогликемические лекарственные средства, может потребоваться мониторинг уровня глюкозы в крови и корректировка дозы гипогликемического средства.
Передозировка
симптомы: острое развитие симптоматической гипотензии и тромбоцитопении.
Лечение: контроль показателей гемодинамики, поддержание жизненно важных функций, симптоматическая терапия (в том числе инфузионная терапия). Специфический антидот не известен.