Ехокардіографія кардіології (5000154686)
ФІЗИЧНІ ОСНОВИ ехоКГ
Ультразвук — поширення поздовжньо- хвильових коливань у пружному середовищі з частотою >20 000 коливань за секунду. УЗ- хвиля — це поєднання послідовних стиснень і розріджень, а повний цикл хвилі становить компресію та одне розрідження. Частота УЗ- хвилі — кількість повних циклів за певний проміжок часу. За одиницю частоти УЗ- коливань прийнято герц (Гц), що становить одне коливання за секунду. У медичній практиці застосовують УЗ- коливання з частотою від 2 до 30 МГц, а відповідно в ехоКГ — від 2 до 7,5 Мгц.
Швидкість поширення ультразвуку в середовищах з різною щільністю різна; у м’яких тканинах людини досягає 1540 м/с. У клінічних дослідженнях ультразвук використовують у формі променя, що поширюється в середовищі різної акустичної щільності і при проходженні через гомогенне середовище, тобто середовище, що має однакову щільність, структуру і температуру, поширюється прямолінійно.
Просторова розрізнювана здатність УЗ- діагностичного методу визначається мінімальною відстанню між двома точковими об’єктами, при якому їх ще можна розрізнити на зображенні як окремі точки. УЗ-промінь відбивається від об’єктів, величина яких не менше ¼ довжини УЗ- хвилі. Відомо, що чим вища частота УЗ- коливань, тим зазвичай вужча ширина променя і менше його проникаюча здатність. Легені — значна перешкода на шляху поширення ультразвуку, оскільки мають найменшу із всіх тканин глибину половинного згасання. Тому трансторакальне ехоКГ (ТТ-ехоКГ)-дослідження обмежене ділянкою, де серце прилягає до передньої грудної стінки і не прикрите легенями.
Для одержання УЗ-коливань використовують датчик зі спеціальними п’єзоелектричними кристалами, що перетворюють електричні імпульси в УЗ-імпульси і навпаки. При подачі електричного імпульсу п’єзокристал змінює свою форму і розправляючись, генерує УЗ-хвилю, а відбиті УЗ-коливання, сприйняті кристалом, змінюють його форму і викликають появу на ньому електричного потенціалу. Ці процеси дозволяють одночасно використовувати УЗ-п’єзокристалічний датчик як у ролі генератора, так і приймача УЗ-хвиль. Електричні сигнали, що генеруються п’єзокристалом датчика під впливом відбитих УЗ-хвиль, потім перетворюються і візуалізуються на екрані приладу у вигляді ехограм. Як відомо, паралельні хвилі відбиваються краще і саме тому на зображенні більш чітко видно об’єкти, що перебувають у ближній зоні, де вище інтенсивність випромінювання та ймовірність поширення паралельних променів перпендикулярно до границь розподілу середовищ.
Регулювати довжину ближньої та дальної зони можна, змінюючи частоту випромінювання і радіус УЗ-датчика. На сьогодні за допомогою конвергувальних і розсіювальних електронних лінз штучно подовжують ближню зону і зменшують розбіжність УЗ-променів у дальній зоні, що дозволяє значно підвищити якість одержуваних УЗ- зображень.
В клініці для ехоКГ-дослідження використовують як механічні, так і електронні датчики. Датчики з електронно-фазовою решіткою, що мають від 32 до ≥128 п’єзоелектричних елементів, вбудованих у вигляді решітки, називають електронними. При ехоКГ-дослідженні датчик працює в так званому імпульсному режимі, при якому сумарна тривалість випромінювання УЗ-сигналу становить <1% загального часу роботи датчика. Більший час датчик сприймає відбиті УЗ-сигнали і перетворює їх в електричні імпульси, на основі яких потім будується діагностичне зображення. Знаючи швидкість проходження ультразвуку в тканинах (1540 м/с), а також час руху ультразвуку до об’єкта і назад до датчика (2 • t), розраховують відстань від датчика до об’єкта.
Відношення між відстанню до об’єкта дослідження, швидкістю поширення ультразвуку в тканинах і часом лежить в основі побудови УЗ-зображення. Відбиті від дрібного об’єкта імпульси реєструються у вигляді точки, його положення щодо датчика за часом відображається лінією розгорнення на екрані приладу. Нерухомі об’єкти будуть представлені прямою лінією, а зміна глибини положення викличе появу хвилястої лінії на екрані. Цей спосіб реєстрації ехосигналів називається одновимірною ехоКГ. При цьому на вертикальній осі на екрані ехокардіографа відображається відстань від структур серця до датчика, а на горизонтальній — шкала часу. Датчик при одновимірній ехоКГ може посилати імпульси з частотою 1000 сигналів за секунду, що забезпечує високу часову роздільну здатність М-режиму дослідження.
Наступним етапом розвитку методу ехоКГ з’явилося створення приладів для двовимірного зображення серця. При цьому сканування структур проводиться у двох напрямках — як за глибиною, так і по горизонталі в режимі реального часу. При проведенні двовимірної ехоКГ перетин досліджуваних структур відображається у межах сектора 60–90° і побудований безліччю точок, що змінюють положення на екрані залежно від зміни глибини розміщення досліджуваних структур за часом щодо УЗ-датчика. Відомо, що частота кадрів зображення при двовимірній ехоКГ на екрані ехоКГ-прилада, як правило, від 25 до 60 за секунду, що залежить від глибини сканування.
ОДНОВИМІРНА ехоКГ
Одновимірна ехоКГ — найперший в історичному плані метод УЗД серця. Головною відмінною ознакою сканування в М-режимі є високе часове розрізнення і можливість візуалізації дрібних особливостей структур серця в русі. На даний час дослідження в М-режимі залишилося вагомим доповненням до основної двовимірної ехоКГ.
Суть методу полягає в тому, що сканувальний промінь, орієнтований на серце, відбиваючись від його структур, приймається датчиком і після відповідної обробки та аналізу весь блок одержаних даних відтворюється на екрані приладу у вигляді УЗ-зображення. Таким чином, на ехограмі в М-режимі вертикальна вісь на екрані ехокардіографа відображає відстань від структур серця до датчика, а на горизонтальній осі відображається час.
Для одержання основних ехоКГ-перерізів при одновимірній ехоКГ УЗД проводять у парастернальній позиції датчика з одержанням зображення вздовж довгої осі ЛШ. Датчик розміщують у третьому або четвертому міжребер’ї на 1–3 см лівіше від парастернальної лінії (рис. 7.1).
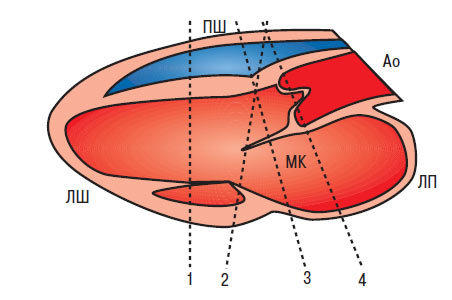
Рис. 7.1. Напрямок УЗ-променя при основних зрізах одновимірної ехоКГ. Тут і далі: Ао — аорта, ЛП — ліве передсердя, МК — мітральний клапан
При напрямку УЗ-променя вздовж лінії 1 (див. рис. 7.1) одержують можливість оцінити розміри камер, товщину стінок шлуночків, а також розрахувати показники, що характеризують скоротну здатність серця (рис. 7.2) за візуалізованою на екрані ехоКГ (рис. 7.3). Сканувальний промінь має перпендикулярно перетинати міжшлуночкову перегородку і далі проходити нижче країв мітральних стулок на рівні папілярних м’язів.

Рис. 7.2. Схема визначення розмірів камер і товщини стінок серця в М-режимі. Тут і далі: RV — ПШ; LV — ЛШ; ПП (RA) — праве передсердя; ЛП (LA) — ліве передсердя; МШП — міжшлуночкова перегородка; АК — аортальний клапан; ВТ ПШ — виносний тракт ПШ; ВТ ЛШ — виносний тракт ЛШ; dAo — діаметр аорти; КС — коронарний синус; ЗС — задня стінка (шлуночка); ПС — передня стінка; КДР— кінцево-діастолічний розмір ЛШ; КСР — кінцево-систолічний розмір ЛШ; Е — максимальне ранньодіастолічне відкриття; А — максимальне відкриття при систолі передсердь; МСС — мітрально-септальна сепарація
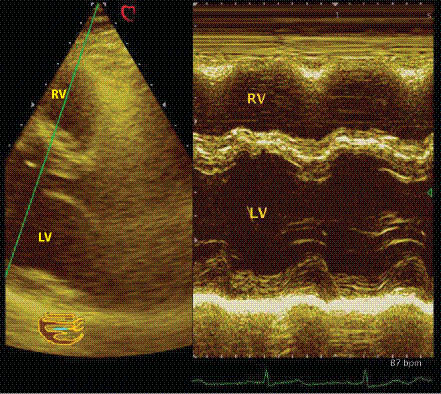
Рис. 7.3. ЕхоКГ-зображення на рівні папілярних м’язів
Орієнтуючись на отримане зображення за КДР і КСР ЛШ, розраховують його КДО і КСО, використовуючи формулу Teicholtz:
де V — об’єм ЛШ, D — передньозадній размір ЛШ.
Сучасні ехокардіографи мають можливість автоматичного розрахунку показників скоротної здатності міокарда ЛШ, серед яких слід виділити ФВ, фракційне укорочення (ФУ), швидкість циркулярного укорочення волокон міокарда (Vcf). Розрахунок вищезазначених показників проводять за формулами:
де dt — час скорочення задньої стінки ЛШ від початку систолічного підйому до вершини.
Використання М-режиму як методу визначення розмірів порожнин і товщини стінок серця обмежене через утруднення перпендикулярного сканування щодо стінок серця.
Для визначення розмірів серця найточнішим методом є секторальне сканування (рис. 7.4), методика якого описана далі.
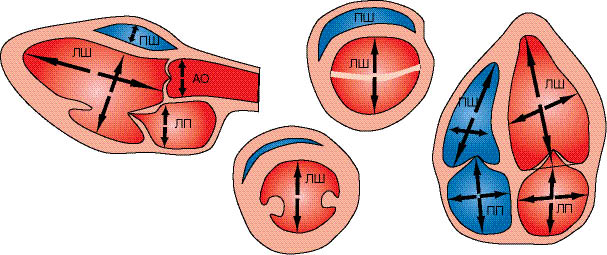
Рис. 7.4. Схема вимірювання камер серця при двовимірній ехоКГ
Нормальні значення вимірів в М-режимі у дорослих наведені у додатку 7.2.
Слід враховувати і перекручування деяких показників проведених вимірів при скануванні у М-режимі у хворих із порушенням сегментарної скоротності міокарда ЛШ.
У цієї категорії пацієнтів при розрахунку ФВ буде враховуватися переважно скоротна здатність задньої стінки ЛШ і базальних сегментів міжшлуночкової перегородки, у зв’язку з чим розрахунок глобальної скоротної функції у цих хворих проводиться іншими методами.
З аналогічною ситуацією дослідники стикаються і при розрахунку ФУ та Vcf . Виходячи з цього, показники ФВ, ФУ і Vcf у хворих із сегментарними порушеннями при проведенні одновимірної ехоКГ не використовуються.
Водночас при проведенні одновимірної ехоКГ можна виокремити ознаки, за якими можна судити про зниження скоротної здатності міокарда ЛШ. До таких ознак відносять передчасне відкриття аортального клапана, коли останній відкривається до реєстрації комплексу QRS на ЕКГ, збільшення більше ніж на 20 мм відстані від точки Е (див. рис. 7.2) до міжшлуночкової перегородки, а також передчасне закриття мітрального клапана.
Використовуючи результати вимірів у цій позиції сканувального променя при одновимірній ехоКГ, застосовуючи формулу Penn Convention, можна розрахувати масу міокарда ЛШ:
Маса міокарда ЛШ (г) = 1,04 • [(КДР + МШП + ТЗС)3 — КДР3] — 13,6,
де КДР — кінцево-діастолічний розмір ЛШ, МШП — товщина міжшлуночкової перегородки, ТЗС — товщина задньої стінки ЛШ.
При зміні кута нахилу датчика і скануванні серця вздовж лінії 2 (див. рис. 7.1) на екрані чітко візуалізуються стінки ПШ, МШП, передня та задня стулки мітрального клапана, а також задня стінка ЛШ (рис. 7.5).
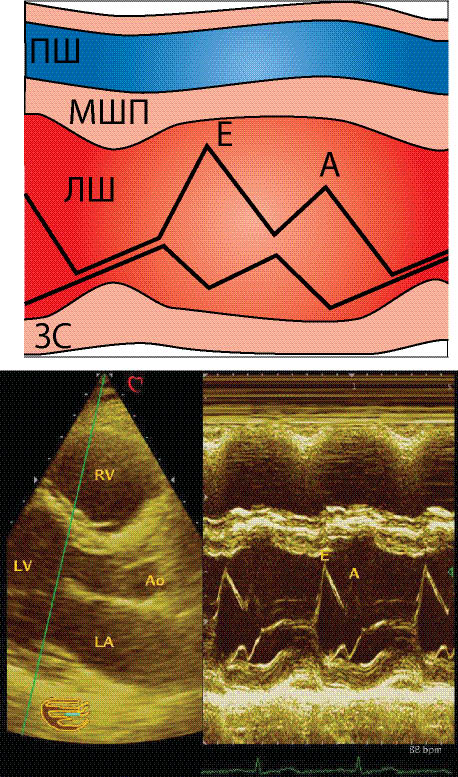
Рис. 7.5. Одновимірне ехоКГ-сканування на рівні стулок мітрального клапана
Стулки мітрального клапана в діастолу роблять характерні рухи: передня — М-подібні, а задня — W-подібні. В систолу обидві стулки мітрального клапана дають графіку косовисхідної лінії. Слід зазначити, що в нормі амплітуда руху задньої стулки мітрального клапана завжди менша, ніж передньої його стулки.
Продовжуючи змінювати кут нахилу та направивши датчик вздовж лінії 3 (див. рис. 7.1), одержуємо зображення стінки ПШ, міжшлуночкової перегородки і, на відміну від попередньої позиції, лише передню стулку мітрального клапана, що робить М-подібний рух, а також стінку лівого передсердя.
Нова зміна кута нахилу датчика вздовж лінії 4 (див. рис. 7.1) приводить до візуалізації виносного тракту, ПШ, кореня аорти і лівого передсердя (рис. 7.6).
На отриманому зображенні передня і задня стінки аорти становлять паралельні хвилясті лінії. У просвіті аорти перебувають стулки аортального клапана. В нормі стулки аортального клапана в систолу ЛШ розходяться, а в діастолу замикаються, утворюючи під час руху замкнуту криву у вигляді коробочки. Використовуючи це одновимірне зображення, визначають діаметр лівого передсердя, розмір задньої стінки лівого передсердя, а також діаметр висхідного відділу аорти.

Рис. 7.6. Одновимірне ехоКГ-сканування на рівні стулок аортального клапана
ДВОВИМІРНА ехоКГ
Двовимірна ехоКГ — основний метод УЗ- діагностики в кардіології. Датчик розміщують на передній грудній стінці в міжреберних проміжках біля лівого краю грудини або під реберною дугою, або в яремній ямці, а також у зоні верхівкового поштовху.
Основні ехоКГ-доступи
Визначено чотири основні УЗ-доступи для візуалізації серця:
- парастернальний (навкологрудинний);
- апікальний (верхівковий);
- субкостальний (підреберний);
- супрастернальний (надгрудинний).
Парастернальний доступ по довгій осі
УЗ-зріз із парастернального доступу по довгій осі ЛШ є основним, з нього починають ехоКГ-дослідження, по ньому орієнтують вісь одновимірного сканування.
Парастернальний доступ по довгій осі ЛШ дозволяє виявити патологію кореня аорти та аортального клапана, підклапанну обструкцію виходу з ЛШ, оцінити функцію ЛШ, визначити рух, амплітуду руху і товщину міжшлуночкової перегородки та задньої стінки, визначити структурні зміни або порушення функції мітрального клапана, або його підтримувальних структур, виявити розширення коронарного синуса, оцінити ліве передсердя та виявити об’ємне утворення в ньому, а також провести кількісну допплєрівськую оцінку мітральної чи аортальної недостатності й визначити м’язові дефекти міжшлуночкової перегородки колірним (або пульсовим) допплєрівським методом, а також виміряти величину систолічного градієнта тиску між камерами серця.
Для коректної візуалізації датчик розміщують перпендикулярно до передньої грудної стінки у третьому або четвертому міжребер’ї біля лівого краю грудини. Сканувальний промінь направляють по гіпотетичній лінії, що з’єднує ліву здухвинну ділянку і середину правої ключиці. Структури серця, що перебувають ближче до датчика, завжди будуть візуалізовані у верхній частині екрана. Таким чином, зверху на ехоКГ перебувають передня стінка ПШ, далі — міжшлуночкова перегородка, порожнина ЛШ з папілярними м’язами, сухожильними хордами і стулками мітрального клапана, а задня стінка ЛШ візуалізується в нижній частині ехоКГ. При цьому міжшлуночкова перегородка переходить у передню стінку аорти, а передня мітральна стулка — в задню стінку аорти. Біля кореня аорти видно рух двох стулок аортального клапана. Права коронарна стулка аортального клапана завжди верхня, а нижня стулка може бути як лівою коронарною, так і некоронарною, що залежить від площини сканування (рис. 7.7).
У нормі рух стулок аортального клапана видно нечітко, оскільки вони досить тонкі. В систолу стулки аортального клапана видно як дві паралельні прилягаючі до стінок аорти смужки, які в діастолу вдається побачити лише по центру кореня аорти в місці змикання. Нормальна візуалізація стулок аортального клапана буває при їх потовщенні або у осіб з хорошим еховікном.

Рис. 7.7. Довга вісь ЛШ, парастернальний доступ
Стулки мітрального клапана зазвичай добре візуалізуються і у діастолу роблять характерні рухи, а мітральний клапан відкривається двічі. При активному надходженні крові з передсердя ЛШ у діастолу мітральні стулки розходяться та звисають у порожнину ЛШ. Потім мітральні стулки, наближаючись до передсердя, частково закриваються після закінчення ранньодіастолічного наповнення шлуночка кров’ю, що й називають ранньодіастолічним прикриттям мітрального клапана.
У систолу лівого передсердя потік крові вдруге призводить до діастолічного відкриття мітрального клапана, амплітуда якого менша за ранньодіастолічне. В систолу шлуночків стулки мітрального клапана закриваються, і після фази ізометричного скорочення відкривається аортальний клапан.
В нормі при візуалізації ЛШ по короткій осі його стінки утворюють м’язове кільце, всі сегменти якого рівномірно потовщуються і наближаються до центру кільця в систолу шлуночка.
При парастернальному доступі по довгій осі ЛШ виглядає як рівносторонній трикутник, у якому вершина — верхівка серця, а основа — умовна лінія, що з’єднує базальні частини протилежних стінок. Скорочуючись, стінки рівномірно потовщуються і наближаються до центру.
Таким чином, парастернальне зображення ЛШ по його довгій осі дає можливість дослідникові оцінити рівномірність скорочення його стінок, міжшлуночкової перегородки і задньої стінки. Водночас при цьому УЗ-зрізі у більшості пацієнтів не вдається візуалізувати верхівку ЛШ і оцінити її скорочення.
При цьому УЗ-зрізі у передсердно-шлуночковій борозні візуалізується коронарний синус — утворення меншого, ніж низхідна аорта, діаметра. Коронарний синус збирає венозну кров від міокарда і несе її в праве передсердя, а в деяких пацієнтів коронарний синус буває значно ширшим, ніж в нормі, і його можна сплутати з низхідною аортою. Розширення коронарного синуса в більшості випадків відбувається внаслідок того, що в нього впадає додаткова ліва верхня порожниста вена, що є аномалією розвитку венозної системи.
Далі, при повороті площини сканування за годинниковою стрілкою і орієнтуванні її паралельно до лівого краю грудини низхідну аорту можна вивести позаду структур серця по довгій осі.
Щоб оцінити виносний тракт ПШ і визначити рух і стан стулок клапана ЛА, а також побачити проксимальний відділ ЛА і виміряти допплєрівські показники потоку крові через клапан ЛА, необхідно вивести клапан ЛА разом із виносним трактом ПШ і стовбуром ЛА. З цією метою з парастернального доступу, одержавши зображення ЛШ по довгій осі, датчик необхідно незначно повернути за годинниковою стрілкою і нахилити під гострим кутом до грудної клітки, направивши лінію сканування під лівий плечовий суглоб (рис. 7.8). Для кращої візуалізації часто допомагає положення пацієнта на лівому боці із затримкою дихання на видиху.
Це зображення дає можливість оцінити рух стулок клапана ЛА, які рухаються так само, як стулки аортального клапана, а в систолу повністю прилягають до стінок артерії і перестають візуалізуватися. В діастолу вони замикаються, перешкоджаючи зворотному потоку крові в ПШ. При допплєрівському дослідженні в нормі часто виявляють слабкий зворотний потік через клапан ЛА, що не характерно для нормального аортального клапана.

Рис. 7.8. Схема виносного тракту ПШ, парастернальний доступ по довгій осі. ПШ вин. тракт — виносний тракт ПШ; КЛА— клапан ЛА
Для візуалізації приносного тракту ПШ необхідно з точки візуалізації по довгій осі направити УЗ-промінь у загрудинну ділянку і трохи повернути датчик за годинниковою стрілкою (рис. 7.9).
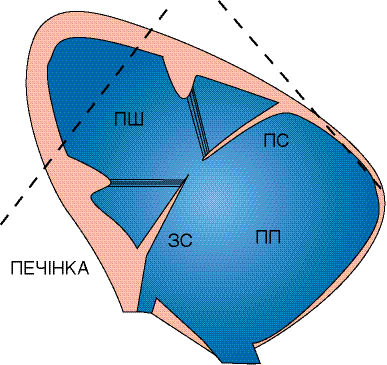
Рис. 7.9. Приносний тракт ПШ (парастернальна позиція, довга вісь). ЗС— задня стулка трикуспідального клапана; ПС — передня стулка трикуспідального клапана
При даній площині сканування досить добре визначається положення та рух стулок трикуспідального клапана, де передня стулка відносно більша і довша, ніж задня чи септальна. В нормі трикуспідальний клапан практично повторює рух мітрального клапана в діастолу.
Не змінюючи орієнтації датчика, часто вдається вивести і місце впадіння коронарного синуса в праве передсердя.
Парастернальний доступ по короткій осі
У режимі реального часу це зображення дає можливість оцінити рух стулок мітрального і трикуспідального клапанів. У нормі в діастолу вони розходяться в протилежні сторони, а в систолу рухаються в напрямку один до одного. При цьому слід звернути увагу на рівномірність циркулярної скоротності ЛШ (всі його стінки мають скорочуватися, наближаючись до центру на однакову відстань, одночасно потовщуючись), рух міжшлуночкової перегородки; ПШ, який на цьому зрізі має серповидну чи наближену до трикутної форму, а його стінка скорочується в тому ж напрямку, що й міжшлуночкова перегородка.
Для одержання зображення серця з парастернального доступу по короткій осі необхідно розміщувати датчик у третьому-четвертому міжребер’ї зліва від краю грудини під прямим кутом до передньої грудної стінки, потім повернути датчик за годинниковою стрілкою доти, поки площина сканування не розміститься перпендикулярно до довгої осі серця. Далі, нахиляючи датчик до верхівки серця, одержуємо різні зрізи по короткій осі. На першому зрізі одержуємо парастернальне зображення ЛШ по короткій осі на рівні папілярних м’язів, які виглядають, як два круглих ехогенних утворення, розміщені ближче до стінки ЛШ (рис. 7.10).
З отриманого зображення поперечного зрізу серця на рівні папілярних м’язів площину сканування слід нахилити до основи серця, щоб одержати зріз ЛШ по короткій осі на рівні мітрального клапана (рис. 7.11). Потім, нахиляючи площину сканування до основи серця, візуалізуємо УЗ-площину на рівні аортального клапана (рис. 7.12а).
У цій площині сканування корінь аорти і стулки аортального клапана перебувають в центрі зображення і в нормі при закритому положенні стулки утворюють характерну фігуру, що нагадує букву Y. Права коронарна стулка розміщена зверху. Некоронарна стулка прилягає до правого передсердя, а ліва коронарна стулка — до лівого передсердя. У систолу стулки аортального клапана відкриваються, утворюючи фігуру у вигляді трикутника (рис. 7.12б). На цьому зрізі можна оцінити рух стулок клапана ЛА та їх стан. При цьому виносний тракт ПШ розміщений попереду від кільця аорти, а початковий відділ стовбура ЛА видно на короткому протязі.

Рис. 7.10. Парастернальний доступ, зріз по короткій осі на рівні папілярних м’язів
Рис. 7.11. Парастернальний доступ, коротка вісь на рівні мітрального клапана

Рис. 7.12. Аортальний клапан (а — закриття; б — відкриття), парастернальний доступ, коротка вісь
Для виявлення вроджених аномалій аортального клапана, наприклад бікуспідального аортального клапана, що є найчастішою вродженою вадою серця, цей переріз оптимальний.
Часто при цій самій позиції датчика вдається визначити устя та основний стовбур лівої коронарної артерії, які видно на невеликому протязі сканування.
При більшому нахилі площини сканування до основи серця одержуємо зріз на рівні біфуркації ЛА, що дає можливість оцінити анатомічні особливості судини, діаметр її гілок, а також застосовується для допплєрівського вимірювання швидкості потоку крові та визначення його характеру. Використовуючи колірну допплєрографію при цій позиції сканувального променя, можна виявити в місці біфуркації ЛА турбулентний потік крові з низхідної аорти в ЛА, що є одним із діагностичних критеріїв відкритої артеріальної протоки.
Якщо максимально нахилити датчик до верхівки серця, можна одержати його зріз по короткій осі, що дає можливість оцінити синхронність скорочення всіх сегментів ЛШ, порожнина якого на даному зрізі в нормі має округлу форму.
Верхівковий доступ
Верхівковий доступ використовується насамперед для визначення рівномірності скорочення всіх стінок серця, а також руху мітрального і трикуспідального клапанів.
Крім структурної оцінки клапанів і вивчення сегментарної скоротності міокарда, при верхівкових зображеннях створюються більш сприятливі умови для допплєрівської оцінки кровотоку. Саме при такому положенні датчика потоки крові ідуть паралельно чи майже паралельно до напрямку ходу УЗ- променів, що забезпечує високу точність вимірів. Тому з використанням верхівкового доступу проводяться такі допплєрівські виміри, як визначення швидкостей кровотоку і градієнтів тиску на клапанах.
При апікальному доступі візуалізація всіх чотирьох камер серця досягається розміщенням датчика на верхівці серця і нахилом лінії сканування до одержання необхідного зображення на екрані (рис. 7.13).

Рис. 7.13. Верхівкове чотирикамерне зображення
Для досягнення найкращої візуалізації необхідно вкласти пацієнта на лівий бік, а датчик встановити в ділянці верхівкового поштовху паралельно до ребер і направити його на праву лопатку.
На сьогодні найчастіше використовується орієнтація ехоКГ-зображення таким чином, щоб верхівка серця перебувала у верхній частині екрана.
Для кращої орієнтації у візуалізованій ехоКГ необхідно враховувати, що перегородкова стулка трикуспідального клапана прикріплюється до стінки серця дещо ближче до верхівки, ніж передня стулка мітрального клапана. У порожнині ПШ при коректній візуалізації визначається модераторний тяж. На відміну від ЛШ, у ПШ більше виражена трабекулярна структура. Продовжуючи дослідження, досвідчений оператор може вивести зображення низхідного відділу аорти по короткій осі нижче лівого передсердя.
Необхідно пам’ятати, що оптимальна візуалізація будь-якої структури при УЗД досягається лише в тому випадку, коли ця структура розміщена перпендикулярно до ходу УЗ-променів, якщо ж структура розміщена паралельно, то зображення буде менш чітким, а при незначній товщині може навіть бути відсутнім. Саме тому досить часто з верхівкового доступу при чотирикамерному зображенні центральна частина міжпередсердної перегородки часто здається відсутньою. Таким чином, для виявлення дефекту міжпередсердної перегородки необхідно використати й інші доступи, і враховувати, що при верхівковому чотирикамерному зображенні найчіткіше візуалізується міжшлуночкова перегородка в її нижній частині. Зміна функціонального стану сегмента міжшлуночкової перегородки залежить від стану коронарної артерії, що її кровопостачає. Так, погіршення функції базальних сегментів міжшлуночкової перегородки залежить від стану правої чи огинаючої гілки лівої коронарної артерії, а верхівковий і середній сегменти перегородки — від передньої низхідної гілки лівої коронарної артерії. Відповідно функціональний стан бічної стінки ЛШ залежить від звуження чи оклюзії огинаючої гілки.
Для того щоб одержати верхівкове п’ ятикамерне зображення, необхідно після одержання апікального чотирикамерного зображення, нахиливши датчик до передньої черевної стінки, зорієнтувати площину ехоКГ-зрізу під праву ключицю (рис. 7.14).
При допплєр-ехоКГ верхівкове п’ятикамерне зображення використовується для розрахунку основних показників кровотоку у виносному тракті ЛШ.
Визначивши як вихідну позицію датчика чотирикамерне апікальне зображення, легко візуалізувати верхівкове двокамерне зображення. З цією метою проводять ротацію датчика проти годинникової стрілки на 90° і нахиляють латерально (рис. 7.15).
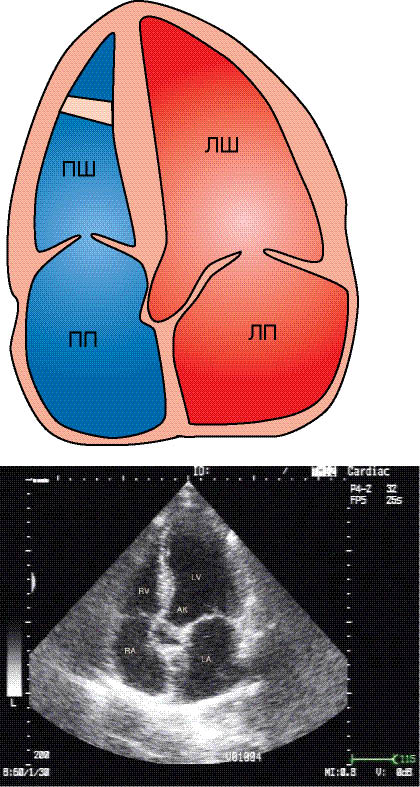
Рис. 7.14. П’ятикамерне верхівкове зображення
Рис. 7.15. Апікальна позиція, ліве двокамерне зображення
ЛШ, що перебуває вгорі, відокремлюють від передсердя обидві мітральні стулки. Стінка шлуночка, що перебуває на екрані справа, передня, а зліва — задньодіафрагмальна.
Оскільки в цій позиції досить чітко візуалізуються стінки ЛШ, ліве двокамерне зображення з апікального доступу використовується для оцінки рівномірності скорочення стінок ЛШ.
Далі, при повороті датчика проти годинникової стрілки на 30°, виводимо верхівкове зображення ЛШ по довгій осі.
При такому зображенні в динаміці можна коректно оцінити роботу мітрального і аортального клапанів.
Використовуючи «кінопетлю» у цій ехоКГ-позиції, також можна визначити сегментарну скоротність міжшлуночкової перегородки і задньобокової стінки ЛШ і виходячи з цього одночасно оцінити кровотік у огинаючій гілці лівої коронарної артерії, а також частково і правої коронарної артерії, які беруть участь у кровопостачанні задньобокової стінки ЛШ.
Субкостальний доступ
Найчастіше причиною шунтувальних потоків та їх акустичних еквівалентів є дефекти міжпередсердної перегородки. Згідно з різними статистичними даними ці вади становлять 3–21% випадків всіх вроджених вад серця. Відомо, що ця вада найчастіше розвивається в дорослій популяції.
При субкостальному чотирикамерному зображенні (рис. 7.16) положення міжпередсердної перегородки щодо ходу променів стає наближеним до перпендикулярного. Тому саме з цього доступу досягається краща візуалізація міжпередсердної перегородки та проводиться діагностика її дефектів.
Для візуалізації всіх чотирьох камер серця із субкостального доступу датчик розміщують біля мечоподібного відростка, а площину сканування орієнтують вертикально і нахиляють вгору, щоб кут між датчиком і черевною стінкою становив 30–40° (див. рис. 7.16). При цьому зрізі над серцем визначається і паренхіма печінки. Особливістю цього УЗ-зображення є те, що побачити верхівку серця неможливо.
Прямою ехоКГ-ознакою дефекту є випадіння ділянки перегородки, яка на зображенні у форматі сірої шкали представляється чорним відносно білого.
У практиці ехоКГ-дослідження найбільші труднощі виникають при діагностиці дефекту венозного синуса (sinus venosus), особливо високих дефектів, що локалізуються біля верхньої порожнистої вени.
Як відомо, існують особливості УЗ- діагностики дефекту венозного синуса, пов’язані з візуалізацією міжпередсердної перегородки. Для того щоб побачити цей сектор міжпередсердної перегородки з вихідного положення датчика (при якому отримано субкостальну візуалізацію чотирьох камер серця), необхідно повернути його за годинниковою стрілкою з орієнтацією площини сканувального променя під праве грудинно- ключичне з’ єднання. На отриманій ехоКГ добре видно перехід міжпередсердної перегородки в стінку верхньої порожнистої вени (рис. 7.17). Наступний етап обстеження пацієнта — одержання зображення як чотирьох камер серця, так і висхідної аорти при субкостальному доступі (рис. 7.18). Для цього лінію сканування датчика з вихідної точки нахиляють ще вище.
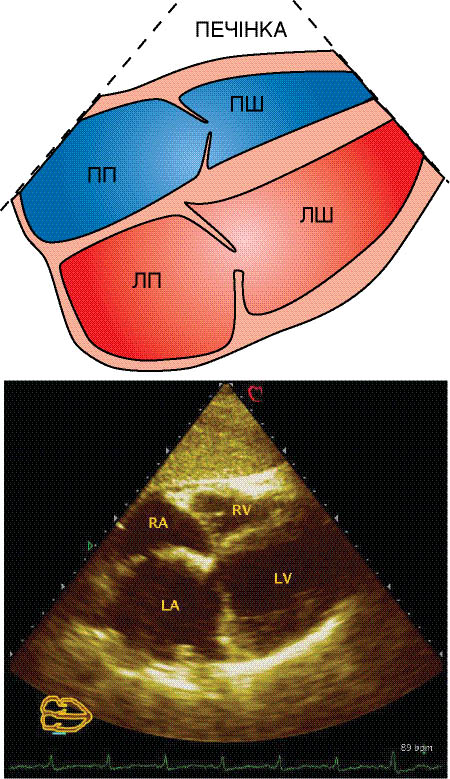
Рис. 7.16. Субкостальна позиція по довгій осі з візуалізацією чотирьох камер серця
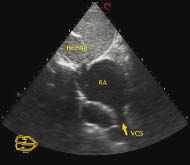
Рис. 7.17. Місце впадіння верхньої порожнистої вени у праве передсердя (субкостальна позиція)
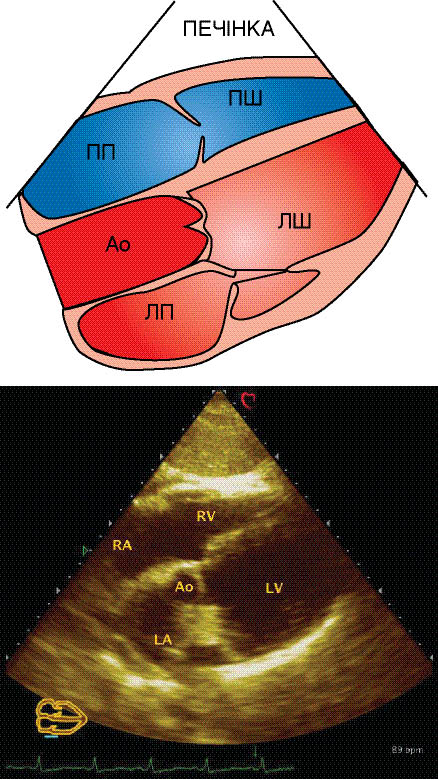
Рис. 7.18. Субкостальна позиція по довгій осі з візуалізацією чотирьох камер серця і висхідної аорти
Слід зазначити, що цей ехоКГ-зріз є найбільш коректним, що часто використовується при обстеженні хворих з емфіземою легень, а також у пацієнтів з ожирінням і вузькими міжреберними проміжками для дослідження аортального клапана.
Далі для візуалізації зображення нижньої порожнистої вени по її довгій осі з субкостального доступу датчик необхідно поставити в епігастральну ямку, а площину сканування орієнтувати сагітально по серединній лінії, трохи нахиливши вправо. При цьому нижня порожниста вена візуалізується ззаду від печінки. На вдиху нижня порожниста вена частково спадається, а на видиху, коли зростає внутрішньогрудний тиск, стає ширшою.
Візуалізація черевного відділу аорти по її довгій осі потребує орієнтації площини сканування сагітально, при цьому датчик розміщують в епігастральній ямці і злегка нахиляють вліво. В цій позиції видно характерну пульсацію аорти, а попереду від неї добре візуалізується верхня брижова артерія, що, відокремившись від аорти, відразу повертає вниз і йде паралельно до неї.
Якщо повернути площину сканування на 90°, то можна побачити перетин обох судин по короткій осі. На ехоКГ нижня порожниста вена перебуває справа від хребта і має форму наближену до трикутника, при цьому аорта розміщується зліва від хребта.
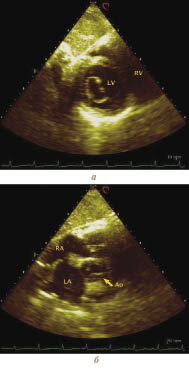
Рис. 7.19. Субкостальна позиція, коротка вісь, зріз на рівні: а) мітрального клапана; б) основи серця
Супрастернальний доступ
Супрастернальний доступ використовують в основному для обстеження висхідного відділу грудної аорти і початкової частини її низхідного відділу.
Розміщуючи датчик у яремній ямці, площину сканування направляють вниз і орієнтують по ходу дуги аорти (рис. 7.20).

Рис. 7.20. Двовимірне зображення дуги аорти по довгій осі (супрастернальний переріз)
Під горизонтальною частиною грудної аорти візуалізується переріз правої гілки ЛА по короткій осі. При цьому можна добре вивести відходження артеріальних гілок від дуги аорти: плечеголовного стовбура, лівих сонної та підключичної артерій.
У цій позиції найбільш коректно візуалізується весь висхідний відділ грудної аорти, з аортальним клапаном включно і частково ЛШ, при нахилі площини сканування дещо вперед і праворуч. З цієї вихідної точки площину сканування повертають за годинниковою стрілкою, що дає можливість одержати зображення поперечного (по короткій осі) зрізу дуги аорти.
На цій ехоКГ горизонтальний відділ дуги аорти має вигляд кільця, а справа від нього перебуває верхня порожниста вена. Далі під аортою видно праву гілку ЛА по довгій осі і ще глибше — ліве передсердя. У деяких випадках вдається побачити місце впадіння всіх чотирьох легеневих вен у ліве передсердя. Встановивши датчик у праву надключичну ямку і направивши сканувальну площину вниз, можна візуалізувати верхню порожнисту вену на всьому її протязі.
Рекомендації з проведення ехоКГ у пацієнтів із серцевою патологією відповідно до настанови з клінічного застосування ехоКГ ACC, AHA та Американського ехокардіологічного товариства (ASE) (Cheitlin M.D., 2003) наведені в табл. 7.1, 7.3–7.20.
Таблиця 7.1
Рекомендації щодо проведення ехоКГ при підозрі на захворювання грудного відділу аорти
| Клас I |
| 1. Розшарування аорти, діагностика, локалізація і поширеність 2. Аневризма аорти* 3. Інтрамуральна гематома аорти 4. Розрив аорти 5. Дилатація стовбура аорти при синдромі Марфана чи інших сполучнотканних синдромах* 6. Дегенеративна чи травматична патологія аорти з клінічною жировою емболією 7. Моніторинг розшарування аорти, особливо при підозрі на можливість ускладнень або прогресування 8. Найближчі родичі пацієнтів із синдромом Марфана чи іншими захворюваннями сполучної тканини, яким рекомендоване проведення ТТ-ехоКГ* |
| Клас IIa |
| Моніторинг пацієнтів із хірургічно усуненим розшаруванням аорти* |
*ТТ-ехоКГ має бути методом первинного вибору в таких ситуаціях, а черезстравохідну ехоКГ слід використовувати лише у тому разі, коли дослідження неповне чи необхідна додаткова інформація. Черезстравохідна ехоКГ-методика показана при дослідженні аорти, особливо у невідкладних ситуаціях.
Таким чином, використовуючи різні доступи до серця, можна одержати численні зрізи, які дають можливість оцінити анатомічну будову серця, розміри його камер і стінок, взаємне розміщення судин.
Класифікація ефективності та доцільності застосування певної процедури
- Клас I — наявність консенсусу експертів і/чи доказу ефективності, доцільності застосування та сприятливої дії процедури.
- Клас II — спірні докази та відсутність консенсусу експертів щодо ефективності й доцільності процедури:
- ІIа — «шалька терез» доказів/консенсусу експертів переважує в бік ефективності й доцільності процедури;
- ІIb — «шалька терез» доказів/консенсусу експертів переважує в бік неефективності й недоцільності застосування процедури.
- Клас III — наявність консенсусу експертів і/чи доказів щодо неефективності та недоцільності застосування процедури, а в окремих випадках навіть її шкоди.
На жаль, не завжди вдається одержати якісне зображення з різних доступів, описаних в цьому розділі, особливо якщо серце прикрите легенями, міжреберні проміжки вузькі, живіт із товстим шаром підшкірної жирової клітковини, а шия коротка й товста, саме в цих випадках проведення ехоКГ-дослідження стає складним. Проте з набуттям досвіду мультипланової черезстравохідної ехо-КГ і ці складності можуть бути подолані.
ДОППЛЄР-ехоКГ
Суть методу заснована на ефекті Допплєра і щодо ехоКГ полягає в тому, що відбитий від об’єкта, що рухається, УЗ-промінь змінює свою частоту залежно від швидкості руху об’єкта. Особливість зміщення частоти УЗ-сигналу залежить від напрямку руху об’єкта: якщо об’єкт рухається від датчика, то частота відбитого від об’єкта ультразвуку буде нижчою, ніж частота ультразвуку, надісланого датчиком. І відповідно якщо об’ єкт рухається в напрямку до датчика, то частота УЗ- сигналу у відбитому промені буде вищою, ніж вихідна.
При цьому, аналізуючи зміни частоти ультразвуку, відбитого від об’єкта, що рухається, визначають:
- швидкість об’єкта, яка тим більша, чим значніше частотне зміщення надісланого та відбитого УЗ-сигналу;
- напрямок руху об’єкта.
Зміна частоти відбитого ультразвуку залежить і від кута між напрямком руху об’єкта і напрямком сканувального УЗ-променя. Водночас частотне зміщення буде найбільшим, коли обидва напрямки збігаються. Якщо надісланий УЗ- промінь орієнтований перпендикулярно до напрямку руху об’ єкта, зміни частоти відбитого ультразвуку не відбудеться. Таким чином, для більшої точності виконуваних вимірів необхідно прагнути направляти УЗ- промінь паралельно до лінії руху об’єкта. Природно, що виконати цю умову буває складно, а іноді просто неможливо. З цієї причини сучасні ехокардіографи оснащені програмою кутової корекції, що автоматично враховує поправку на кут при розрахунку градієнта тиску, а також швидкості кровотоку.
З цією метою і використовується рівняння Допплєра, що дозволяє коректно визначати швидкість потоку крові з урахуванням поправки на кут між напрямком кровотоку і лінією випромінюваного ультразвуку:
де V — швидкість кровотоку, с — швидкість поширення ультразвуку в середовищі (постійна величина, дорівнює 1560 м/с), Δf — зміщення частоти УЗ-сигналу, f0 — вихідна частота випромінюваного ультразвуку, Θ — кут між направленням кровотоку і направленням випромінюваного ультразвуку.
При визначенні швидкості кровотоку в серці й судинах у ролі рушійного об’єкта виступають еритроцити, які рухаються як відносно УЗ- променя датчика, так і щодо відбитого сигналу. Саме тому, як видно з рівняння, коефіцієнт у чисельнику дорівнює 2, оскільки зміщення частоти УЗ- сигналу відбувається двічі.
Таким чином, частотне зміщення залежить і від частоти сигналу, що посилається: чим вона нижча, тим більші швидкості можуть бути виміряні; залежить воно і від датчика, частота якого має бути найменшою.
На сьогодні існує кілька видів допплєрівського дослідження, а саме: імпульсно-хвильова допплєр-ехоКГ (Pulsed wave Doppler), постійно-хвильова допплєр-ехоКГ (Continuous wave Doppler), тканинне допплєрівське дослідження (Doppler Tissue Imaging), енергетичне допплєрівське дослідження (Colour Doppler Energy), колірна допплєр-ехоКГ (Colour Doppler).
Імпульсно-хвильова допплєр-ехоКГ
Суть методу імпульсно-хвильової допплєр-ехоКГ полягає в тому, що в датчику використовується тільки один п’єзокристал, що служить одночасно і для генерації УЗ-хвилі, і для прийому відбитих сигналів. При цьому випромінювання йде у вигляді серії імпульсів; черговий імпульс випромінюється після реєстрації відбитих попередніх УЗ-коливань. Надіслані УЗ-імпульси, частково відбиваючись від об’єкта, швидкість руху якого вимірюється, змінюють частоту коливань і реєструються датчиком. З урахуванням відомої швидкості поширення звукової хвилі в середовищі (1540 м/с) апарат має запрограмовану можливість виборчого аналізу лише хвиль, відбитих від об’єктів, що перебувають на певній відстані від датчика у так званому контрольному чи пробному об’ємі. Застосовуючи імпульсно-хвильову допплєр-ехоКГ на великій глибині, коректно можна визначити лише кровотік, швидкість якого не перевищує 2 м/с. Водночас на менших глибинах вдається проводити досить точні виміри більш швидкісних потоків крові.
Таким чином, перевага методу імпульсно-хвильової допплєр-ехоКГ полягає в тому, що він надає можливість визначати швидкість, напрямок і характер потоку крові в конкретній зоні встановленого об’єму.
Існує пряма залежність між частотою повторення УЗ-сигналів і максимальною швидкістю потоку крові. Максимальна швидкість кровотоку, вимірювана цим методом, обмежена межею Найквіста. Це пов’язане з виникненням перекручування допплєрівського спектра при обчисленні швидкості, що перевершує межу Найквіста. У цьому разі візуалізується лише частина кривої допплєрівського спектра зі зворотного боку від лінії нульової швидкості, а інша частина спектра нівелюється на рівні швидкості, що відповідає межі Найквіста.
У зв’язку з цим для коректності проведених вимірів знижують частоту повторення випромінюваних імпульсів при дослідженні потоків крові в обстежуваній зоні, що перебуває далеко від датчика. Для виключення спотворення вимірів на спектральній допплєрівській кривій при виконанні допплєрівского дослідження імпульсною хвилею знижується значення максимальної швидкості кровотоку, яку можна визначити. На екрані ехоКГ-графік допплєрівского спектра представлений як розгорнення швидкості в часі. При цьому на графіку вище ізолінії відображений кровотік, спрямований до датчика, а нижче ізолінії — від датчика. Таким чином, сам графік складається із сукупності точок, яскравість яких прямо пропорційна кількості еритроцитів, що рухаються з певною швидкістю у цей момент часу. Зображення графіка допплєрівського спектра швидкостей при ламінарному кровотоці характеризується малою шириною, зумовленою невеликим розмахом швидкостей, і становить відносно вузьку лінію, що складається з точок, які мають приблизно однакову яскравість.
На відміну від ламінарного типу кровотоку, для турбулентного характерний більший розмах швидкостей і збільшення ширини видимого спектра, оскільки виникає в місцях прискорення потоку крові при звуженні просвіту судин. При цьому графік допплєрівського спектра складається з безлічі точок різної яскравості, що перебувають на різній відстані від базової лінії швидкості, і візуалізується на екрані у вигляді широкої лінії з розмитими контурами.
Відзначимо, що для коректної орієнтації УЗ-променя при виконанні допплєрівського дослідження в ехоКГ-апаратах передбачено звуковий режим, який забезпечується методом трансформації допплєрівських частот у звичайні звукові сигнали. Для оцінки швидкості та характеру кровотоку через мітральний і трикуспідальний клапани методом імпульсно-хвильового допплєр-ехоКГ датчик орієнтують так, щоб одержати верхівкове зображення з розміщенням контрольного об’єму на рівні стулок клапанів із невеликим зміщенням до верхівки від фіброзного кільця (рис. 7.21).

Рис. 7.21. Імпульсно-хвильова допплєр-ехоКГ (мітральний кровотік)
Дослідження кровотоку через мітральний клапан при імпульсно-хвильовій допплєр-ехоКГ проводять, використовуючи не лише чотири-, але й двокамерні апікальні зображення. Розмістивши контрольний об’єм на рівні стулок мітрального клапана, визначають максимальну швидкість трансмітрального кровотоку. В нормі діастолічний мітральний кровотік є ламінарним, а спектр кривої мітрального кровотоку розміщений вище базової лінії й має дві швидкісні вершини. Перший пік в нормі вищий і відповідає фазі швидкого наповнення ЛШ, а другий пік швидкості менший першого і є відображенням кровотоку при скороченні лівого передсердя. Максимальна швидкість трансмітрального кровотоку в нормі перебуває в межах 0,9–1,0 м/с. При дослідженні кровотоку в аорті при верхівковій позиції датчика, на нормальному графіку швидкості потоку крові спектр кривої аортального кровотоку перебуває нижче ізолінії, оскільки кровотік спрямований від датчика. Максимальна швидкість відзначається на рівні аортального клапана, оскільки це найвужче місце.
Якщо під час допплєрівського дослідження пульсовою хвилею виявлено високошвидкісний кровотік при мітральній регургітації, то коректне визначення швидкості кровотоку стає неможливим через межу Найквіста. У цьому разі для точного визначення потоків із високою швидкістю використовують постійно-хвильову допплєр-ехоКГ.
Постійно-хвильова допплєр-ехоКГ
При допплєрівському дослідженні постійною хвилею один або кілька п’єзоелектричних елементів безперервно випромінюють УЗ-хвилі, а інші п’єзоелементи безперервно приймають відбиті УЗ-сигнали. Основна перевага методу — можливість дослідження високошвидкісного кровотоку по всій глибині дослідження на шляху сканувального променя без спотворення допплєрівського спектра. Проте недоліком цього допплєрівського дослідження є неможливість просторової локалізації за глибиною місця кровотоку.
При постійно-хвильовій допплєр-ехоКГ використовують два типи датчиків. Застосування одного з них дає можливість одночасно візуалізувати двовимірне зображення в режимі реального часу і досліджувати кровотік, направивши УЗ-промінь у місце діагностичного інтересу. На жаль, ці датчики у зв’язку з їх досить великими розмірами незручно використовувати у пацієнтів з вузькими міжреберними проміжками і складно орієнтувати УЗ-промінь максимально паралельно до кровотоку. При використанні датчика з маленькою поверхнею з’являється можливість досягти хорошої якості допплєрівського обстеження постійною хвилею, але без одержання двовимірного зображення, що може створити труднощі для дослідника при орієнтації сканувального променя.
Для забезпечення точної спрямованості УЗ- променя необхідно запам’ятати місце розташування двовимірного датчика перед перемиканням на датчик пальчикового типу. Також важливо знати відмінні риси графіки потоку при різній патології. Зокрема, потік трикуспідальної регургітації, на відміну від мітральної, прискорюється при вдиху і має більш тривалий час напівзниження тиску. При цьому слід не забувати використовувати різні доступи. Дослідження кровотоку при аортальному стенозі проводять як при апікальному, так і при супрастернальному доступі.
Отримана інформація надається в акустичному та графічному вигляді, при якому відображається розгорнення швидкості потоку в часі.
На рис. 7.22 наведене апікальне зображення ЛШ по довгій осі, де спрямованість УЗ-хвилі у просвіт аортального клапана відображена у вигляді суцільної лінії. Графік швидкостей кровотоку становить криву з повністю заповненим просвітом під рамкою і відображає всі швидкості, що визначаються за ходом УЗ- променя. Максимальна швидкість реєструється за чітким краєм параболи й відображає швидкість кровотоку в отворі аортального клапана. При нормальному кровотоці спектр кривої перебуває під базовою лінією, оскільки потік крові через аортальний клапан спрямований від датчика.
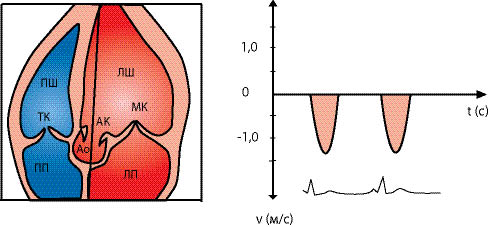
Рис. 7.22. Вимірювання аортального потоку при постійно-хвильовій допплєр-ехоКГ
Відомо, що чим більша різниця тиску вище й нижче місця звуження, тим більша швидкість в ділянці стенозу і навпаки; виходячи з цього, можна визначити градієнт тиску. Ця закономірність використовується для розрахунку градієнта тиску за швидкістю кровотоку в місці стенозування. Дані розрахунки проводять за формулою Бернуллі:
∆Р = 4 · V2,
де ∆Р — градієнт тиску, V — максимальна швидкість потоку (м/с).
Таким чином, визначивши максимальну швидкість і розрахувавши максимальний систолічний градієнт тиску між шлуночком і відповідною судиною, можна оцінити тяжкість аортального стенозу і стенозу клапана ЛА.
У разі визначення тяжкості мітрального стенозу користуються середнім діастолічним градієнтом тиску на мітральному клапані.
Цей градієнт розраховують за середньою швидкістю діастолічного кровотоку через мітральний отвір. Сучасні ехокардіографи устатковані програмами автоматичного розрахунку середньої швидкості діастолічного кровотоку та градієнта тиску. Для цього просто необхідно обвести спектр кривої трансмітрального кровотоку.
Для хворих із дефектом міжшлуночкової перегородки величина градієнта систолічного тиску між ЛШ і ПШ має велике прогностичне значення. При розрахунку цього градієнта систолічного тиску визначають швидкість кровотоку через дефект з однієї камери серця в іншу. З цією метою допплєрівське дослідження постійною хвилею проводять при орієнтації датчика таким чином, щоб УЗ- промінь проходив через дефект за можливістю максимально паралельно кровотоку.
Таким чином, постійно-хвильову допплєр-ехоКГ ефективно застосовують для визначення високих миттєвих швидкостей кровотоку. Крім того, метод широко використовується для визначення значень інтеграла швидкість/час, а також максимальної швидкості кровотоку, обчислення градієнта тиску і часу зниження градієнта тиску вдвічі. За допомогою допплєрівського дослідження постійною хвилею проводять виміри градієнта тиску в ЛА, обчислення параметра dp/dt обох шлуночків серця і виміри динамічного градієнта тиску при обструкції виносного тракту ЛШ.
Колірна допплєр-ехоКГ
Метод колірної допплєр-ехоКГ дає можливість автоматично визначати характер і швидкість кровотоку одночасно у великій кількості точок у межах заданого сектора, а інформація подається у вигляді кольору, який накладається на основне двовимірне зображення. Кожна точка кодується певними кольорами залежно від того, в якому напрямку і з якою швидкістю в ній відбувається рух еритроцитів. При розміщенні точок досить щільно і проведені оцінки в режимі реального часу можна одержати зображення, яке сприймається як рух кольорових потоків через серце і судини.
Принцип колірного допплєрівського картування по суті не відрізняється від імпульсно-хвильового допплєр-ехоКГ. Відмінність полягає лише в режимі подання отриманої інформації. При допплєрівському дослідженні імпульсною хвилею проводиться переміщення контрольного об’єму по двовимірному зображенню в ділянках, що становлять інтерес для визначення кровотоку, а отримана інформація відображається у вигляді графіка швидкостей кровотоку. Різними відтінками червоного і синього кольорів зазвичай відображають спрямованість кровотоку, а також середню швидкість і наявність перекручування допплєрівського спектра.
Напрямок потоку в одному напрямі може подаватися в червоно-жовтому, а в іншому — синьо-блакитному колірному спектрі. Враховуються лише два основні напрямки: до датчика й від датчика. Зазвичай потоки крові, спрямовані до датчика, на ехоКГ зображуються червоним кольором, а спрямовані від датчика — синім (рис. 7.23).

а

б
Рис. 7.23. Колірна допплєр-ехоКГ, верхівковий доступ: а) діастола; б) систола
Швидкість кровотоку диференціюється за яскравістю колірної гами на одержаному зображенні. Чим яскравіші кольори, тим вища швидкість потоку. Якщо швидкість дорівнює нулю і кровотік відсутній, на екрані візуалізуються чорні кольори.
У всіх сучасних ехокардіографах на екрані приводиться колірна шкала, що відображає відповідність напрямку й швидкості кровотоку тому або іншому колірному спектру.
При турбулентних потоках до основних кольорів — червоного і синього — зазвичай додаються відтінки зеленого, що при колірному картуванні проявляється мозаїчністю фарбування. Такі відтінки з’являються при реєстрації регургітації чи потоків стенозованих просвітів. Як і будь-який метод, колірна допплєр-ехоКГ має свої недоліки, основними з яких є відносно низька часова розрізнювальна здатність, а також неможливість відображення високошвидкісних потоків крові без спотворень. Останній недолік пов’язаний з явищем перекиду, що проявляється в тому разі, коли швидкість кровотоку, що визначається, перевищує обмеження Найквіста і візуалізується на екрані через білий колір. Необхідно відзначити, що при використанні режиму колірного картування якість двовимірного зображення нерідко погіршується.
При дослідженні різних відділів аорти можна візуалізувати зміну напрямку потоків відносно сканувального променя датчика. По відношенню до УЗ-променя у висхідному відділі аорти потік крові йде в зустрічному напрямку і відображається відтінками червоного кольору. У низхідному відділі аорти відзначається протилежна спрямованість кровотоку (від сканувального променя), що відповідно візуалізується відтінками синього кольору. Якщо кровотік буде мати напрямок, перпендикулярний до УЗ-променя, то вектор швидкості при проектуванні на напрямок сканування дає нульове значення. Ця ділянка відображається у вигляді смужки чорного кольору, яка розділяє червоний і синій кольори, і вказує на швидкість, що дорівнює нулю. Таким чином, для коректного сприйняття колірної гами, що відображається, необхідно чітко уявляти спрямованість потоків відносно сканувального УЗ-променя.
Тканинний допплєр
Суть методу полягає в дослідженні руху міокарда за допомогою модифікованої обробки допплєрівського сигналу. Об’єкт дослідження — стінки міокарда, що рухаються і дають кодоване кольором зображення залежно від спрямованості їх руху, аналогічно допплєрівському дослідженню потоків. Рух досліджуваних структур серця від датчика відображається відтінками блакитного кольору, а до датчика — відтінками червоного. Зображення міокарда методом допплєр-ехоКГ у клінічній практиці можна використати для оцінки функції міокарда, аналізу порушення регіонарної скоротності міокарда (завдяки можливості одночасної реєстрації середньої швидкості руху всіх стінок ЛШ), кількісної оцінки систолічного і діастолічного руху міокарда, візуалізації інших рухомих тканинних структур серця.
Енергетичне допплєрівське дослідження
Використовуючи оригінальну методику при енергетичному допплєрівському дослідженні, вдається оцінити інтенсивність потоку завдяки аналізу відбитого УЗ-сигналу від еритроцитів, які рухаються. Інформація відображається в кольорі, ніби накладаючись на чорно-біле двовимірне зображення обстежуваного органа, визначаючи судинне русло. Цей спосіб допплєрівського обстеження активно ввійшов у клінічну медицину і досить широко застосовується для оцінки кровонаповнення органів і ступеня їх перфузії. Діагностичні можливості цього методу проявилися в дослідженні судинного русла при тромбозі глибоких вен гомілки і нижньої порожнистої вени, диференціації оклюзії внутрішньої сонної артерії від стенозу зі слабким кровотоком, виявленні ходу хребетних артерій, зображенні судин з вираженою звивистістю, контуруванні бляшок, що звужують просвіт судин, а також транскраніальному зображенні судин головного мозку.
Колірний М-режим
При методиці колірного М-режиму на екрані ехокардіографа візуалізується зображення, що відповідає стандартному М-режиму з відображенням швидкості і напрямку кровотоку, як при колірній допплєр-ехоКГ. Колірне подання потоків крові знайшло застосування при оцінці діастолічного розслаблення міокарда, а також для визначення локалізації та тривалості турбулентних потоків.
ЧЕРЕЗСТРАВОХІДНА ехоКГ
Черезстравохідна ехоКГ — ехоКГ- і допплєр-ехоКГ-дослідження серця за допомогою ендоскопічного зонда із вбудованим УЗ-датчиком.
Стравохід безпосередньо прилягає до лівого передсердя, розміщеного спереду від нього, а низхідна аорта — ззаду. В результаті відстань від апертури черезстравохідного датчика до структур серця становить кілька сантиметрів і навіть менше, в той час як у ТТ-датчика може досягати багатьох сантиметрів. Це один із визначальних факторів одержання високоякісного зображення. За даними спеціальної групи ACC/AHA більше ніж у половині випадків черезстравохідна ехоКГ дає нову чи додаткову інформацію про структуру й функцію серця, уточнює прогноз і тактику лікування. Також надає негайні результати в масштабі реального часу щодо ефективності реконструктивних операцій, протезуванні клапанів відразу після припинення штучного кровообігу. Зображення, отримане через стравохід, дозволяє перебороти обмеження, типові для стандартної ТТ-ехоКГ, пов’язані з екстракардіальними факторами: 1) респіраторні артефакти — ХОХЛ (в тому числі емфізема), гіпервентиляція; 2) ожиріння, наявність вираженого шару підшкірно-жирової клітковини; 3) виражений реберний каркас грудної клітки; 4) розвинені молочні залози; а також з кардіальними факторами: 1) акустична тінь протеза серцевого клапана; 2) кальциноз клапана; 3) малі розміри об’ємних утворень. Метод забезпечує практично абсолютне, рівномірне акустичне вікно хорошої якості. Використання високочастотних датчиків (5–7 МГц) дозволяє на порядок поліпшити просторову розрізнювальну здатність в аксіальному та латеральному напрямках. Це ще один визначальний фактор одержання високоякісного зображення, недоступного при проведенні стандартної ехоКГ. За допомогою цього методу можуть бути досліджені структури, недоступні при стандартній ехоКГ: верхня порожниста вена, вушка передсердь, легеневі вени, проксимальні частини коронарних артерій, синуси Вальсальви, грудна аорта. Відкрито нові можливості в дослідженні правого серця. Виявлено унікальні можливості черезстравохідної ехоКГ у пацієнтів, які перебувають у критичному стані, при внутрішньоопераційному моніторингу функції шлуночка, якщо потрібна діагностика гіповолемії, систолічної дисфункції шлуночка, транзиторної ішемії, ІМ. Метод високоефективний для диференційної діагностики об’ємних і умовно прийнятих за об’ємні утворень серця: пухлин, тромбів, провісників системної тромбоемболії: спонтанного ехоКГ-контрастування порожнини, ниток фібрину; вегетацій малих розмірів, ниток шва протеза клапана, несправжніх хорд шлуночка, міксоматозної дегенерації мітрального клапана. Метод черезстравохідної ехоКГ порівнювали з іншими методами, в тому числі з тими, що розглядаються як стандартні, включаючи стандартну двовимірну ехоКГ (Коваленко В.Н. и соавт., 2003).
Протокол дослідження визначається конкретною клінічною ситуацією, черезгрудинна ехоКГ завжди передує черезстравохідному ехоКГ-дослідженню.
Показання до проведення черезстравохідної ехоКГ
1. Субоптимальна стандартна ТТ-ехоКГ.
2. Виявлення коронарної артерії, що обумовила інфаркт.
3. Оцінка ефективності реконструктивних операцій, протезування клапанів, трансплантованого серця, спроможність аорто-коронарних мамарно-коронарних шунтів відразу після виходу зі штучного кровообігу. Оцінка стентування коронарної артерії.
4. Внутрішньоопераційний моніторинг загальної та локальної функції шлуночка; діагностика ішемії, ІМ; диференціація стану гіповолемія/систолічна дисфункція шлуночка.
5. Точна діагностика значимості стенотичних і регургітуючих потоків при вадах серця.
6. Патологічні стани аорти, включаючи розшаровувальну аневризму, коарктацію аорти.
7. Необхідність проведення диференційного діагнозу об’ємних та умовно прийнятих за об’ємні утворень серця:
7.1. Пухлина.
7.2. Тромб.
7.3. Вегетація (інфекційний ендокардит).
7.4. Абсцес кільця клапана.
7.5. Аневризматичне розширення коронарної артерії.
7.6. Аневризма перегородки передсердь, її ліпоматоз.
7.7. Міксоматозна дегенерація парусів мітрального клапана.
7.8. Псевдохорда шлуночка.
7.9. Сітка Хіарі.
7.10. Нитки шва протеза клапана.
7.11. Спонтанне ехоКГ-контрастування порожнини передсердя (провісник тромбоемболії).
7.12. Нитки фібрину (провісник тромбоемболії).
7.13. Мікропухирці.
8. Оцінка інфекційних ускладнень, пов’язаних із встановленими катетерами та електродами, включаючи електрод пейсмекера.
9. Діагностика септальних дефектів, включаючи малі комунікації.
10. Наявність рецидивних ПШ-ритмів (підозра на аритмогенну дисплазію ПШ серця).
11. Прогнозоване джерело системної тромбоемболії в передсердях або вушку передсердя, нижній порожнистій вені.
12. Виявлення парадоксальної повітряної емболії у пацієнтів при нейрохірургічних процедурах, лапароскопії, цервікальній ламінектомії.
13. ТЕЛА.
14. Контроль ефективності перикардіоцентезу, ендоміокардіальної біопсії.
15. Відбір донорів для трансплантації серця.
Ускладнення процедури черезстравохідної ехоКГ
Тяжкі
1. Перфорація стравоходу.
2. Минущий параліч голосових зв’язок.
3. Травма ротової порожнини.
4. Кровотеча з варикозно розширених вен стравоходу чи внаслідок фрагментації пухлини, розміщеної внутрішньостравохідно.
5. Фібриляція шлуночків, інші шлуночкові ритми.
6. Ларингоспазм.
7. Бронхоспазм.
8. Тонічні, клонічні судоми.
9. Ішемія міокарда.
Легкі
1. Транзиторна гіпо- та гіпертензія.
2. Блювання.
3. Суправентрикулярні порушення ритму.
4. Стенокардія.
5. Гіпоксемія.
Основні площини сканування
Методика черезстравохідної ехоКГ становить собою план дослідження, розділений на три етапи. Базальне, чотирикамерне і трансгастральне сканування можливе на різних пунктах локалізації кінця ендоскопа щодо відстані від передніх зубів пацієнта (рис. 7.24).
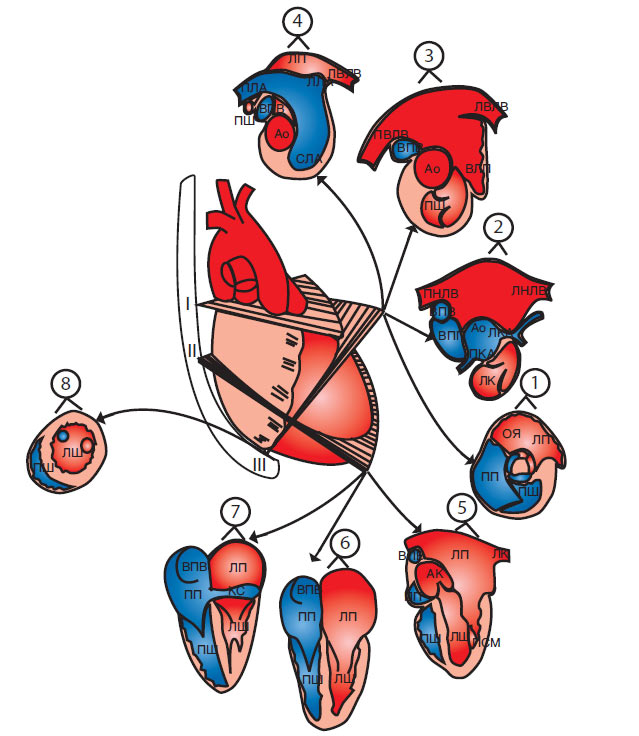
Рис. 7.24. Діаграма переходу від первинних площин сканування до результуючих: з 1 по 8. Базальні перетини по короткій осі: 1 — корінь аорти; 2 — коронарні артерії; 3 — вушко лівого передсердя; 4 — біфуркація стовбура ЛА. Чотирикамерні перетини: 5 — тракт відтоку ЛШ; 6 — чотирикамерний вигляд; 7 — коронарний синус. Черезгастральні перетини по короткій осі: 8 — вигляд шлуночків у перетині сосочкових м’язів. ПСМ — передньолатеральний сосочковий м’яз; ЗСМ — задньомедіальний сосочковий м’яз; Ао — аорта; АК — клапан аорти; КС — коронарний синус; ОЯ — овальна ямка; НПВ — нижня порожниста вена; ВПВ — верхня порожниста вена; L — ліва коронарна заслонка; R — права коронарна заслонка; N — некоронарна заслонка; ЛКА — ліва коронарна (вінцева) артерія; ПКА — права коронарна (вінцева) артерія; ЛП — ліве передсердя; ВЛП — вушко лівого передсердя; ПП — праве передсердя; ВПП — вушко правого предсердя; СЛА — стовбур ЛА; ЛЛА — ліва ЛА; ПЛА — права ЛА; ЛВЛВ — ліва верхня легенева вена; ЛНЛВ — ліва нижня легенева вена; ЛК — легеневий клапан; ПВЛВ — права верхня легенева вена; ПНЛВ — права нижня легенева вена. I — базальні короткоосьові площини сканування BASAL SHORT AXIS; II — чотирикамерні площини сканування; III — черезшлуночкові площини по короткій осі
Потім переходять від загального плану дослідження до окремого, з одержанням стандартних результуючих площин сканування. Скануванням по базальній короткій осі одержують, принаймні, чотири стандартні види: з 1 по 4 (див. рис. 7.24). У чотирикамерному перерізі — три види: з 5 по 7, що приблизно відповідає стандартним ТТ-двовимірним ехоКГ-видам по довгій осі. При переміщенні кінця ендоскопа у фундальну частину шлунка (трансгастральне сканування по короткій осі) одержують переріз шлуночків на рівні середніх відділів сосочкових м’язів ЛШ (див. рис. 7.24, вид 8), де проводиться аналіз локальної функції сегментів стінок шлуночка, моніторинг його загальної функції.
Рівень посилення сигналу первинно встановлюють до одержання артефактів — тобто високо з метою визначення справжніх контурів ендокарда.
Нахиляючи кінець ендоскопа вгору чи дещо його витягаючи, одержують послідовне сканування структур по базальній короткій осі (див. рис. 7.24, вид 1).
В результаті кінець ендоскопа розміщується відразу позаду лівого передсердя.
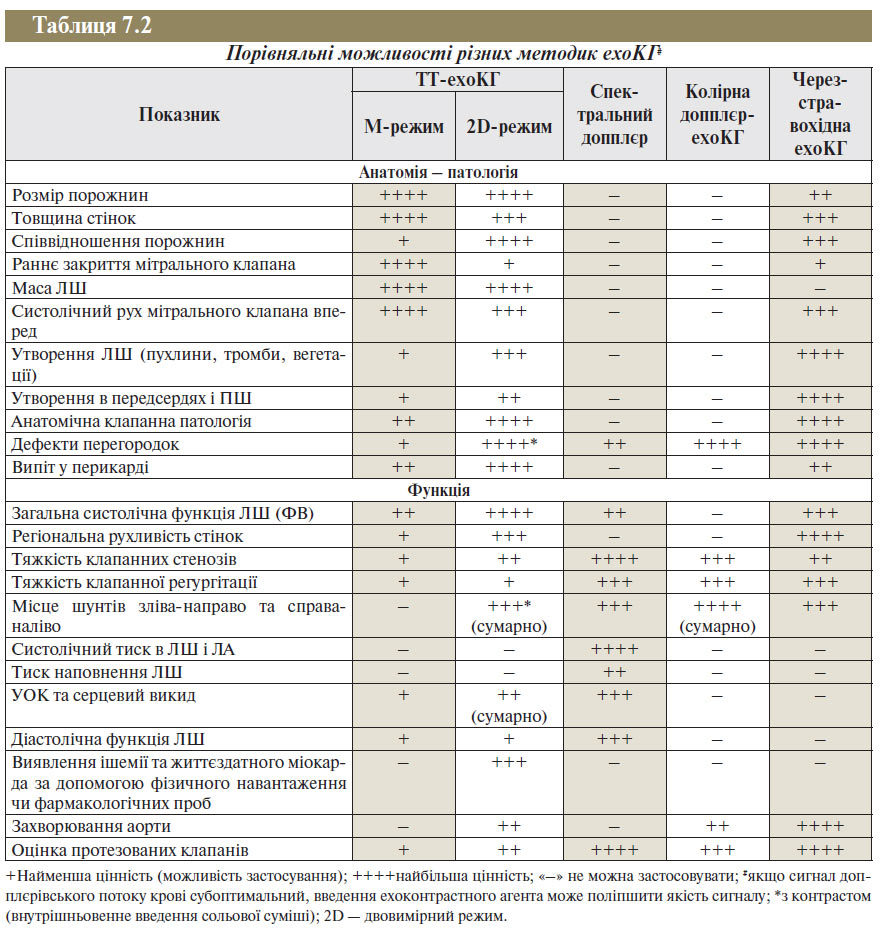
МОЖЛИВОСТІ РІЗНИХ МЕТОДИК ехоКГ
ОЦІНКА ФУНКЦІЇ ШЛУНОЧКІВ СЕРЦЯ
Систолічна функція
Основним і найчастіше використовуваним показником сумарної скоротності ЛШ є ФВ. Найбільше поширення одержав метод визначення ФВ за одновимірною ехоКГ, що складається з вимірювання КДР і КСР з таким обчисленням об’ємів ЛШ:
Проте цей метод має серйозні недоліки, оскільки, по-перше, у дуже багатьох хворих не вдається досягти проходження лінії сканування суворо перпендикулярно до міжшлуночкової перегородки, що необхідно для точності розрахунків, по-друге, формула Тейхольца для розрахунку об’єму ЛШ коректна лише тоді, коли його геометрія правильна.
У пацієнтів з ІХС і при деяких інших захворюваннях переважно в систолу геометрія ЛШ порушується. Також не можна забувати й про те, що при цьому методі враховується скоротність тільки базальних відділів ЛШ. У зв’язку з цими причинами фракція укорочення і швидкість циркулярного укорочення не можуть використовуватися як показники систолічної функції ЛШ (вони також визначаються за базальними сегментами ЛШ).
Тому були запропоновані інші, планіметричні методи визначення об’ємів ЛШ у систолу та діастолу з подальшим розрахунком ФВ. У цих методах використовується верхівковий доступ або комбінація верхівкового доступу з парастернальным доступом по короткій осі (методи Bullet, Simpson та ін.). Проведення дослідження цими методами потребує дуже багато часу при їх досить низькій точності. Тому вони не знайшли широкого використання при рутинному обстеженні хворих.
Часто досвідчені лікарі оцінюють ФВ візуально. Результати досліджень свідчать, що при відповідній кваліфікації візуальна оцінка ФВ дуже точна.
На сьогодні однією з найточніших і водночас простих методик визначення ФВ є обчислення співвідношення ударного об’єму ЛШ, отриманого при імпульсній допплєрографії у виносному тракті на рівні аортальних стулок, до КДО, що розраховано за формулою Тейхольца. Цей метод дозволяє оцінювати систолічну функцію ЛШ у хворих із сегментарними порушеннями скоротності, а також при вираженій мітральній недостатності, коли значна частина крові в систолу викидається не в аорту, а повертається в ліве передсердя. Цей метод точно реєструє мінімальні зміни ФВ у динаміці, що особливо цінне для оцінки перебігу захворювання та ефективності лікування пацієнтів із систолічною дисфункцією ЛШ. У нормі сумарна скоротність ЛШ має становити >55%. Зручно ділити порушення сумарної скоротності ЛШ на такі ступені: помірне зниження (ФВ ЛШ — 40–55%), зниження середньої тяжкості (ФВ ЛШ — 30–40%), виражене зниження (ФВ ЛШ <30%).
Ця класифікація досить зручна і дозволяє стежити за перебігом хвороби та ефективністю терапії, а також точно оцінювати прогноз у пацієнтів.
У хворих із СН велике прогностичне значення мають розмір порожнини ЛШ у базальному відділі та ФУ. Якщо базальні відділи ЛШ скорочуються задовільно, то функціонує «лівошлуночкова манжетка», що забезпечує достатній викид крові в аорту. У хворих із задовільною скоротністю базальних відділів відзначають значно кращий прогноз, ніж у тих, у кого один або кілька базальних сегментів скорочуються патологічно. Інформативність дослідження підвищується, якщо поряд з величиною ФВ одночасно оцінювати індекс скоротності ЛШ, що характеризує вираженість сегментарних порушень.
Для характеристики сумарної скоротності ЛШ має значення і оцінка руху мітральних стулок. При значно зниженій сумарній скоротності ЛШ у ранню діастолу відбувається патологічне прикриття мітральних стулок внаслідок високого кінцево-діастолічного тиску в ЛШ.
Для визначення систолічної функції ЛШ можна використати допплєр-ехоКГ. Для цього рекомендується визначати час прискорення потоку і часовий інтеграл швидкості потоку виносного тракту ЛШ. Якщо скоротність ЛШ знижена, то зменшується площа часового інтеграла швидкості і час прискорення, що визначається від початку прискорення потоку до досягнення максимальної швидкості.
Діастолічна функція
У клінічній практиці досить часто відзначають випадки, коли у хворих розвивається ХСН, а шлуночки при цьому не збільшені і ФВ нормальна, оскільки продуктивність роботи серця залежить не лише від його здатності викидати кров в аорту в систолу, але й від його можливості заповнюватися кров’ю в діастолу. У цих хворих спостерігається характерна рентгенологічна картина: застій у малому колі кровообігу при відсутності кардіомегалії. В такій ситуації причиною застійної СН може бути порушення діастолічного розслаблення міокарда та/або його підвищена жорсткість. Процес розслаблення після скорочення не пасивний, 15% всіх енергетичних витрат міокарда йдуть на покриття потреб діастоли. Порушення процесу діастолічного розслаблення і зниження піддатливості міокарда ЛШ виникають при таких захворюваннях, як ІХС, АГ, аортальний стеноз, ГКМП. Крім того, міокард стає жорстким і непіддатливим при розвитку фіброзу.
Катетеризація серця та визначення першої похідної тиску за часом (dР/dТ) — еталонний метод дослідження діастолічної функції серця. Проте імпульсна допплєр-ехоКГ є досить простим, неінвазивним і досить надійним методом оцінки діастолічної функції міокарда. Для оцінки діастолічної функції ЛШ при проведенні ехоКГ одержують верхівкове чотирикамерне зображення і розміщують пробний об’єм у вхідному тракті ЛШ. Слід одержати графік потоку через мітральний отвір з найбільшою швидкістю. Зазвичай це вдається на рівні країв мітральних стулок у діастолу, тобто дещо далі від фіброзного кільця клапана в напрямку до верхівки шлуночка. При хорошій якості запису чітко видно момент початку і момент припинення потоку через мітральний клапан, а також максимальну швидкість раннього діастолічного наповнення (точка Е) і максимальну швидкість у передсердну систолу (точка А).
Якщо скористатися постійно-хвильовим допплєрівським методом і направити сканувальний промінь так, щоб він на шляху до мітрального отвору перетнув виносний відділ ЛШ, то можна зареєструвати, крім діастолічного мітрального потоку, ще й систолічний потік крові, що викидається в аорту. Такий запис дає можливість виміряти тривалість періоду ізоволюмічної релаксації (IVRT): від моменту припинення викиду крові в аорту до початку мітрального потоку (рис. 7.25).

Рис. 7.25. Показники діастолічної функції ЛШ за трансмітральним потоком. IVRT — час ізоволюмічного розслаблення від моменту закриття аортального клапана до моменту відкриття мітрального клапана; AT — час прискорення ранньодіастолічного кровотоку; DT — час уповільнення ранньодіастолічного наповнення; dE — тривалість ранньодіастолічного наповнення; dA — тривалість
пізньодіастолічного наповнення
Нормальна тривалість періоду ізоволюмічної релаксації (isovolumic relaxation time — IVRT) становить 70–90 мс, при погіршенні розслаблення ЛШ ця величина зростає. З метою оцінки діастолічної функції міокарда знайшли широке застосування діастолічні часові інтервали. Серед них і час прискорення ранньодіастолічного потоку (acceleration time — AT), що визначають від початку трансмітрального потоку до досягнення максимальної швидкості (Е) і яке в нормі становить 100±10 мс. Показник тривалості ранньодіастолічного наповнення — dЕ, нормальне значення якого 214±26 мс і який значно збільшується при обструкції виносного тракту ЛШ. Також для характеристики діастолічної функції міокарда використовується час уповільнення (deceleration time — DT) — від точки, коли досягнуто максимальної швидкості ранньодіастолічного наповнення, до моменту його припинення; нормальна величина — 190±20 мс.
Відношення максимальної швидкості ранньодіастолічного потоку (Е) до потоку, зумовленого систолою передсердь (А), — важливий показник діастолічної функції (Е/А). В нормі коливається від 1,07 до 2,35.
При порушенні діастолічної функції ЛШ виділяють різні типи графіків потоку. Перший з них пов’язаний з порушенням релаксації ЛШ і характеризується такими змінами: збільшується період ізоволюмічної релаксації; знижується швидкість ранньодіастолічного наповнення, а швидкість потоку внаслідок систоли передсердь не змінюється або зростає; відповідно зменшується відношення Е/А; збільшується час уповільнення ранньодіастолічного потоку. Такий характер потоку частіше відзначають у осіб із ГЛШ та/чи ІХС при нормальному або помірно підвищеному тиску в лівому передсерді, коли систолічна функція ЛШ не порушена, а виявляється лише порушення діастолічного розслаблення. Як наслідок, зменшується ранньодіастолічне наповнення шлуночка кров’ю, а на частку передсердя доводиться відповідно більша робота, що викликає його дилатацію. Аналогічна графіка потоку виявляється у хворих з гострим підвищенням постнавантаження.
У деяких пацієнтів із вираженою ГЛШ і невеликою порожниною ЛШ спостерігається потік у виносному тракті в пізню діастолу і період ізоволюмічного скорочення. Швидкість цього потоку прямо пропорційна швидкості піка А трансмітрального потоку та обернено пропорційна об’єму ЛШ у діастолу. Цей феномен, імовірно, пов’язаний із поганою піддатливістю ЛШ і нездатністю його швидко збільшитися в розмірах, при цьому кров у систолу передсердь швидко спрямовується у виносний тракт.
Інший тип графіки потоку, рестриктивний, буває у хворих, у яких значно виражені симптоми застійної СН або знижена піддатливість ЛШ. Для нього характерні такі показники: короткий період IVRT; нормальна чи підвищена швидкість ранньодіастолічного наповнення — висока хвиля Е; знижена чи нормальна швидкість наповнення внаслідок систоли передсердя — знижена хвиля А; укорочене DT ранньодіастолічного потоку. Така графіка трансмітрального потоку пояснюється тим, що в цих випадках тиск у лівому передсерді значно підвищений, а його скоротна здатність суттєво послаблена. У ранню діастолу створюється високий тиск наповнення ЛШ, що сприяє швидкому надходженню крові з передсердя, а в систолу передсердь залишається відносно невеликий об’єм крові для проштовхування в непіддатливий шлуночок. Подібну картину виявляють також у хворих із підвищеним переднавантаженням, рестриктивною кардіоміопатією, перикардіальною констрикцією.
Крім зазначених показників, діастолічну функцію можна характеризувати за допомогою часових інтегралів швидкості ранньодіастолічного та передсердного наповнення (Е’ і А’ ), а також їх частки в загальному діастолічному наповненні (Е’/Т’ і А’/Т’). Часовий інтеграл швидкості визначається як площа під кривою швидкості потоку, тому Е’ — площа під тією частиною кривої, що відображає зміну швидкості у фазу ранньодіастолічного наповнення, А’ — наповнення внаслідок передсердної систоли. Т’ — площа під всією кривою зміни швидкості діастолічного потоку. Нормальні значення цих показників:
У пацієнтів з ІХС і збереженою ФВ ЛШ знижується перший з цих двох показників і підвищується другий порівняно із здоровими особами тих же вікових груп.
Виявлено, що після успішної черезшкірної балонної коронарної ангіопластики настає швидка нормалізація цих показників. Також відзначено, що лікування пацієнтів з АГ супроводжується поліпшенням діастолічної функції ЛШ, що підтверджується нормалізацією значень індексів Е´/Т´ і А´/Т´.
Таким чином, можна виявити три типи трансмітрального потоку при заповненні ЛШ. Нормальний тип характеризується тим, що хвиля Е трохи вища хвилі А. При порушенні релаксації ЛШ хвиля Е низька, а хвиля А стає високою. При рестриктивному характері діастолічного заповнення ЛШ хвиля Е стає високою, а хвиля А — більш низькою. При ІХС або АГ порушення діастолічної функції спочатку проявляється в тому, що хвиля Е стає низькою, а хвиля А — високою. Якщо ж розвивається СН або виникає мітральна недостатність — стани, при яких підвищується тиск у лівому передсерді (тиск наповнення ЛШ), то відбуваються протилежні зміни: хвиля Е стає високою, а хвиля А — більш низькою. У процесі трансформації одного патологічного типу трансмітрального потоку в інший може спостерігатися «псевдонормалізація» графіки трансмітрального потоку. Необхідно пам’ятати, що на графіку трансмітрального потоку також впливають інші фактори. З віком перша хвиля (Е) знижується, а друга (А) — підвищується, також підвищується хвиля А при тахікардії.
На сьогодні апробовані підходи визначення стану діастолічної функції ЛШ за допомогою оцінки трансмітрального потоку з використанням колірного М-режиму з визначенням кута поширення ранньодіастолічного потоку в ЛШ, що залежить від здатності ЛШ до активної релаксації.
РЕКОМЕНДАЦІЇ ЩОДО ПРОВЕДЕННЯ ехоКГ ПРИ ОКРЕМИХ ЗАХВОРЮВАННЯХ СЕРЦЕВО-СУДИННОЇ СИСТЕМИ
ЕхоКГ в оцінці патології клапанів серця
ЕхоКГ особливо показана при оцінці серцевих шумів, стенозів і регургітацій всіх чотирьох клапанів серця, оцінці функціонування протезованих клапанів та у хворих з інфекційним ендокардитом (Erbel R. и соавт., 2001; Клив Розендорф, 2007) (див. табл. 7.3–7.20).
Таблиця 7.3
Рекомендації щодо проведення ехоКГ у пацієнтів із серцевими шумами (згідно з АСС/AHA/ASE, 2003)
| Клас I |
| 1. Пацієнт із шумом і кардіореспіраторною симптоматикою 2. Пацієнт із шумом без клінічної симптоматики, клінічні дані якого вказують, як мінімум, на помірну можливість того, що шум відображає наявність органічного захворювання серця |
| Клас IIa |
| Пацієнт без клінічної симптоматики, з низькою вірогідністю серцевого захворювання, але у якого діагноз захворювання серця не може бути обґрунтований виключно за допомогою стандартного клінічного обстеження серцево-судинної системи |
| Клас ІІІ |
| Дорослий пацієнт без клінічної симптоматики, серцевий шум якого розцінюється досвідченим спеціалістом як функціональний або незначний |
Таблиця 7.4
Рекомендації щодо проведення ехоКГ при стенозі клапанів
| Клас I |
| 1. Діагноз; оцінка гемодинамічної тяжкості 2. Оцінка розмірів, функції та/чи гемодинаміки ЛШ і ПШ 3. Повторна оцінка у пацієнтів із встановленим клапанним стенозом при зміні симптоматики або показників 4. Оцінка змін гемодинамічної тяжкості й шлуночкової компенсації у хворих із встановленим клапанним стенозом у період вагітності 5. Повторна оцінка пацієнтів без клінічної симптоматики з тяжким стенозом |
| Клас IIa |
| 1. Оцінка гемодинамічної значимості клапанного стенозу легкого та середнього ступеня методом стрес-ехоКГ 2. Повторне обстеження хворих із стенозом устя аорти легкого та середнього ступеня із дисфункцією чи ГЛШ навіть за відсутності клінічної симптоматики |
| Клас ІІb |
| 1. Повторна оцінка стану хворих з аортальним стенозом легкого та середнього ступеня із стабільними ознаками і симптомами 2. ЕхоКГ із введенням добутаміну для оцінки стану хворих із низькоградієнтним стенозом устя аорти і шлуночковою дисфункцією |
| Клас ІІІ |
| 1. Рутинна повторна оцінка стану дорослих пацієнтів без клінічної симптоматики із стенозом устя аорти легкого ступеня, стабільними фізикальними даними, нормальними розмірами та функцією ЛШ 2. Рутинна повторна оцінка стану пацієнтів без клінічної симптоматики з мітральним стенозом легкого та середнього ступеня і стабільними фізикальними даними |
Таблиця 7.5
Рекомендації щодо проведення ехоКГ при нативній клапанній регургітації
| Клас I |
| 1. Діагноз; оцінка ступеня тяжкості гемодинамічних порушень 2. Первинна і повторна оцінка розмірів, функції та/чи гемодинаміки ЛШ і ПШ 3. Повторна оцінка стану пацієнтів із клапанною регургітацією легкого і середнього ступеня при зміні симптоматики 4. Повторна оцінка стану пацієнтів без клінічної симптоматики з тяжкою регургітацією 5. Оцінка зміни тяжкості гемодинамічних порушень і компенсації функції шлуночків у хворих із встановленою клапанною регургітацією в період вагітності 6. Повторне обстеження пацієнтів із клапанною регургітацією легкого та середнього ступеня з дилатацією шлуночків без клінічної симптоматики 7. Оцінка впливу лікувальних заходів на тяжкість регургітації та ступінь компенсації функції шлуночків, якщо це може змінити тактику лікування 8. Оцінка морфології клапанів та регургітації у пацієнтів із указанням в анамнезі на прийом будь-яких засобів або інших препаратів, застосування яких може бути пов’язане з клапанною патологією серця, з наявністю клінічної симптоматики, серцевих шумів, або які попередньо були обстежені аускультативно з використанням неадекватних методик (технічно недосконалих) |
| Клас ІІb |
| 1. Повторна оцінка стану хворих із мітральною регургітацією легкого та середнього ступеня без розширення камер серця і клінічної симптоматики 2. Повторне обстеження хворих із помірною аортальною регургітацією без розширення камер серця та клінічної симптоматики |
| Клас ІІІ |
| 1. Рутинна повторна оцінка стану пацієнтів без клінічної симптоматики з клапанною регургітацією легкого ступеня, стабільними фізичними параметрами, нормальними розмірами та функцією ЛШ 2. Рутинні повторні ехоКГ-обстеження осіб з нормальними показниками або з незначними клапанними відхиленнями |
Таблиця 7.6
Рекомендації щодо ехоКГ при пролапсі мітрального клапана
| Клас I |
| Діагноз; оцінка гемодинамічної тяжкості, морфології стулок і/або компенсації функції шлуночків у хворих із клінічними ознаками пролапса мітрального клапана |
| Клас IIa |
| 1. Для виключення пролапса мітрального клапана у хворих із цим встановленим діагнозом, але без клінічних підтверджень цього діагноза 2. Для виключення пролапса мітрального клапана у найближчих родичів пацієнтів із встановленою міксоматозною клапанною хворобою 3. Стратифікація ризику у хворих із фізікальними ознаками пролапса мітрального клапана або встановленим пролапсом мітрального клапана |
| Клас ІІІ |
| 1. Виключення пролапса мітрального клапана у пацієнтів з ознаками захворювання за відсутності комплексу клінічних симптомів або фізикальних даних на користь пролапса мітрального клапана чи за наявності позитивного сімейного анамнезу 2. Рутинне повторення ехоКГ у хворих із пролапсом мітрального клапана без регургітації чи з регургітацією легкого ступеня і без змін клінічної симптоматики |
Таблиця 7.7
Рекомендації щодо проведення ехоКГ при інфекційному ендокардиті: протезовані клапани
| Клас I |
| 1. Виявлення і визначення характеру клапанних уражень, тяжкості гемодинамічних порушень та/чи компенсації функції шлуночків* 2. Виявлення супутніх аномалій (наприклад абсцесів, шунтів)* 3. Повторні комплексні обстеження при ендокардиті (наприклад тяжке порушення гемодинаміки, ураження аортального клапана, персистувальна лихоманка чи бактеріємія, клінічні зміни або погіршення клінічної картини)* 4. Оцінка стану пацієнтів із високим ступенем клінічної підозри на інфекційний ендокардит при негативних результатах посіву* 5. Оцінка бактеріємії невизначеної етіології* |
| Клас IIa |
| Оцінка персистувальної гарячки без даних про бактеріємію чи при новому шумі* |
| Клас ІІb |
| Рутинне повторне обстеження при неускладненому ендокардиті під впливом антибіотикотерапії* |
| Клас ІІІ |
| Оцінка транзиторної лихоманки за відсутності даних про бактеріємію чи новий шум |
*Черезстравохідна ехоКГ может забезпечити лікаря новою інформацією на доповнення до одержаної при проведенні ТТ-ехоКГ.
Таблиця 7.8
Рекомендації щодо ехоКГ при інфекційному ендокардиті: нативні клапани
| Клас I |
| 1. Виявлення та визначення характеру клапанних уражень, їх гемодинамічної тяжкості та/чи компенсації функції шлуночків* 2. Виявлення вегетацій і характеристика уражень у пацієнтів із вродженими захворюваннями серця з підозрою на інфекційний ендокардит 3. Виявлення супутніх аномалій (наприклад абсцес, шунти)* 4. Повторні комплексні обстеження при ендокардиті (наприклад при тяжких порушеннях гемодинаміки, ураженні аортального клапана, персистувальній лихоманці або бактеріємії, клінічних змінах або погіршенні клінічної картини) 5. Оцінка пацієнтів із високим ступенем клінічної підозри на інфекційний ендокардит за наявності ендокардиту і негативних результатів бактеріального посіву* 6. Якщо дані ТТ-ехоКГ неясні, показане проведення черезстравохідної ехоКГ для встановлення причини бактеріємії, особливо стафілококової бактеріємії, а також фунгемії (гематогенна грибкова інфекція) за відсутності визначеного джерела інфікування |
| Клас IIa |
| 1. Оцінка персистувальної нестафілококової бактеріємії за відсутності визначеного джерела інфікування* 2. Стратифікація ризику при маніфестуючому ендокардиті* |
| Клас ІІb |
| Рутинне повторне обстеження при неускладненому ендокардиті під впливом антибіотикотерапії |
| Клас ІІІ |
| Виявлення причини транзиторної гарячки за відсутності даних про бактеріємію чи новий шум |
*Черезстравохідна ехоКГ часто может надати лікарю додаткову інформацію до одержаної при ТТ-ехоКГ. Роль черезстравохідної ехоКГ як дослідження «першого ряду» потребує подальшого обґрунтування.
Таблиця 7.9
Рекомендації щодо ехоКГ при інтервенційних втручаннях при клапанних захворюваннях серця та протезуванні клапанів
| Клас I |
| 1. Оцінка часових інтервалів втручань на клапанах, що ґрунтується на шлуночковій компенсації та функції і/чи тяжкості первинних і вторинних уражень 2. Вибір альтернативних методів лікування при захворюваннях мітрального клапана (наприклад балонна пластика клапана, оперативне відновлення клапана і протезування клапана)* 3. Використання ехоКГ (особливо черезстравохідної ехоКГ) для корекції техніки інвазивного чи хірургічного втручання (наприклад балонна вальвулотомія і відновлення клапана) при клапанній патології 4. Базисні дослідження клапанної функції (ранні) та ремоделювання шлуночків (пізні) після інвазивного втручання 5. Повторна оцінка пацієнтів із протезованими клапанами за умови зміни клінічної симптоматики, при підозрі на дисфункцію протеза (стеноз, регургітація) чи тромбоз* |
| Клас IIa |
| Рутинна повторна ехоКГ-оцінка після базисних досліджень пацієнтів із заміщенням клапанів, легкого та середнього ступеня дисфункції шлуночків, без зміни клінічної симптоматики |
| Клас ІІb |
| Рутинна повторна оцінка під час підвищення ступеня недостатності біопротеза без клінічних даних про дисфункцію протеза |
| Клас ІІІ |
| 1. Рутинна повторна оцінка пацієнтів із протезованими клапанами без підозри на дисфункцію клапана та з незмінною клінічною симптоматикою 2. Пацієнти, клінічний статус яких перешкоджає лікувальним втручанням |
*Черезстравохідна ехоКГ може забезпечити лікаря новою інформацією на додаток до отриманої при проведенні ТТ-ехоКГ.
ЕхоКГ при ІХС
У пацієнтів із хронічною ІХС ехоКГ застосовується у багатьох випадках, включаючи діагностику, стратифікацію ризику та рішення про лікувальну стратегію. Кількісні показники глобальної та регіонарної систолічної функції (включаючи фрагментарне укорочення, фрагментарні зміни площі й індексу руху стінок) застосовуються для характеристики функції ЛШ, визначення прогнозу та оцінки результатів лікування.
Таблиця 7.10
Рекомендації щодо використання ехоКГ в діагностиці синдромів гострої ішемії міокарда
| Клас I |
| 1. Діагностика підозрюваної гострої ішемії чи ІМ, недіагностованих стандартними методами 2. Оцінка вихідної функції ЛШ 3. Оцінка стану пацієнтів з ІМ нижніх відділів серця та клінічних даних, що дозволяють припустити ІМ ПШ 4. Оцінка механічних ускладнень і пристінкових тромбів* |
| Клас IIa |
| Ідентифікація локалізації/тяжкості захворювання у пацієнтів з ішемією, що розвивається (в наявності) |
| Клас ІІІ |
| Підтвердження діагнозу «гострий ІМ», вже встановленого стандартними методами |
*Проведення черезстравохідної ехоКГ показане, коли ТТ-ехоКГ діагностично неінформативна.
Таблиця 7.11
Рекомендації щодо використання ехоКГ в діагностиці та оцінці прогнозу при хронічній ІХС
| Клас I |
| 1. Діагностика ішемії міокарда у осіб із клінічною симптоматикою* |
| 2. Навантажувальна ехоКГ з метою діагностики ішемії міокарда у окремих пацієнтів (у яких ЕКГ-оцінка менш діагностично значима у зв’язку із застосуваням дигоксину, або тих, у яких відзначено ГЛШ, депресію сегмента ST >1 мм у стані спокою на вихідній ЕКГ, синдром передчасного збудження (WPW-синдром) або повну блокаду лівої ніжки пучка Гіса) з проміжними даними, що дозволяють припустити наявність захворювання коронарних артерій 3. Оцінка глобальної функції шлуночків серця у стані спокою 4. Оцінка життєздатності міокарда (гібернований міокард) для планової реваскуляризації** 5. Оцінка функціональної значимості коронарних порушень (якщо це ще не встановлено), при плануванні проведення ПКВ* |
| Клас IIa |
| 1. Прогнозування розвитку ішемії міокарда у окремих хворих (у яких ЕКГ менш презентабельна) з наступними аномаліями на ЕКГ: синдром передчасного збудження шлуночків (WPW-синдром), штучно нав’язаний шлуночковий ритм, депресія сегмента ST у спокої >1 мм, повна блокада лівої ніжки пучка Гіса* 2. Виявлення артеріопатії коронарних артерій у хворих після трансплантації серця** 3. Виявлення ішемії міокарда у жінок з даними проміжних досліджень, у яких припускається захворювання коронарних артерій* |
| Клас ІІb |
| 1. Оцінка пацієнта без клінічної симптоматики, але з позитивними результатами скринінгу за допомогою проби з навантаженням на тредмілі* 2. Оцінка глобальної шлуночкової функції за допомогою навантажувальних тестів* |
| Клас III |
| 1. Скринінг пацієнтів без клінічної симптоматики з низькою вірогідністю виникнення захворювання коронарних артерій 2. Рутинні періодичні повторні обстеження клінічно стабільних пацієнтів, для яких не розглядаються можливі зміни в лікуванні 3. Рутинне заміщення обстежень із навантаженням на тредмілі у хворих, для яких ЕКГ-контроль визнаний достатнім* |
У табл. 7.11 і 7.13: *фізичне навантаження чи фармакологічна стрес-ехоКГ; **стрес-ехоКГ з добутаміном.
Таблиця 7.12
Рекомендації щодо ехоКГ при оцінці інтервенційних втручань при хронічній ІХС
| Клас I |
| 1. Оцінка функції ЛШ за необхідності призначення і модифікації фармакотерапії у хворих із встановленою дисфункцією ЛШ або підозрою на неї 2. Оцінка рестенозу після реваскуляризації у хворих із атиповою рецидивуючою симптоматикою* |
| Клас II |
| 1. Оцінка рестенозу після реваскуляризації у хворих із типовими рецидивними симптомами* 2. Оцінка функції ЛШ у хворих з ІМ в анамнезі, за необхідності імплантації кардіостимулятора-дефібрилятора у пацієнтів із встановленою дисфункцією ЛШ або підозрі на неї |
| Клас III |
| Рутинна оцінка у пацієнтів без клінічної симптоматики після реваскуляризації |
*Фізичне навантаження чи фармакологічна стрес-ехоКГ.
Таблиця 7.13
Рекомендації щодо застосування ехоКГ при оцінці ризику, прогнозування та ефективності лікування при синдромах гострої ішемії міокарда
| Клас I |
| 1. Оцінка розмірів ІМ та/чи зон ризику в міокарді 2. Внутрішньолікарняна оцінка функції шлуночків, результати якої відобразяться на виборі терапії 3. Внутрішньолікарняна чи рання оцінка наявності/поширеності індуцибельної ішемії навіть за відсутності вихідних аномалій, що можуть впливати на інтерпретацію ЕКГ* 4. Оцінка життєздатності міокарда з метою визначення потенціальної ефективності реваскуляризації** |
| Клас IIa |
| 1. Внутрішньолікарняна чи рання оцінка наявності/поширеності індуцибельної ішемії за відсутності вихідних аномалій, які можуть вплинути на інтерпретацію ЕКГ* 2. Повторна оцінка функції шлуночків у період реконвалесценції (реабілітаційний період), при цьому одержані результати впливають на лікувальний режим 3. Оцінка функції шлуночків після реваскуляризації |
| Клас ІІb |
| Оцінка пізнього прогнозу (≥2 років після перенесеного ІМ) |
| Клас ІІІ |
| Рутинні повторні оцінки за відсутності будь-яких змін клінічного статусу |
Оцінка сегментарної скоротності ЛШ
ЕхоКГ та її черезстравохідний варіант відкривають для клініки цінну можливість діагностики коронарної артерії, що обумовила інфаркт, за вторинними (механічними) ознаками порушення коронарної перфузії — локальної дисфункції сегмента стінки шлуночка.
Відповідно до уявлень про так званий ішемічний каскад, механічні аномалії (локальна дисфункція сегмента стінки шлуночка) настають вже на етапі неоднорідності кровотоку, а депресія сегмента ST на ЕКГ реєструє один із кінцевих етапів ішемії. Зменшення коронарного кровотоку на ≥50% у басейні артерії, що обумовила інфаркт, супроводжується появою механічних аномалій руху стінки шлуночка, які можна реєструвати при ехоКГ-обстеженні. Ця обставина дозволяє реєструвати ішемію на ранніх етапах ішемічного каскаду, задовго до появи зміщень сегмента ST на ЕКГ, ангінозного болю. Хоча ехоКГ у стані спокою не належить до методів діагностики ІХС, проте посегментний аналіз руху стінок камер серця ефективний та інформативний у ряді клінічних ситуацій. Аналіз надає об’єктивні дані для оцінки ефективності лікування гострих форм ІХС за рахунок можливості спостереження локальної функції стінок шлуночка в динаміку. Метод дозволяє оцінювати ефективність хірургічної реваскуляризації, коронарної ангіопластики. Успішно конкурує з ангіографією в оцінці прогнозу ускладнень, летального результату гострого ІМ. Метод дозволяє оцінити обсяг некротизованного і життєздатного міокарда, особливо ефективно при використанні стрес-ехоКГ. Сегментний аналіз дозволяє проводити диференційну діагностику у разі болю у грудній клітці: відсутність механічних аномальних рухів стінки шлуночка практично виключає ішемію міокарда і/або ІМ як причину больового синдрому. Сегментний аналіз особливо інформативний в тому разі, якщо трактування та інтерпретація стандартної ЕКГ утруднена щодо визначення топіки ураження при блокадах, гіпертрофії, повторних ІМ, на фоні застосування лікарських засобів. Не викликає сумніву обґрунтованість проведення сегментного аналізу при ІМ ПШ або при залученні у процес нижньодіафрагмальної стінки ЛШ.
Для сегментного аналізу при проведенні черезстравохідної ехоКГ використовують стандартизовані підходи, детально розроблені для стандартної двовимірної ехоКГ, стресової ехоКГ. Підходи ґрунтуються на тому, що ехоКГ-сегменти стінки шлуночка, передсердя васкуляризуються відповідною гілкою коронарної епікардіальної сітки серця. Згідно з анатомічними даними, прямим зіставленням результатів коронароангіографії, аутопсії та стандартної ехоКГ встановлені ділянки міокарда, васкуляризація яких здійснюється епікардіальними коронарними артеріями серця. Ці дані підтверджені й задокументовані при проведенні ехоКГ-обстеження на експериментальній моделі із застосуванням спеціального дрібнодисперсного середовища при його селективному введенні в головні коронарні стовбури. Для аналізу локальної функції сегмента стінки шлуночка застосовуються стандартні двовимірні ехоКГ-підходи: короткоосьові парастернальні з площиною сканування на трьох рівнях — мітральний клапан, середні відділи сосочкових м’язів ЛШ, верхівка серця; парастернальний довгоосьовий вид з оптимальним зображенням мітрального клапана; апікальні чотири- і двокамерні зображення по довгій осі. Стандартизованим і уніфікованим вважається підхід, що припускає поділ стінок ЛШ на 16 сегментів (Segar D.S. et al., 1992), запропонований Американським товариством ехокардіографії (рис. 7.26).
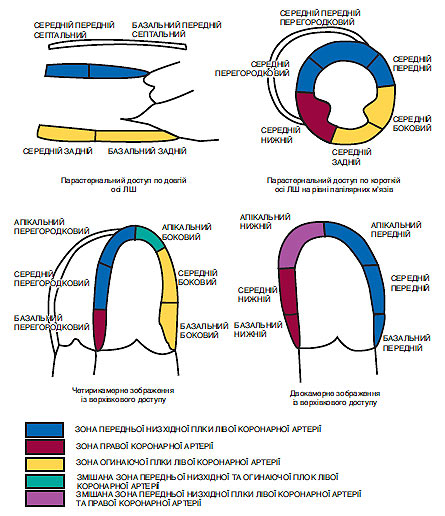
Рис. 7.26. Схема розподілу ЛШ на сегменти
Кожен сегмент відповідає 6,25% поверхні шлуночка, а верхівка — 25%. На практиці досліджень застосовують номенклатуру і томографічний аналіз, де використовується і 14-сегментна модель ЛШ: по 6 сегментів на верхній і середній третині, 2 — на верхівці. Аналіз припускає додаткові довгоосьові проекції, оскільки короткоосьові в ряді випадків мають низьку відтворюваність, а механічні аномалії руху стінки шлуночка мають бути підтверджені кількома ортогональними позиціями.
Встановлено, що передні та передньоперегородкові сегменти верхньої та середньої третини ЛШ, а також верхівковий сегмент васкуляризуються лівою передньою низхідною артерією. Перегородкові нижні й задні сегменти на базальному та середньому рівні — правою коронарною артерією. Бічні, базальний та середній — лівою коронарною огинаючою артерією. У дорослій популяції у 85% спостережень або у 90% випадків сегменти задньої стінки ЛШ васкуляризуються задньою низхідною артерією, що відходить від правої коронарної артерії — правокоронарна форма кровопостачання. У невеликій кількості спостережень задня низхідна артерія відходить від лівої коронарної огинаючої артерії. Проте з клінічної точки зору сітка стовбура лівої коронарної артерії завжди більш значима, оскільки васкуляризує більшість сегментів стінок ЛШ. Разом з тим є дані, що свідчать, що ліво- і правокоронарні форми відзначаються лише у 10 і 5% спостережень відповідно, а найчастіше виявляється рівномірна форма, при якій обидва великих коронарних стовбури мають приблизно рівні ділянки кровопостачання. Вважається, що короткоосьовий вид у площині сканування сосочкових м’язів — це, як правило, вид вибору для діагностики механічних аномальних рухів стінки шлуночка, а також для моніторування функції шлуночка з високою імовірністю внутрішньоопераційної ішемії.
Дисфункція передньоперегородкового сегмента на середньому рівні та відсутність змін цього сегмента на базальному вказують на високу імовірність оклюзії лівої передньої низхідної артерії нижче відходження передньої септальної гілки. Апікальні сегменти нижньої третини ЛШ забезпечуються лівою передньою низхідною артерією. Задні апікальні сегменти нижньої третини завжди живляться задньою низхідною артерією, що може відходити як від лівої огинаючої артерії, так і від правої коронарної артерії. Якщо артерією, що обумовила інфаркт, виявиться ліва передня низхідна артерія, механічна сегментарна дисфункція може виявлятися у всіх апікальних сегментах, тоді як у разі тромбозу в системі правої коронарної артерії — задньої низхідної артерії — лише в задніх сегментах.
Особливу увагу рекомендується приділяти сегментам базального рівня — задньобазальному, базальному бічному, базальному нижньоперегородковому. Механічну дисфункцію задньобазального сегмента задньої стінки ЛШ може імітувати систолічний латеральний рух епі- та ендокардіальних контурів без потовщення з невеликим стоншенням у фазі ізоволюмічного скорочення. Феномен латерального руху не слід розцінювати як артефакт або локальну дисфункцію внаслідок ІМ. Аналогічним підходом слід керуватися щодо базальних бічних і базального перегородкового сегментів, систолічний рух яких в нормі в умовах спокою обмежений. Стресова ехоКГ може виявити ізольовану гіпокінезію зазначених сегментів, що слід розцінювати як псевдопозитивний результат. Ізольована, що спостерігається лише в зазначених базальних сегментах, гіпокінезія є варіантом нормальної реакції як у інтактних осіб, так і в популяції з ураженням коронарних артерій (Varga A. еt al., 1992). Низька чутливість у виявленні локальної дисфункції стінок ЛШ встановлена для нижніх сегментів у стані спокою при комп’ютерному аналізі.
Оцінюючи локалізацію і поширення механічних сегментних аномалій одночасно проводять їх кількісний аналіз, що вказує на ступінь вираженості дисфункції. Існують два способи аналізу: візуальний і комп’ютерний (цифровий). Комп’ютерний аналіз зручний у тому разі, коли потрібна кількісна оцінка дисфункції сегментів у процесі лікування. Проте візуальний аналіз визнаний більш точним, особливо при гіпокінезії. Він використовується як контрольна процедура при аналізі локальної функції сегмента стінки шлуночка. Наявність подібного візуального контрольного тесту, що застосовується в більшості медичних центрів, набуває особливого значення: сегменти міокарда, що зберегли здатність до систолічного потовщення у спокої та перебувають у стані гіпокінезії (порівняно з акінетичними), частіше виявляються життєздатними.
Розроблено численні протоколи дослідження. Часто використовується протокол, що вже став класичним і включає такі характеристики:
- нормокінезія (систолічна екскурсія ендокарда) >5 мм;
- гіпокінезія 2–5 мм;
- акінезія <2 мм;
- дискінезія.
У клінічній практиці користується популярністю стандартна номенклатура аналізу аномальних рухів сегмента стінки, де маркером дискінезії вважається відсутність систолічного потовщення та/чи наявність систолічного стоншення сегмента стінки. Ця модель зручна в практичному аспекті, оскільки є можливість аналізувати ту чи іншу ділянку міокарда з різних проекцій. Це набуває особливого значення при дослідженні дорослої популяції, коли для конкретної ехоКГ-проекції є обмеження. До переваг моделі слід віднести стандартну номенклатуру, що забезпечує уніфікацію процедури та ретельний аналіз двовимірної томограми.
Американським товариством ехокардіографії запропонована 16-сегментна модель ЛШ, проте короткоосьові томограми часто опасифіковані та/чи погано відтворені. Тому зростає роль апікальних зображень.
Індекс асинергії (відношення суми значень екскурсій сегментів із дисфункцією до кількості досліджених сегментів) сегментного аналізу використовується як прогностичний показник виживаності на коротко-довгостроковий період, розподіляє пацієнтів із гострим ІМ на підгрупи високого й низького ризику. Встановлено, що індекс асинергії має значно більшу прогностичну чутливість, ніж загальна ФВ камери шлуночка. Його значення >1,9 розцінюється як прогностично несприятливе.
При значенні >2,0 частота ускладнень гострого періоду ІМ досягала 89% проти 16% — при значенні <2,0. Тому індекс асинергії зручно використовувати як маркер прогнозу ускладнень і летального кінця в гострий період ІМ. Також встановлено зв’язок ступеня загального серцево-судинного ризику з маркерами функції ендотелію і запалення, що корелюють з масою міокарда ЛШ у хворих з ІХС та АГ.
Відомо, що черезстравохідна ехоКГ у варіанті добутамінового тесту з метою виявлення життєздатного міокарда підвищувала чутливість і специфічність діагностики стандартної ехоКГ з 84 і 81% до 91 і 100% відповідно. Проводячи черезстравохідну ехоКГ-внутрішньоопераційну діагностику механічних сегментних аномалій, завжди необхідно враховувати тиск наповнення шлуночка, його піддатливість, інші параметри кровопостачання, які є величинами змінними, їх значення можуть широко варіювати, впливаючи на систолічну екскурсію сегмента стінки шлуночка.
З метою одержання більш об’єктивної картини механічних сегментних аномалій у 1989 р. розроблено концепцію використання тканинного допплєрівського методу. Метод допплєрівського зображення тканини (DTI) дозволяє одержувати цифровий аналіз пікових швидкостей розслаблення/скорочення сегментів стінок, піковий міокардіальний градієнт швидкості, що припускає співвідношення зазначених параметрів до систолічного потовщення стінки. Метод практично не залежить від ручної планіметрії та суб’єктивного фактора, добре відтворюється. Результати дослідження зручно архівуються з можливістю повторного аналізу й порівнянь у процесі лікування.
Нові можливості сегментного аналізу відкриває цифрова віднімальна ехоКГ з високою швидкістю кадрів.
Артеріальна гіпертензія
ЕхоКГ — неінвазивна діагностична процедура вибору при оцінці впливу системної АГ на серце як найчастішої причини розвитку ГЛШ і застійної СН у дорослих. Пацієнтам із пограничною АГ без ознак ГЛШ на ЕКГ ехоКГ може бути показана безпосередньо для оцінки ГЛШ. Значення повторних досліджень у пацієнтів з АГ без клінічної симптоматики і нормальною функцією ЛШ не встановлено.
Таблиця 7.14
Рекомендації щодо ехоКГ при АГ
| Клас I |
| 1. При оцінці функції розслаблення ЛШ, ГЛШ або концентричного ремоделювання (ехоКГ важлива для прийняття клінічного рішення) 2. Виявлення і оцінка функціональної значимості супутнього захворювання коронарних артерій за допомогою стресової ехоКГ 3. Динамічна оцінка розмірів та функції ЛШ у хворих із його дисфункцією, у яких документовано зміну клінічного стану, або для підбору медикаментозної терапії |
| Клас IIa |
| 1. Ідентифікація аномалій діастолічного наповнення ЛШ із наявністю систолічних аномалій або без таких 2. Оцінка ГЛШ у пацієнтів із пограничною АГ без ознак ГЛШ на ЕКГ з метою прийняття рішення про доцільність початку лікування |
| Клас ІІb |
| Стратифікація ризику для прогнозування продуктивності роботи ЛШ |
| Клас ІІІ |
| 1. Повторна оцінка для вибору антигіпертензивної терапії, що ґрунтується на зменшенні маси ЛШ 2. Повторне обстеження пацієнтів без клінічної симптоматики для оцінки функції ЛШ |
Кардіоемболічні захворювання та судинні оклюзивні події
Двовимірна ехоКГ — єдина методика, що легко здійснюється і широко застосовується для виявлення потенційного джерела емболії.
Дослідження можуть проводитися з використанням ТТ- або черезстравохідного доступу. У табл. 7.15 зіставлено дані черезстравохідної та ТТ-ехоКГ щодо виявлення потенційних джерел емболії.
Таблиця 7.15
ТТ-ехоКГ порівняно із черезстравохідною ехоКГ для виявлення потенційних джерел кардіоемболії
Діагностика | Діагностика |
| • Мітральний стеноз • ДКМП • Аневризма ЛШ • Тромби ЛШ • Пролапс мітрального клапана • Вегетації • Дефекти перегородок передсердь | • Тромби лівого передсердя • Спонтанне контрастування лівого передсердя • Аневризма передсердної перегородки • Відкрите овальне вікно • Атероматоз аорти |
*Досить проведення ТТ-ехоКГ; черезстравохідну ехоКГ можна проводити додатково, проте це дослідження не обов’язкове.
Інформативна ТТ-ехоКГ дозволяє з впевненістю діагностувати захворювання, а черезстравохідна ехоКГ в цьому разі не забезпечує одержання додаткової інформації. При виявленні захворювання методом ТТ-ехоКГ проведення черезстравохідної ехоКГ у всіх пацієнтів не обов’язкове. Діагностична цінність встановленого діагнозу зростає при проведенні черезстравохідної ехоКГ після негативних результатів ТТ-ехоКГ або у тому разі, якщо виявлені ознаки унікальні і можуть бути визначені лише на черезстравохідній ехоКГ, навіть у разі результативної ТТ-ехоКГ.
Ці категорії припускають, що високоякісна ТТ-ехоКГ — діагностичний метод оцінки потенційних кардіальних джерел емболії. У разі сумнівних результатів ТТ-ехоКГ необхідно додатково проводити черезстравохідну ехоКГ.
Таблиця 7.16
Рекомендації щодо виконання ехоКГ у пацієнтів із цереброваскулярними чи іншими судинними оклюзивними подіями
| Клас I |
| 1. Пацієнти будь-якого віку з гострою оклюзією основних периферичних або вісцеральних артерій 2. Пацієнти молодшого віку (зазвичай <45 років) з цереброваскулярними подіями 3. Пацієнти старшого віку (зазвичай >45 років) з неврологічними подіями без даних про наявність цереброваскулярного захворювання або іншої очевидної причини 4. Пацієнти, у яких рішення про застосування тієї чи іншої тактики лікування (наприклад призначення антикоагулянтної терапії) буде залежати від результатів ехоКГ |
| Клас IIa |
| Пацієнти з підозрою на емболію чи цереброваскулярне захворювання невизначеної етіології та клінічної значимості |
| Клас ІІb |
| Пацієнти з неврологічною подією і вираженим цереброваскулярним захворюванням, достатнім для того, щоб розвинулась клінічна подія |
| Клас ІІІ |
| Пацієнти, у яких результати ехоКГ не впливають на рішення про застосування антикоагулянтної терапії чи інших підходах до діагностики і лікування |
Аритмії
За наявності аритмії роль ехоКГ складається перш за все у виявленні супутньої серцевої патології, знання про яку може впливати на лікування аритмії чи забезпечить прогностичну інформацію. У цьому плані ехоКГ-обстеження часто проводять у хворих із фібриляцією чи тріпотінням передсердь, передсердними тахікардіями, шлуночковою тахікардією чи фібриляцією шлуночків. Хоча ехоКГ забезпечує повноцінну інформацію про вплив аритмії на серцеву функцію, не існує рекомендацій щодо повторних клінічних досліджень. Повторні дослідження проводяться у разі змін клінічного статусу або якщо результат может може вплинути на ухвалення рішення про лікувальну тактику.
Таблиця 7.17
Рекомендації щодо ехоКГ у пацієнтів із порушеннями ритму серця і серцебиттям
| Клас I |
| 1. Аритмія з клінічною підозрою на органічне захворювання серця 2. Аритмія у пацієнта з наявністю в сімейному анамнезі генетично зумовленого ураження серця, що асоціюється з аритмією, такого як туберозний склероз, рабдоміома чи ГКМП 3. Оцінка у пацієнтів як компонент програми перед проведенням електрофізіологічних процедур абляції |
| Клас IIa |
| 1. Аритмія, що потребує лікування 2. Черезстравохідна ехоКГ або внутрішньосерцеве УЗД як контроль проведения процедур радіочастотної абляції |
| Клас IIb |
| 1. Аритмії, що зазвичай асоційовані з серцевим захворюванням, але без клінічних даних на користь останнього 2. Оцінка стану пацієнтів, які перенесли радіочастотну абляцію за відсутності ускладнень (у центрах із чітко розробленими абляційними програмами проведення ехоКГ після процедури абляції може не бути необхідним) 3. Післяопераційна оцінка хворих, які перенесли процедуру MAZE, для моніторингу функції передсердь |
| Клас ІІІ |
| 1. Серцебиття без супутньої аритмії чи іншої кардіальної симптоматики 2. Ізольовані передчасні скорочення шлуночків, при яких немає клінічної підозри на захворювання серця |
Таблиця 7.18
Рекомендації щодо ехоКГ перед кардіоверсією
| Клас I |
| 1. Пацієнти, яким необідна швидка (проте не невідкладна) кардіоверсія, для яких небажане проведення масивної антикоагулянтної терапії перед кардіоверсією* 2. Хворі без передуючих кардіоемболічних подій, що пов’язані, вірогідно, із внутрішньопередсердними тромбами* 3. Пацієнти з протипоказаннями до антикоагулянтної терапії, для яких рішення про кардіоверсію приймається з урахуванням даних черезстравохідної ехоКГ* 4. Пацієнти, у яких наявність тромба у передсердях продемонстрована раніше за допомогою черезстравохідної ехоКГ* 5. Оцінка пацієнтів, для яких на рішення щодо кардіоверсії впливають знання про прогностичні фактори (такі як функція ЛШ або супутнє захворювання мітрального клапана) |
| Клас IIa |
| Пацієнти з фібриляцією передсердь тривалістю <48 год та іншими захворюваннями серця* |
| Клас ІІb |
| 1. Пацієнти з фібриляцією передсердь тривалістю <48 год і за відсутності іншої серцевої патології* 2. Пацієнти із захворюваннями мітрального клапана чи ГКМП, які тривалий період перед кардіоверсією одержували антикоагулянти у терапевтичних дозах, виключаючи інші причини для застосування антикоагулянтів (наприклад ембол, що існував раніше, або діагностований тромб при попередній черезстравохідній ехоКГ)* 3. Пацієнти, у яких проводили кардіоверсію з приводу тріпотіння передсердь* |
| Клас ІІІ |
| 1. Пацієнти, яким необхідна невідкладна кардіоверсія 2. Пацієнти, які одержували лікування антикоагулянтами тривалий час перед кардіоверсією у терапевтичних дозах і які не мали захворювань мітрального клапана чи ГКМП до проведення кардіоверсії, крім інших причин для призначення антикоагулянтів (наприклад ембол, що існував раніше або діагностований тромб при попередній черезстравохідній ехоКГ)* 3. Оцінка стану пацієнтів до проведення кардіоверсії, які були обстежені раніше за допомогою черезстравохідної ехоКГ і без клінічної підозри на суттєві зміни серцевого ритму |
*Лише черезстравохідна ехоКГ.
Непритомності
Таблиця 7.19
Рекомендації щодо ехоКГ у пацієнтів з непритомностями
| Клас I |
| 1. Непритомність у пацієнта з клінічною підозрою на захворювання серця 2. Непритомності при фізичному напруженні |
| Клас IIa |
| Непритомності у пацієнтів окремих професійних груп (наприклад льотчиків) |
| Клас ІІb |
| Непритомності неясної етіології без виявлених серцевих захворювань за даними анамнезу чи фізикального обстеження |
| Клас ІІІ |
| 1. Рецидивні непритомності у пацієнта з раніше діагностованою причиною непритомності (на ехоКГ чи при іншому обстеженні) 2. Непритомності у пацієнта без клінічної підозри на захворювання серця 3. Класична неврогенна непритомність |
ЕхоКГ як метод скринінгу
Багатогранність методу ехоКГ робить можливим його застосування як метод скринінгу. Проте серед багатьох станів, які можуть бути виявлені за допомогою ехоКГ, лише незначна частина відповідає критеріям для скринінгу осіб без клінічної симптоматики. До відповідних критеріїв захворювань належать спадкові хвороби серця та великих судин, коли у ролі досліджуваної групи для скринінгу виступають члени родини пацієнта з наявністю патології. Одні з найпоширеніших захворювань, які потрапляють до цієї категорії, — кардіоміопатія та синдром Марфана.
Останні досягнення в галузі молекулярної генетики виявили сімейну основу багатьох форм кардіоміопатій (Charron P. et al., 1997). Хоча у майбутньому як метод скринінгу все ширше буде використовуватися генетичне тестування, на сьогодні одним з основних методів скринінгу продовжує залишатися ехоКГ. Генетичне тестування, доповнене ехоКГ, забезпечує документування генетичного субстрату захворювання з подальшим визначенням його проявів і прогресування. Однозначно визначена роль ехоКГ як методу скринінгу для трьох форм міопатії ГКМП і ДКМП, а також аритмогенної дисплазії ПШ.
Таблиця 7.20
Рекомендації щодо проведення ехоКГ для скринінгу наявності серцево-судинного захворювання
| Клас I |
| 1. Пацієнти з сімейним анамнезом серцево-судинного захворювання, що передається генетично 2. Потенційні донори для трансплантації серця 3. Пацієнти з фенотиповими ознаками синдрому Марфана чи подібними захворюваннями сполучної ткани 4. Вихідна і повторні оцінки пацієнтів, які приймають хіміотерапію кардіотоксичними агентами 5. Найближчі родичі (батьки, рідні брати і сестри або діти) пацієнтів із ДКМП невстановленої етіології |
| Клас ІІb |
| Пацієнти із системними захворюваннями, які можуть вражати серце |
| Клас ІІІ |
| 1. Загальна популяція 2. Рутинний ехоКГ-скринінг для участі у спортивних змаганнях у пацієнтів з нормальним кардіологічним анамнезом, ЕКГ і даними обстеження |
НОРМАЛЬНІ ЗНАЧЕННЯ РЕЗУЛЬТАТІВ ВИМІРІВ У М- ТА В-РЕЖИМАХ У ДОРОСЛИХ ОСІБ
Додаток 7.1
Нормальні значення вимірів у В-режимі у дорослих осіб: апікальна чотирикамерна позиція (з урахуванням площі поверхні тіла)
| ЛШ (КД) довга вісь, см/м² ЛШ (КС) довга вісь, см/м² ЛШ (КД) коротка вісь, см/м² ЛШ (КС) коротка вісь, см/м² ПШ (КД) довга вісь, см/м² ПШ (КС) довга вісь, см/м² ПШ (КД) коротка вісь, см/м² ПШ (КС) коротка вісь, см/м² ЛП (КД) довга вісь, см/м² ЛП (КС) довга вісь, см/м² ЛП (КД) коротка вісь, см/м² ЛП (КС) коротка вісь, см/м² ПП (КД) довга вісь, см/м² ПП (КС) довга вісь, см/м² ПП (КД) коротка вісь, см/м² ПП (КС) коротка вісь, см/м² | 4,1–4,9 2,7–3,5 2,3–2,9 1,4–2,0 3,6–4,6 2,5–3,5 1,3–2,1 0,9–1,7 1,1–1,9 1,7–2,5 0,9–1,5 1,5–2,1 1,1–1,7 1,9–2,7 1,1–1,9 1,4–2,2 |
| Корінь Ао, см Висхідна Ао, см ЛА на рівні стулок, см НПВ, см | 1,8–3,0 1,7–4,1 1,5–2,5 1,5–2,0 |
Параметри наведені за: Вилкенсхоф У., Крук И. (2007) Справочник по эхокардиографии. Медицинская литература, Москва.
Тут і далі в додатках: КС — кінець систоли, КД — кінець діастоли, ЛП — ліве передсердя, ПП — праве передсердя, НПВ — нижня порожниста вена.
Додаток 7.2
Нормальні значення вимірів у М-режимі у дорослих осіб
| Ао (КД), мм ЛП (КС), мм ПШ (КД), мм ПШ (КС), мм МШП (КД), мм ЗСЛШ (КД), мм МШП/ЗСЛШ ЛШ (КД), мм ЛШ (КС), мм ФУ, % LVET, мс MCC-відстань, мм АоК-розкриття стулок, мм ФВ, % | 27 29 19 18 9 9 <1,3:1 47 35 25–45 280 >6 >16 62 | 21–44 18–39 9–26 15–22 6–12 6–12 37–56 27–37 230–334 5–10 15–22 45–90 |
Параметри наведені за: Вилкенсхоф У., Крук И. (2007) Справочник по эхокардиографии. Медицинская литература, Москва.
МШП — міжшлуночкова перегородка, ЗСЛШ — задня стінка ЛШ, LVET — час викиду ЛШ, МСС — мітрально-септальна сепарація.
Додаток 7.3
Нормальні значення вимірів у В-режимі у дорослих осіб
Позиція обстеження | Норма (середнє значення ±2 σ), см | Середнє значення, см | Індекс, см/м² |
| Апікальна чотирикамерна | |||
| ЛШ (КД) довжина ЛШ (КД) поперечник ЛШ (КС) поперечник ПШ довжина ПШ поперечник | 6,9–10,3 3,3–6,4 1,9–3,7 6,5–9,5 2,2–4,4 | 8,6 4,7 2,8 8,0 3,3 | 4,1–5,7 2,2–3,1 1,3–2,0 3,8–5,3 1,0–2,8 |
| Парастернальна довга вісь | |||
| ЛШ (КД) ЛШ (КС) ПШ | 3,5–6,0 2,1–4,0 1,9–3,8 | 4,8 3,4 2,8 | 2,3–3,1 1,4–2,1 1,2–2,0 |
| Парастернальна коротка вісь на рівні стулок МК | |||
| ЛШ (КД) ЛШ (КС) | 3,5–6,2 2,3–4,0 | 4,8 3,2 | 2,3–3,2 1,5–2,2 |
| На рівні папілярних м’язів | |||
| ЛШ (КД) ЛШ (КС) | 3,5–5,8 2,2–4,0 | 4,7 3,1 | 2,2–3,1 1,4–2,2 |
Параметри наведені за: Вилкенсхоф У., Крук И. (2007) Справочник по эхокардиографии. Медицинская литература, Москва.
Додаток 7.4
Нормальні показники максимальних швидкостей потоків у дорослих осіб
Показник | Hatle, м/с | Kisslo, м/с | Labovitz, м/с |
| MК ТК ЛК АоК ВисхАо НисхАо | 0,9 (0,6–1,3) 0,5 (0,3–1,3) 0,7 (0,6–1,3) 1,3 (1,0–1,7) | 0,9 (0,6–1,4) 0,6 (0,4–0,8) 0,7 (0,5–0,9) 1,4 (0,9–1,8) | 0,4–1,3 0,3–1,0 0,5–1,5 0,5–1,8 0,5–1,5 0,5–1,5 |
МК — мітральний клапан, ТК — трикуспідальний клапан, АоК —
аортальний клапан, ЛК — клапан ЛА, ВисхАо/НизхАо — висхідна/низхідна частина аорти.
Параметри наведені за такими джерелами:
Hatle L. (1985) Doppler Ultrasound in Cardiology. Lea&Febiger. Philadelphia.
Kisslo J. et al. (1986) Basic Doppler Echocardiography. Churchill Livingstone, New York, Edinburgh, London, Melbourne.
Labovitz A. (1988) Doppler Echocardiography. Lea&Febiger, Philadelphia.
Додаток 7.5
Нормальні значення показників потоків в аорті та ЛА у дорослих осіб
Показник | Аорта | ЛА |
| Vмакс, м/с | 0,92 (0,72–1,20) | 0,63 (0,44–0,78) |
| ET, мс | 294 (265–325) | 331 (280–380) |
| AT, мс | 98 (83–118) | 159 (160–185) |
| Середнє прискорення, м/с² | 9,40 (7,35–13,18) | 3,96 (2,70–5,15) |
| Середнє уповільнення, м/с² | 4,73 (3,90–6,30) | 3,56 (2,57–4,60) |
АТ — час прискорення потоку, ЕТ — час викиду, Vмакс — максимальна швидкість.
Параметри наведені за: Gardin J. et al. (1984) Evaluation of blood flow velocity in the ascending aorta and main pulmonary artery of normal subjects by Doppler echocardiography. Am. Heart J., 107: 310.
Додаток 7.6
Показники динаміки наповнення ЛШ у дорослих осіб
| Вік, років Мітральний клапан пік Е, м/с пік A, м/с Е/A-співвідношення DT, мс IVRT, мс | <50 0,72±0,14 0,40±0,10 1,9±0,6 179±20 76±11 | >50 0,62±0,14 0,59±0,14 1,1±0,3 210±36 90±17 |
| Легеневі вени пік S, м/с пік D, м/с пік A, м/с | 0,48±0,09 0,5±0,1 0,19±0,04 | 0,71±0,09 0,38±0,09 0,23±0,14 |
DT — час сповільнення потоку, IVRT — час ізоволюмічного розслаблення.
Параметри наведені за: Klein A., Cohen G. (1992) Doppler echocardiographic assessment of constrictive pericarditis, cardiac amyloidosis, and cardiac tamponade. Cleve Clin. J. Med., 59: 281.
Додаток 7.7
Показники динаміки наповнення ПШ у дорослих осіб
| Вік, років Тристулковий клапан Е, м/с A, м/с Е/A-співвідношення DT, мс IVRT, мс | <50 0,51±0,07 0,27±0,08 2,0±0,5 188±22 76±11 | >50 0,41±0,08 0,33±0,08 1,34+0,40 198±23 90±17 |
| Верхня порожниста вена пік S, м/с пік D, м/с пік A, м/с | 0,41±0,09 0,22±0,05 0,13±0,03 | 0,42±0,12 0,22±0,05 0,16±0,03 |
Параметри наведені за: Klein A., Cohen G. (1992) Doppler echocardiographic assessment of constrictive pericarditis, cardiac amyloidosis, and cardiac tamponade. Cleve Clin. J. Med., 59: 281.
ЛІТЕРАТУРА
1. Абдулаев Р.Я., Соболь Ю.С., Шиллер Н.Б. и др. (1998) Современная эхокардиография. Фортуна-Пресс, Харьков, 248 с.
2. Бобров В.А., Чубучный В.Н., Иванив Ю.А., Павлюк В.И. (1998) Трансторакальная эхокардиография: методика исследования и клиническая интерпретация. Дельфин, Киев, 84 с.
3. Вилкенсхоф У., Крук И. (2007) Справочник по эхокардиографии. Медицинская литература, Москва, 223 с.
4. Клінічна допплєрівська ультрасонографія (2001) За ред. Пола Л. Аллана, Пола А. Доббіса, Мирона А. Посняка та ін. Пер. з англ. Медицина світу, Львів. 293 с.
5. Коваленко В.Н., Деяк С.И. (ред.) (2004) Клиническое применение эхокардиографии: Практ. пособие для врача. Киев, 32 с.
6. Коваленко В.Н., Коношевич С.Н. (2003) Клиническая чреспищеводная эхокардиография. Мотор Сич, Запорожье, 178 с.
7. Митьков В.В. (рук.) (1996) Клиническое руководство по ультразвуковой диагностике. 2-е изд. Т. 1. Видар, Москва, 336 с.
8. Основы кардиологии: принципы и практика (2007) Под ред. Клива Розендорфа. 2-е изд. Медицина світу, Львов. 1064 с.
9. Стаднюк Л.А., Лапшин О.В., Динник О.Б., Долженко М.М. и др. (2004) Стрес-ехокардіографія: Навч. посіб., Київ, 164 с.
10. Фейгенбаум Х. (1999) Эхокардиография. Пер. с англ. под ред. В.В. Митькова. Видар, Москва, 512 с.
11. Шиллер Н., Осипов М.А. (2005) Клиническая эхокардиография. Москва, 347 с.
12. Attenhofer J.C.G., Tutina J., Mayer K. et al. (2000) Echocardiography in the evaluation of systolic murmurs of unknown cause. Am. J. Med., 108: 614–620.
13. Aurigemma G.P., Gaash W.H., Villegas B. et al. (1995) Noninvasive assessment of left ventricular mass, chamber volume, and contractile function. Curr. Probl. Cardiol., 20: 361–440.
14. Charron P., Dubourg O., Desnos M. et al. (1997) Diagnostic value of electrocardiography and echocardiography for familial hypertrophyc cardiomyopathy in a genotyped adult population. Circulation, 96: 214–229.
15. Cheitlin M.D., Armstrong W.F., Aurigemma G.P. et al. (2003) ACC/AHA/ASE 2003 guideline update for the clinical application of echocardiography: summary article — a report of the American college of cardiology. American heart association task force on practice guidelines (ACC/AHA/ASE committee to update the 1997 guidelines for the clinical application of echocardiography). J. Am. Coll. Cardiol., 42(5): 954–970.
16. Erbel R., Alfonso F., Boileau C. et al. (2001) Diagnosis and management of aortic dissection. Europ. Heart. J., 22: 1642–1681.
17. Gibler W.B., Runyon J.P., Levy R.C. et al. (1995) A rapid diagnostic and treatment center for patients with chest pain in the emergency department. Ann. Emerg. Med., 25: 1–8.
18. Mulvagh S.L., De Maria A.N., Feintein S.B. et al. (2000) Contrast echocardiography: Current and future applications. American Society of echocardiography task force on standards and guidelines for the use of ultrasonic contrast in echocardiography. J. Am. Soc. Echocardiogr., 13(4): 331–342.
19. Segar D.S., Brown S.C., Sawada S.C. et al. (1992) Dobutamine stress echocardiography: corellation with coconary lesion severity as determined by quantitative angiography. J. Am. Coll. Cardiol. 19: 1197–1202.
20. Varga A., Picano E., Dodi C. et al. (1992) Madness and method in stress echo reading. Eur. Heart. J. 20(17): 1271–1275.