Порушення реполяризації шлуночків серця: механізми виникнення, методи виявлення та клінічне значення (5000155760)
Актуальність проблеми стратифікації ризику пацієнтів із серцево-судинними захворюваннями, і, перш за все, з ІХС, зумовлена тим, що нині ця нозологічна група продовжує залишатися провідною причиною смерті у більшості розвинених країн. Важливим для прогнозу фактором є електрична нестабільність міокарда, що відображає вразливість міокарда для розвитку загрозливих для життя аритмій. Складові електричної нестабільності такі: аритмогенний субстрат (стійкий, нестійкий), що провокує фактори-тригери (шлуночкова екстрасистолія, ішемія міокарда). Негомогенна хвиля деполяризації міокарда, що виникає внаслідок порушення проведення імпульсу в зонах з вираженою ішемією міокарда, призводить до можливої багаторазової циркуляції хвилі та розвитку небезпечних для життя порушень ритму серця. Останнім часом велика увага приділяється розробці таких неінвазивних і простих маркерів аритмогенезу, як тривалість інтервалу Q–T, величина його дисперсії (dQ–T) і їх похідні.
Інтервал Q–T відображає тривалість ПД клітин міокарда (електрична систола шлуночків), включаючи як деполяризацію, так і реполяризацію, а його подовження — сповільнену й асинхронну реполяризацію міокарда шлуночків. ЕКГ записується у стані спокою на швидкості 50 мм/с, інтервал Q–T вимірюється не менше ніж у 3 послідовних циклах з обчисленням середніх значень. Не аналізують ЕКГ з нечіткою диференціацією зубця Т, з блокадою ніжок пучка Гіса, частковим і повним порушенням внутрішньошлуночкової провідності, фібриляцією передсердь. Не оцінюють величини інтервалу Q–T у комплексах екстрасистол, комплексах перед екстрасистолами та наступних за екстрасистолами. Оптимальним для вимірювання на стандартній ЕКГ спокою вважають II стандартне відведення, а у разі вираженої хвилі U або згладженості зубця Т — I стандартне чи грудне відведення V5. У загальному вигляді цей інтервал визначають як відстань між початком зубця Q (або точкою відхилення кардіограми від ізолінії після закінчення зубця P) і закінченням зубця Т і вимірюють у мілісекундах. При вимірі «вручну», найчастіше закінчення зубця Т визначають як місце перетину ізоелектричної лінії ТР і дотичної, проведеної по максимальному нахилу низхідного коліна зубця Т (класичний метод E. Lepeshkin і B. Surawicz). Тривалість інтервалу Q–T змінюється залежно від ЧСС, статі, віку, стану нейрогормональної регуляції, психоемоційного та фізичного напруження.
Електрофізіологічною основою, що визначає тривалість кінцевої частини ПД, є стан іонних каналів мембрани кардіоміоцита (переважно повільні калієві канали IK, менш значимі — IK1 та ICa).
У всіх клітин з обох боків їх мембрани існують електричні потенціали. Існування мембранних потенціалів зумовлене тим, що концентрація іонів у цитоплазмі значно відрізняється від такої в інтерстиціальній рідині й іони, що рухаються проти градієнта концентрації шляхом дифузії на напівпроникних мембранах, сприяють виникненню різниці потенціалів. Необхідно враховувати три найважливіші іони: натрій (Na+), кальцій (Са2+), концентрація яких в інтерстиціальній рідини вища, ніж всередині клітин, і калій (К+), розподіл якого протилежний. Дифузія іонів через мембрану клітини відбувається через канали, специфічні для певних іонів. На рис. 2.1 показано, як у відповідь на електричний синусовий або інший імпульс генерується ПД, що створюється спрямованим за градієнтом концентрації іонним потоком через іонні канали.
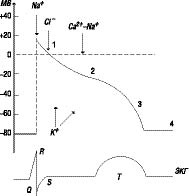
Рис. 2.1. Трансмембранний ПД
Фази ПД:
0 — фаза швидкої деполяризації (10 мс): початкова фаза порушення, активація швидких Na-каналів (іони Na+ направляються всередину клітини).
1 — фаза ранньої швидкої реполяризації: відновлення початкової полярності мембрани кардіоміоцита (перенесення іонів хлору (Cl–) всередину клітини).
2 — фаза плато: повільної реполяризації (200 мс): всередину клітини надходять іони Са2+ і Na+.
3 — кінцева частина швидкої реполяризації кардіоміоцитів: іони К+ з клітини надходять у позаклітинну рідину).
4 — потенціал спокою — діастола на ЕКГ. В останній фазі концентрація іонів К+ в 30 разів вища всередині клітини, ніж у позаклітинній рідині, а в позаклітинній рідині концентрація іонів Na+ вища у 20 разів, Са2+ — у 25 разів, завдяки чому відбувається підтримка активної функції іонних каналів.
При порушенні роботи іонних каналів (причинами можуть бути, зокрема, гіпертрофія чи ішемія м’язового волокна, порушення електролітного складу як всередині, так і поза клітиною, спрямована дія зовнішніх хімічних агентів), тривалість електричної систоли може збільшуватися, причому в ряді випадків тривалість ПД може в різних кардіоміоцитах збільшуватися по-різному, що створює умови для виникнення аритмій за типом «повторного входу». Проте на тому рівні досліджень, що доступний у клінічній практиці, ми стикаємося не з показниками електрофізіологічного стану окремих кардіоміоцитів, а з комбінованим ПД від цілої ділянки серцевого м’яза (а у разі з дискордантними відведеннями — з проекцією глобального вектора електричної осі серця, що практично виключає топографічну вибірковість у відображенні електричної активності серця). Отже, показники негомогенної реполяризації лише частково відображають електрофізіологічний статус кардіоміоцитів, великий вплив на них має стан магістральних відділів провідної системи серця та автономної нервової системи серця, питома вага фіброзної сполучної тканини у структурі ділянки міокарда (що особливо актуально за наявності рубцевих змін у міокарді) і маса ділянки фіброзу серцевого м’яза. Результати проведених досліджень демонструють зв’язок поверхово визначеної негомогенної реполяризації з різною міокардіальною патологією.Таким чином, можна вважати, що в різних ситуаціях цей показник може бути або причиною, або супутнім маркером, або наслідком патологічного стану міокарда.
Коригований інтервал Q–T (Q–Tc) — похідний показник від інтервалу Q–T. Коректне вимірювання цього інтервалу — обов’язковий компонент дослідження, необхідний для встановлення діагнозу, визначення тактики лікування, оцінки ефективності проведеної терапії.
Спроби знайти точне математичне співвідношення ЧСС і Q–T беруть початок з 1920 р., коли майже одночасно й незалежно один від одного L. Fridericia і H. Bazett запропонували використовувати практично однаковий спосіб обчислення належного значення інтервалу Q–T. Історично «вижили» дві формули H. Bazett, отримані на підставі результатів ЕКГ обстеження 39 здорових чоловіків молодого віку. Одну використовують для розрахунку належного інтервалу Q–Tд і розраховують за формулою:
Q–Tд=k√R–R,
де k — емпірично знайдений коефіцієнт, становить 0,37 для чоловіків і 0,40 — для жінок. Подовженням вважається перевищення належного значення інтервалу Q–Tд більше ніж на 0,02 с. Іншу формулу H. Bazett використовують для визначення коригованого інтервалу Q–Tc, розрахованого за формулою:
Q–Tc = Q–T/√R–R,
де Q–T і R–R — інтервали, що вимірюються на ЕКГ, Q–Tc —коригований інтервал Q–T. Зміст цього перетворення полягає от у чому: тривалість інтервалу Q–T математично прирівнюється до такої при частоті 60 скорочень за хвилину. За даним методом розрахунку Q–Tc у нормі у дорослих не має перевищувати 440 мс.
У 1985 р. P. Schwartz з використанням вищенаведеної формули (Q–Tc=Q–T/√R–R), запропонував великі й малі клініко-ЕКГ-критерії для встановлення діагнозу синдрому подовженого інтервалу Q–T (див. далі табл. 2.2).
Відносно одиниць виміру цього показника та інших інтервалів ЕКГ, які коригуються формулою H. Bazett, існує кілька різних точок зору. Відповідно до вищенаведеної формули, були запропоновані виміри в одиницях с–1, проте вимірювання у секундах і мілісекундах набагато зручніше у практичному плані й має логічне обґрунтування.
У наукових дослідженнях, крім ранніх рівнянь корекції (формула H. Bazett), використовують інші способи та формули, що ґрунтуються на рівняннях лінійної регресії (додатки 4–6).
Дисперсія інтервалу Q–T (dQ–T) показує неоднорідність шлуночкової реполяризації міокарда. Її визначають як різницю між найбільшим і найменшим значеннями інтервалу Q–T у 12 стандартних відведеннях ЕКГ:
dQ–T=Q–Tmax—Q–Tmin.
Стандартні 12 відведень ЕКГ рекомендується записувати у спокої, в денний час, при швидкості 50 мм/c на 12-канальному електрокардіографі, а інтервали Q–T вимірювати у всіх 12 (мінімум 8) відведеннях, не менше 2 у кожному. Одиниці вимірювання — мілісекунди (мс).
Коригована дисперсія інтервалу Q–T (dQ–Tc) — величина, що обчислюється при застосуванні формули визначення dQ–T до коригованих інтервалів Q–T:
dQ–Tс=Q–Tсmax—Q–Tсmin.
При дослідженні 4866 осіб різних вікових груп встановлено, що і у здорових людей, і у пацієнтів з різною кардіальною патологією при використанні автоматичного методу обробки ЕКГ верхня границя нормального значення dQ–T — 50 мс є досить достовірним критерієм. Граничне значення 50 мс, за даними D. Dabar і співавторів (1996), передбачає раптову серцеву смерть із 92% чутливістю і 43% специфічністю.
Стандартизована дисперсія Q–T (dQ–Tadj) — дисперсія Q–T, яка ділиться на квадратний корінь з використаних у підрахунку відведень (N):
dQ–Tadj = dQ–T/v.
Зміст цієї формули полягає в тому, щоб мати можливість порівнювати між собою результати аналізів ЕКГ, при яких використали різну кількість відведень. Автори методу вважають, що чим менше відведень використовувалося в обчисленнях (за технічними чи будь-якими іншими причинами), тим вища ймовірність одержання заниженого значення dQ–T. Формула тим значніше зменшує результат підрахунку, чим більше відведень використовують в аналізі. Так само цю формулу застосовують і щодо частотно коригованих показників (dQ–Tadj).
Слід відзначити, що разом з цим найпоширенішим і найбільш простим з математичної точки зору маркером негомогенної реполяризації були запропоновані й інші більш складні показники, такі як коефіцієнт варіації та стандартне відхилення значень тривалості інтервалу Q–T від його середнього значення. Одним із перспективних підходів до аналізу негомогенної реполяризації можна вважати дослідження неоднорідності морфології кінцевої частини зубця Т, але цей метод потребує наявності відповідного апаратно-програмного забезпечення.
Інтервал J–T — сучасний показник, що характеризує винятково процеси реполяризації міокарда шлуночків. На відміну від інтервалу Q–T, точкою відліку цього інтервалу є точка J (місце переходу кінцевої частини комплексу QRS у сегмент ST).
Коригований інтервал J–T (J–Tc) — похідна від інтервалу J–T, отримана за формулою:
J–Tc = J–T/√R–R,
де J–T і R–R — інтервали, що вимірюються на ЕКГ, J–Tc — коригований інтервал J–T.
Коригована дисперсія інтервалу J–T (dJ–Tc) обчислюється за формулою:
dJ–Tс = J–Tсmax—J–Tсmin.
МЕТОДИКА ВИЗНАЧЕННЯ ІНТЕРВАЛУ Q–Т І ЙОГО ДИСПЕРСІЇ. НОРМАЛЬНІ ЗНАЧЕННЯ
Інтервал Q–T і його дисперсію можуть визначати при аналізі:
- 8–12 відведень поверхневої ЕКГ;
- ортогональних відведень X, Y, Z Франка ЕКГ високого розрізнення;
- даних добового холтерівського моніторування ЕКГ.
Інтервал Q–T, його дисперсія при поверхневій ЕКГ
В основі діагностики будь-яких форм синдрому подовженого інтервалу Q–T лежить коректне вимірювання точності оцінки тривалості інтервалу Q–T. Основні труднощі зазвичай виникають при визначенні початку зубця Q і кінця зубця Т, а також за необхідності диференціації зубців T і U, при наявності останнього.
Проблема дисперсії початку комплексу QRS, що проявляється в неодночасному початку електричної систоли шлуночків у різних відведеннях, вирішується використанням такого стандарту: початком інтервалу Q–T вважають саму ранню точку комплексу QRS, що відповідає переходу ізоелектричної лінії сегмента РQ (R) у зубець Q (R).
Наступною технічною проблемою є необхідність коректного визначення закінчення зубця Т. При синусовій брадикардії, гіпокаліємії, синдромах подовженого Q–T і при деяких інших станах зубець U, зазвичай не виражений на ЕКГ, досягає амплітуди, що дорівнює амплітуді зубця Т. У ряді випадків ці два зубці настільки близько розміщені один до одного, що інтервал T–U не встигає досягти ізолінії — випадки так званого злиття T і U. У найбільш несприятливому варіанті такого злиття відсутня навіть западина між зубцями T і U, що практично виключає можливість визначити справжне закінчення зубця Т за морфологією кінцевої частини електричної систоли в одному кардіоциклі. На сьогодні ця проблема має кілька варіантів вирішення. При наявності розділової западини між зубцями T і U закінчення зубця T може бути визначено як найбільш поглиблене місце розділової западини і перетин з ізолінією, дотичною до найбільш стрімкої ділянки низхідної частини зубця Т (класичний метод Лепешкіна), або відрізка, що сполучає вершину і найбільш стрімку ділянку низхідної частини зубця Т (модифікований метод Лепешкіна), математичне продовження низхідної частини зубця Т до перетину з ізолінією у вигляді експонентної чи параболічної кривої, результат комбінованого аналізу розбитого на сегменти кардіоциклу.
У разі потреби диференціювати двофазний зубець Т або розщеплений зубець Т з апікальною виїмкою від неповного злиття зубців Т і U, використовують такі критерії (D. Pinsky і співавтори):
1) зубець U має найбільшу амплітуду у відведеннях V2—V3;
2) при багатоканальній реєстрації амплітуда зубця U у 98% випадків перебуває в межах 25% від найбільшого значення амплітуди зубця Т у всіх відведеннях і, як правило, не перевищує 50% амплітуди зубця Т у цьому ж відведенні;
3) амплітуда зубця U коливається відповідно до коливань зубця Т;
4) при порівнянні суміжних відведень зубці U у них практично не відрізняються за амплітудою і тривалістю;
5) для розділового поглиблення між зубцями Т і U типова різка зміна амплітуди;
6) тривалість розділової виїмки між зубцями Т і U зазвичай перевищує 0,15 с, тоді як відстань між вершинами розщепленого зубця Т менша цієї величини.
У разі ізоелектричного зубця Т визначити дійсну тривалість інтервалу Q–T практично неможливо, тому в аналіз відведення з подібними комплексами QRST не включаються.
Ще одна проблема пов’язана з логічним обґрунтуванням вибору відведень стандартної ЕКГ для подальшого аналізу, оскільки виникає закономірне питання: чи правомірно зіставляти результати, отримані при аналізі 12 відведень і, скажімо, 7? Чи не занижується значення дисперсії при аналізі неповного набору відведень? Компромісним можна вважати рішення, запропоноване учасниками Роттердамского дослідження, які довели, що в комплект досліджуваних відведень необхідне включення лише 8 із 12 стандартних відведень (6 прекардіальних відведень за Вільсоном і I, II за Ейнтховеном), оскільки інші відведення за Ейнтховеном і Голдбергером можуть бути отримані математичним шляхом із двох вищезазначених:
III=II–I; aVR=(I+II):2; aVL=(I–III):2; aVF=(II+III):2.
Відповідно до вищенаведеного математичного узагальнення у ролі двох стандартних відведень за Ейнтховеном можуть бути використані будь-які два — I, II і III.
Джерелом погрішності при вимірюванні дисперсії Q–T у відведеннях є також використання в аналізі неодночасно отриманих записів щодо відведень. У разі реєстрації ЕКГ на одно-, дво- або триканальному електрокардіографі відбувається змішування показників дисперсії та варіабельності Q–T, що може змінити результат виміру в непрогнозований бік.
Використання автоматизованих систем обробки ЕКГ для оцінки тривалості реполяризації міокарда та її негомогенності
Для більш точної оцінки реполяризації рекомендується використовувати динамічну ЕКГ (холтерівське моніторування).
Можна використовувати 3 псевдоортогональних відведення Франка: X, Y, Z ЕКГ високого розрізнення, які дозволяють проводити більш адекватну автоматичну калькуляцію тривалості інтервалу Q–T, уникати додаткових перешкод, використовувати інші можливості для аналізу серцевого циклу (оцінка дисперсії реполяризації та ППШ).
У зв’язку з обмеженою кількістю відведень, постуральних змін, дислокації електродів, артефактів і маловивченого впливу добових коливань вегетативної регуляції ритму серця на динаміку інтервалу Q–T, його оцінка при холтерівському моніторуванні складніша, ніж на ЕКГ спокою. Проте багатьма авторами показана перевага цього методу, пов’язана з можливістю автоматичного аналізу близько 100 тис. інтервалів R–R і Q–T (Q–Тmax, Q–Тmin, Q–Тc), вимірюваних в основному у відведенні СМ5 (V5).
У ряді досліджень продемонстрована висока кореляція між тривалістю інтервалу Q–T, вимірюваного одночасно на стандартній ЕКГ і при холтерівському моніторуванні ЕКГ. Так, у роботі J. Christiansen і співавторів виміри проводили «вручну» двома незалежними експертами у відведеннях V1 і V5 у 14 хворих віком 4–36 років при швидкості запису 25 мм/с. Всього проаналізовано 100 пар вимірюваних інтервалів Q–T. При порівнянні двох методів виміру, особливо у відведенні V5, відзначена висока кореляція: r від 0,872 до 0,988. При аналізі результатів холтерівського моніторування ЕКГ інтервал Q–T максимальний (Q–Тmax), мінімальний (Q–Тmin), коригований (Q–Тc), вимірюють в основному у відведенні СМ1 (V5). Аналізуючи результати 650 вимірів Q–T з 18 холтерівських стрічок, P. Laguna і співавтори одержали відмінності між значеннями інтервалу Q–T при автоматичному та «ручному» вимірюванні в середньому на 2,417 мс. R. Baranowski та співавтори, аналізуючи результати автоматичного визначення тривалості Q–T інтервалу при холтерівському моніторуванні ЕКГ у здорових і пацієнтів із кардіальною патологією, вивчили відтворюваність вимірювання цього показника. Виявилося, що вона найбільш виражена в діапазонах ЧСС 75–80 і 95–100 уд./хв.
При холтерівському моніторуванні ЕКГ багато дослідників застосовують оцінку dQ–T за аналізом двох стандартних каналів запису — СМ1 і СМ5. На жаль, на сьогодні відсутні єдині критерії оцінки допустимих значень dQ–Tc у пацієнтів з ІХС при аналізі записів холтерівського моніторування ЕКГ. N. McLaughlin і співавтори (1996) порівняли у своїй роботі чотири алгоритми для автоматизованих систем, що найчастіше використовуються: простий і диференційний граничний (threshold) методи, метод перехоплення низхідної кривої зубця Т (slope intercept) і метод продовження відрізка між верхівкою та точкою дотику спадної кривої зубця Т з ізолінією (peak slope intercept). Перші два методи визначають кінець хвилі Т як місце її останнього перетину з деяким граничним рівнем, що підбирається емпірично залежно від рівня шумів і ступеня посилення сигналу. Інші два алгоритми — модифікації тангенціального методу. В результаті встановлено, що похибка при використанні цих алгоритмів у пацієнтів із кардіальною патологією була у 2 рази вищою, ніж у здорових осіб, що автори пояснюють більш низьким середнім значенням амплітуди зубця Т у 1-й групі. Також отримана більш висока вірогідність при використанні тангенціального методу. I. Savelieva і співавтори (1998) при дослідженні здорових добровольців, хворих, які перенесли ІМ, і пацієнтів із ГКМП граничний метод використовували лише для виключення з аналізу відведень з недостатньою амплітудою зубця Т. У подальшому закінчення зубця Т визначали алгоритмом підбору найменшого квадрата (least-square fitting), а верхівку зубця Т — методом регіонального центрування (regional centering). При аналізі подібним методом серій ЕКГ того самого пацієнта і подальшій статистичній обробці результатів всіх пацієнтів отримано досить низький коефіцієнт варіабельності (до 2%) як прояв високої відтворюваності методу. Цими ж авторами проведено порівняння результатів автоматичного та мануального аналізу ЕКГ.
Цікаві одержані дані про добові ритми дисперсії dQ–T, отримані при холтерівському моніторуванні ЕКГ. Виявлене достовірне збільшення дисперсії інтервалу dQ–T вночі та в ранкові години, що, ймовірно, і підвищує ризик раптової смерті в цей час у осіб із різними серцево-судинними захворюваннями (ішемія та ІМ, СН тощо).
Фізіологічні фактори (вік, стать, нейроендокринна система, фізичне навантаження, маса тіла, охолодження), що впливають на процеси реполяризації шлуночків
Клінічні та експериментальні роботи свідчать про те, що величина інтервалу Q–T і його дисперсія залежать від статі обстежуваного. За даними стандартної ЕКГ спокою у жінок довший інтервал Q–Tc, менша дисперсія цього інтервалу dQ–Tc, менша амплітуда і тривалість зубця Т, ніж у чоловіків. Під час фізичного навантаження при підвищенні ЧСС Q–T-інтервал стає довшим у жінок порівняно з чоловіками, тобто є більш постійною величиною. Можливо, саме цим можна пояснити більш високий ризик виникнення torsade de pointes на фоні прийому антиаритмічних препаратів, здатних подовжувати цей інтервал, і більш часті проаритмогенні ефекти цієї групи препаратів у жінок. Подібні відмінності можуть бути пов’язані з впливом естрогену та прогестерону, а також особливостями вегетативної нервової системи у осіб жіночої статі.
Статеві відмінності тривалості й дисперсії інтервалу Q–T стають помітними у пубертатний період, максимально виражені у віці 24–25 років і знову нівелюються до 70-річного віку. Зміни тонусу нейроендокринної регуляції серця виявляють при холтерівському моніторуванні ЕКГ, коли в добовому циклі відбувається постійна зміна рівня фізичної та емоційної активності, здійснюються складні перебудови функціональних систем організму при переході від сну до активності.
Значення дисперсії dQ–T у період вагітності (36–40 тиж) перевищують показники здорових жінок. Відзначено наявність достовірної позитивної кореляції між дисперсією Q–T і масою тіла. Хоча підвищення цього показника у важкоатлетів пов’язують із фізіологічною гіпертрофією міокарда ЛШ, характерною для спортсменів.
Встановлено вплив охолодження організму на негомогенність процесів реполяризації шлуночків у бік значного підвищення цього показника.
СИНДРОМ ПОДОВЖЕНОГО ІНТЕРВАЛУ Q–T: КЛАСИФІКАЦІЯ, ЕТІОЛОГІЯ, ПАТОГЕНЕЗ, ДІАГНОСТИКА
Класифікація синдрому подовженого інтервалу Q–T. Історія відкриття
Встановлено, що як вроджені, так і набуті форми подовження інтервалу Q–T є предикторами фатальних порушень ритму, які, в свою чергу, призводять до раптової смерті хворих. Існує кілька критеріїв, закладених в основу класифікації подовження інтервалу Q–T:
Набуте подовження інтервалу Q–T
1. Гостре:
а) отруєння речовинами, що мають кардіотоксичну дія (плюмбум, арсен, гідраргірум) і сповільнюють процес реполяризації шлуночків:
— антиаритмічними препаратами (хінідину сульфат, дизопірамід, прокаїнамід, аміодарон, соталол, аймалін);
— психотропними засобами (амітриптилін, хлорпромазин);
— адреноміметиками (сальбутамол, фенотерол);
— артеріальними вазодилататорами (дигідропіридини, фентоламін);
— антибіотиками (еритроміцин, галофантрин, хлорохін);
— антигістамінними засобами (астемізол, терфенадин);
— діуретиками (фуросемід);
— прокінетиками (метоклопрамід, цизаприд);
б) гостре порушення електролітного балансу (гіпокаліємія, гіпокальціємія, гіпомагніємія) внаслідок застосування діуретиків;
в) порушення з боку ЦНС:
— травма головного мозку;
— субарахноїдальний крововилив;
— пухлина;
— тромбоз;
— емболія;
г) гострий ІМ;
д) інфекційний чи алергічний міокардит.
Відповідно до рекомендацій Асоціації кардіологів України з профілактики раптової кардіальної смерті неінвазивними провісниками пірует-тахікардії внаслідок проаритмогенної дії препаратів є тривалість інтервалу Q–T >600 мс, подовження інтервалу Т–U, наявність T-alternans (коливання конфігурації та амплітуди зубця Т), зміна конфігурації T–U у постекстрасистолічному комплексі, а також наявність маленьких піруетів (torsadelets).
2. Хронічне:
а) хронічні захворювання серцево-судинної системи (різні форми ІХС, АГ, ДКМП, ГКМП, застійна СН, пролапс мітрального клапана, вроджені вади серця);
б) патологічні стани, не пов’язані з первинним ураженням серця (цукровий діабет, ХОХЛ, термінальна стадія ХНН, хвороба Бехчета, неврогенна анорексія, низькобілкова дієта, хронічний алкоголізм, остеогенна саркома, карцинома легені, сімейний періодичний параліч, отрута скорпіонів, синдром Конна, феохромоцитома, гіпотермія, ваготонія).
Вроджене подовження інтервалу Q–T
1. За етіологією: спадкові форми: синдром Джервелла — Ланге-Нільсена (поєднання нападів втрати свідомості й раптової смерті з вродженою глухонімотою) і синдром Романо — Уорда (без вродженої глухонімоти).
2. За клінічними проявами:
— синкопе + подовження інтервалу Q–T (38%);
— ізольоване подовження інтервалу Q–T (40%);
— синкопе без подовження інтервалу Q–T (11%);
— прихована форма — латентний перебіг синдрому (11%).
3. Молекулярно-генетичні варіанти синдрому подовженого інтервалу Q–T (табл. 2.1).
Таблиця 2.1 Молекулярно-генетичні варіанти синдрому подовженого інтервалу Q–T
Варіант | Локалізація | Ген | Білковий продукт |
LQ–T1 | 11p15.5 | KCNQ1 (KvLQ–T1) | α-субодиниця калієвого каналу |
LQ–T2 | 7q35–36 | HERG | α-субодиниця калієвого каналу |
LQ–T3 | 3p21–24 | SCN5A | натрієвий канал |
LQ–T4 | 4q25–27 | ||
LQ–T5 | 21q22.1–22 | KCNE1 (MinK) | β-субодиниця калієвого каналу |
LQ–T6 | 21q22.1–22 | KCNE2 (MiRP 1) | β-субодиниця калієвого каналу |
JLN1 | 11p15.5 | KCNQ1 | α-субодиниця калієвого каналу |
JLN2 | 21q22.1–22 | KCNE1 | β-субодиниця калієвого каналу |
Історія відкриття синдрому, найбільш імовірно, починає відлік із 1856 р., коли T. Meissner описав раптову смерть під час стресової ситуації людини молодого віку, у родині якого ще двоє дітей померли за аналогічних обставин. Лише через 100 років, у 1957 р. A. Jervell і F. Lange-Nielsen надали повний клінічний опис синдрому подовженого інтервалу Q–T у чотирьох членів однієї родини з вродженою глухотою, частими нападами втрати свідомості та стійким подовженням інтервалу Q–T на ЕКГ. Незабаром C. Romano (1963) і O. Ward (1964) навели спостереження аналогічного синдрому, але без вродженої глухоти. Відтоді відомі два варіанти спадкового синдрому подовженого інтервалу Q–T: Романо — Уорда (аутосомно-домінантний і аутосомно-рецесивний) і Джервелла — Ланге-Нільсена. В останньому випадку подовження Q–T поєднується із вродженою глухотою.
Поширеність
Встановлено, що синдром Романо — Уорда визначають у популяції з частотою 1:10 000, а в дитячому віці 1:5000–1:7000. Синдром Джервелла — Ланге-Нільсена — найрідша патологія. За даними G. Fraser, цей синдром відзначали в популяції 4–10-річних дітей Об’єднаного Королівства з частотою 1,6 на 1 млн. За даними J. Bricker (1984), синдром подовженого інтервалу Q–T з високою частотою виявляють у осіб із пароксизмальними станами, а у дітей із вродженою глухотою — близько 0,8%. При обстеженні груп пацієнтів із кардіогенними синкопальними станами синдром відзначали у 36% випадків. Є дані щодо високої частоти виявлення патологічного подовження інтервалу Q–T при супутньому ЕКГ-обстеженні.
Етіологія та патогенетичні механізми спадкового синдрому подовженого інтервалу Q–T
Етіологія синдрому донедавна залишалася не повністю вивченою, хоча виявлення захворювання у декількох членів однієї родини дозволило практично з моменту першого опису розглядати його як спадкову патологію. В патогенезі синдрому подовженого інтервалу Q–T провідна роль належить кільком основним гіпотезам. Одна з них — гіпотеза симпатичного дисбалансу припускає порушення правобічної симпатичної іннервації серця з перевагою лівосторонніх симпатичних впливів. Проте як основна існує гіпотеза внутрішньосерцевих аномалій, яка погоджується з теорією про патологію іонних каналів. Мутації в генах, відповідальних за розвиток синдрому подовженого інтервалу Q–T, призводять до порушення функціонування іонних каналів (калієвого чи натрієвого) і збільшення тривалості ПД у кардіоміоциті, що полегшує появу ранніх або пізніх післядеполяризацій і, таким чином, поліморфної шлуночкової тахікардії типу пірует (torsades de pointes). За механізмом розвитку шлуночкових тахікардій всі вроджені синдроми подовженого інтервалу Q–T виділяють у групу адренергічно залежних (шлуночкова тахікардія у цих хворих розвивається на фоні підвищеного симпатичного тонусу), тоді як синдроми набутого подовження інтервалу Q–T становлять групу паузозалежних (шлуночкова тахікардія, переважно піруетна, виникає після подовженого інтервалу R–R у вигляді декількох повторень патерну, що прискорюється, «довгий R–R — короткий R–R»). Розподіл цей досить умовний, оскільки є дані про наявність, наприклад ідіопатичного паузозалежного синдрому подовженого Q–T. Крім того, зареєстровані випадки, коли прийом медикаментів призводить до маніфестації безсимптомного раніше вродженого синдрому подовженого інтервалу Q–T.
Критерії діагностики
У 1985 р. P. Schwartz запропонував застосовувати діагностичні критерії, які були доповнені в 1993 р.:
Великі:
- подовження Q–Tc >440 мс на ЕКГ спокою;
- синкопе;
- випадки виявлення подовження Q–T у родині.
Малі:
- вроджена глухота;
- альтернація зубця Т;
- низька ЧСС;
- порушення процесу реполяризації міокарда шлуночків.
Синдром подовженого інтервалу Q–T діагностують за наявності двох великих або одного великого і двох малих критеріїв. Існує також бальна система для встановлення діагнозу синдрому подовженого інтервалу Q–T (табл. 2.2). При сумі ≤1 бал діагноз малоймовірний; 2–3 бали — середня вірогідність синдрому подовженого інтервалу Q–T; >4 балів — висока вірогідність цього діагнозу.
Таблиця 2.2 Діагностичні критерії синдрому подовженого інтервалу Q–T відповідно до бальної системи (Schwartz P., 1985)
Критерій | Бал |
Електрокардіографічний | |
Q–Tc >480 мс | 3 |
Q–Tc >460–470 мс | 2 |
Q–Tc >450 мс | 1 |
Тахікардія типу «пірует» | 1 |
Альтернація зубця Т | 1 |
Двогорбий зубець Т як мінімум у 3 відведеннях | 1 |
Брадикардія (відповідно до віку) | 0,5 |
Клінічний | |
Синкопальні стани, що провокуються стресом | 2 |
Синкопальні стани без стресу | 1 |
Вроджена глухота | 0,5 |
Випадки реєстрації синдрому подовженого інтервалу Q–T у родині | 1 |
Випадки раптової смерті невстановленої етіології у членів родини у віці молодше 30 років | 0,5 |
За відсутності можливості проведення молекулярно-генетичних досліджень досі клінічна діагностика залишається найбільш точною і надійною. При цьому найважчий саме перший крок — підтвердження наявності спадкового синдрому подовженого інтервалу Q–T у пробанда. Подальша діагностика у сумнівних клінічних випадках полегшена у зв’язку з високою імовірністю повторних випадків в уражених родинах. Синкопе — найбільш загальний прояв синдрому, вперше виникає в віці 5–15 років, у чоловіків частіше, ніж у жінок. Вік, у якому з’являється перший синкопе, має прогностичне значення — якщо у віці до 5 років, — це визначає тяжку форму хвороби, а якщо синкопе реєструють на 1-му році життя, то це асоціюється з надзвичайно поганим прогнозом. Наявність зупинки серця в анамнезі підвищує в 13 разів ризик зупинки серця чи раптової коронарної смерті надалі, що є твердою мотивацією для використання кардіовертера-дефібрилятора у цієї категорії хворих. При аналізі факторів, провокуючих синкопе, встановлено, що практично у 40% хворих їх реєструють на фоні сильного емоційного збудження (гнів, страх). Приблизно у 50% випадків напади провокуються фізичним навантаженням (крім плавання), у 20% дітей — плаванням, у 15% вони відбуваються під час пробудження від нічного сну, у 5% — як реакція на різкі звукові подразники (телефонний дзвінок, дзвінок у двері тощо). Таким чином, емоційне збудження та фізична активність рівною мірою є аритмогенними факторами для дітей із синдромом подовженого інтервалу Q–T.
ЕКГ має нерідко вирішальне значення в діагностиці основних клінічних варіантів синдрому. Збільшення тривалості інтервалу Q–T більше ніж на 50 мс щодо нормальних значень для даної ЧСС має навести дослідника на думку щодо виключення синдрому подовженого інтервалу Q–T. Практика свідчить, що за винятком дітей раннього віку, при спадковому синдромі подовженого інтервалу Q–T цей інтервал, як правило, завжди >400 мс. У сумнівних випадках необхідно диференціювати первинне та вторинне подовження Q–T за допомогою аналізу інших маркерів ранньої коронарної смерті. Величина інтервалу Q–T на ЕКГ спокою у пацієнтів із синкопальною формою захворювання коливається від 400 до 650 мс. У осіб із безсинкопальною формою синдрому тривалість цього інтервалу вірогідно менша і в середньому становить 440–450 мс.
Холтерівськое моніторування дозволяє встановити значення максимальної тривалості інтервалу Q–T, що не має перевищувати:
- 400 мс — у дітей раннього віку;
- 460 мс — у дітей дошкільного віку;
- 480 мс — у дітей шкільного віку;
- 500 мс — у дорослих.
Слід зазначити, що критерії подовження інтервалу Q–T (за даними холтерівського моніторування ЕКГ) не входять у діагностичні критерії, запропоновані P. Schwartz (1985; 1993).
Аналіз предикторів синкопе та раптової смерті у хворих із синдромом подовженого інтервалу Q–T показав, що в дитячому віці маркери ризику дещо відрізняються від таких у дорослих. Так, якщо ризик раптової смерті при синдромі вищий серед жінок, то за даними клініки Федерального дитячого центру діагностики та лікування порушень ритму серця (Росія, Москва), найбільш злоякісний перебіг синдрому в дитячому віці відзначають саме у хлопчиків. Неінформативним у дітей є інтервал Q–Tc >460 мс, оскільки може відзначатися не лише у всіх дітей із синкопе, але і в 90% — без синкопе. Крім того, відносна рідкість виявлення у дітей шлуночкової екстрасистолії на ЕКГ спокою затрудняє використання цієї ознаки як предиктора раптової смерті при цьому способі реєстрації.
Досі стратифікація ризику головним чином ґрунтується на наявності в анамнезі синкопальних епізодів, torsade de pointes (фібриляція-тріпотіння шлуночків) або зупинки серця. Тривалість коригованого інтервалу Q–T >600 мс — більш слабкий предиктор виникнення основних проявів. Таким чином, моніторування основних клініко-електрофізіологічних маркерів ризику ранньої коронарної смерті при синдромі подовженого інтервалу Q–T дозволяє вчасно призначити лікування і уникнути ускладнень, проводити профілактику загрозливих для життя аритмій у осіб із латентною і безсинкопальною формами захворювання.
СИНДРОМ УКОРОЧЕНОГО ІНТЕРВАЛУ Q–T
Протягом останніх 10 років укорочення інтервалу Q–Tc розглядають у хворих з ідіопатичною шлуночковою тахікардією. Існує дві форми цього синдрому:
1) постійна, ЧСС не впливає;
2) транзиторна, що визначається у зв’язку із сповільненням ритму серця. Зумовлена:
— генетичними порушеннями;
— гіпертермією;
— підвищенням вмісту кальцію чи калію у плазмі крові;
— ацидозом;
— порушенням тонусу автономної нервової системи.
Клінічні прояви цього синдрому такі: серцебиття, перебої в роботі серця, запаморочення, втрата свідомості, наявність у родині випадків раптової смерті в молодому віці, починаючи з самого раннього дитячого віку. Захворювання відзначають у осіб чоловічої та жіночої статі, успадковується за аутосомно-домінантним типом.
Молекулярно-генетичні порушення у цих хворих реєструють у міокарді шлуночків і передсерді. Тому у них виявляють як шлуночкові, так і надшлуночкові порушення ритму.
Критерії діагностики синдрому вкороченого інтервалу Q–T:
— тривалість інтервалу Q–Tc ≤300 мс;
— сімейні випадки раптової смерті в молодому віці;
— наявність вкороченого інтервалу Q–Tc у деяких членів родини;
— вкорочення рефрактерних періодів передсердь і шлуночків, які виявляють за допомогою внутрішньосерцевої електрокардіостимуляції;
— зниження порогу фібриляції передсердь і шлуночків під час програмованої електрокардіостимуляції.
На сьогодні обґрунтованим методом лікування вважається лише імплантація кардіовертера-дефібрилятора.
ІНТЕРВАЛ Q–T, ДИСПЕРСІЯ Q–Т У ПАЦІЄНТІВ З ІХС ІЗ ШЛУНОЧКОВИМИ АРИТМІЯМИ
Ішемія і Q–T
У дослідженні з вивчення діагностичного та прогностичного значення інтервалу Q–T, його дисперсії (dQ–T) у осіб з ІХС (Сычев О.С., Епанчинцева О.А., 2005) показано, що у хворих на стенокардію напруження II–III ФК збільшення дисперсії коригованого інтервалу Q–T >50 мс може служити маркером ішемії міокарда з вірогідно високою специфічністю. Збільшення dQ–Tc при стресовому тестуванні на висоті навантаження >50% початкового рівня — діагностична ознака ІХС. А у тому разі, якщо позитивними виявляються 2 критерії тесту (депресія сегмента ST >1 мм і підвищення dQ–Tc при навантаженні >50%) специфічність тесту різко зростає (96,6%). A. Demir і співавтори (2001) виявили, що між кількістю уражених коронарних артерій у осіб з ІХС і значенням dQ–Tc існує позитивна кореляція (r=0,49; p<0,0001). Крім того, за даними роботи О. Швеця (1998), при катетеризації серця хворим з установкою біполярного водія ритму відзначено, що ступінь зміни dQ–T пов’язаний зі ступенем тяжкості ІХС.
Інтервал Q–T і нестабільна стенокардія
У дослідженні B. Sredniawa і співавторів (2000) показано, що у осіб з ІХС із нестабільним перебігом аналіз неоднорідності шлуночкової реполяризації дозволив виділити пацієнтів з високим ризиком ранньої коронарної смерті. При цьому не виявлено високої асоціації dQ–Tc з розвитком ІМ і необхідністю ургентної реваскуляризації міокарда у обстежуваних хворих.
За даними роботи О.С. Сичова, О.А. Єпанчинцевої (2005), у осіб з ІХС із шлуночковими аритміями (n=193) провісником її несприятливого перебігу (нестабільної стенокардії) може бути інтервал Q–Tc >440 мс, а предикторами розвитку великих кардіальних подій (кардіальної смерті, що включає раптову кардіальну смерть, нефатальний ІМ) у цих хворих може бути подовжений коригований інтервал Q–Tc (>440 мс) і збільшена дисперсія dQ–Tc (>50 мс). Ці дані підтверджують результати дослідження зв’язку збільшення негомогенної реполяризації з наявністю ішемії при нестабільній стенокардії, причому показник dQ–T корелював у цій роботі з рівнем специфічного для ішемії міокарда тропоніну Т у плазмі крові (Ashikaga T., 1998).
Інтервал Q–T, його дисперсія у хворих на ІМ
У дослідженні Н. Parikka та співавторів (1999) показано швидке зменшення dQ–T і частоти шлуночкових аритмій на фоні внутрішньовенної інфузії сульфату магнію в гострій фазі ІМ. Автори не виявили впливу на вищезазначені зміни локалізації інфаркту, різниці за частотою ішемічних епізодів і за показниками варіабельності серцевого ритму між пацієнтами, у яких застосовували магній, і контрольною групою. Це дозволяє припустити, що однією з основних причин негомогенної реполяризації та наявності шлуночкових аритмій у цієї категорії хворих є електролітний дисбаланс, що розвивається місцево в зоні інфаркту. В дослідженнях, проведених за участю великої кількості хворих на ІМ з нормальним та зниженим значенням ФВ ЛШ (<40%) не встановлено чіткого зв’язку між підвищеним значенням dQ–T у ранній період інфаркту та кардіальною смертністю, проте такий зв’язок виявлено для показників dQ–T у підгострий період (1 міс з моменту розвитку захворювання). Встановлене достовірне зменшення dQ–T на 10-ту добу ІМ при проведенні ефективної тромболітичної терапії, причому цей показник був значно вищим при ураженні передньої міжшлуночкової гілки лівої коронарної артерії, тобто при передній локалізації ІМ.
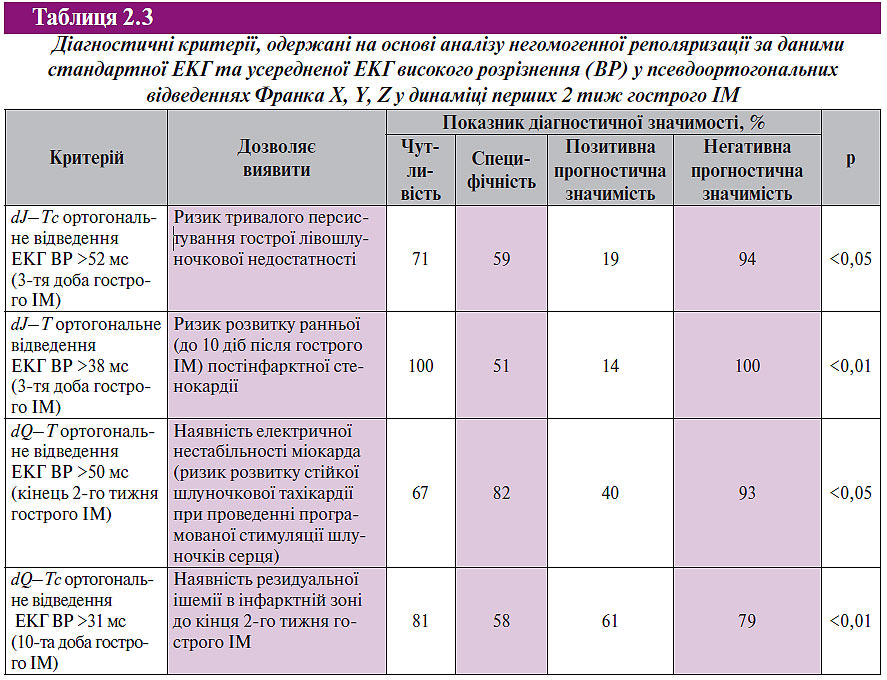
У роботі О.М. Пархоменка, О.В. Шумакова (2003) отримані дані про відсутність подібної динаміки щодо тривалості самого інтервалу Q–T, не виявлено достовірного зв’язку між dQ–T у підгострий період ІМ та локалізацією порушень коронарного кровотоку. На підставі аналізу негомогенної реполяризації за даними стандартної ЕКГ та усередненої ЕКГ високого розрізнення у псевдоортогональних відведеннях Франка X, Y, Z у хворих протягом перших 2 тиж гострого ІМ було запропоновано діагностичні критерії несприятливого перебігу гострого періоду ІМ (табл. 2.3).
Інтервал Q–T, його дисперсія у хворих із постінфарктним кардіосклерозом
При аналізі дисперсії в різні терміни після перенесеного ІМ виявили, що низькі значення dQ–Tc пов’язані зі збереженою функцією ЛШ, водночас як прогресуюче підвищення показника негомогенної шлуночкової реполяризації асоціюється з дилатацією ЛШ, порушенням систолічної та діастолічної функцій ЛШ. Таким чином, у осіб з ІХС, які перенесли ІМ, відзначають збільшення dQ–Tc як в гострий період, так і через 1 рік, що свідчить про порушення процесів реполяризації у цієї категорії хворих.
Дослідження С. Schneider та співавторів (1997) dQ–T <70 мс із чутливістю 83% і специфічністю 71% дозволило виділити хворих, у яких відновлення коронарного кровотоку в постінфарктний період зумовило виражене поліпшення насосної функції ЛШ.
У дослідженнях продемонстроване значне зниження негомогенної реполяризації як у найближчий, так і у віддалений термін після реваскуляризації міокарда, виявлені значно вищі початкові показники і більш виражена динаміка зниження dQ–T у хворих, проведення ангіопластики у яких було ускладнене розвитком летальних аритмій. Рестенозування асоціювалося з підвищенням, а повторна ангіопластика — зі зниженням значень dQ–T.
Шлуночкові аритмії та процеси реполяризації в міокарді
Негомогенність процесів реполяризації в міокарді шлуночків — причина його електричної нестабільності. Окремі ділянки міокарда перебувають в різних фазах як де-, так і реполяризації, створюючи умови для появи додаткових вогнищ збудження, що і є субстратом для виникнення небезпечних для життя аритмій і ранньої коронарної смерті. Дані про достовірний зв’язок між індукцією шлуночкової тахікардії та подовженням інтервалу Q–T з підвищенням його дисперсії, отримані в дослідженнях, підтверджують цінність цих показників як неінвазивних маркерів шлуночкових аритмій. Встановлено, що у осіб із шлуночковою екстрасистолією II–IV класу за B. Lown згідно з даними добового моніторування ЕКГ значення інтервалів Q–Tmax, Q–Tmin, Q–Tc і dQ–Tc були вірогідно більшими порівняно із хворими без шлуночкових порушень ритму. Частота виникнення епізодів нестійкої шлуночкової тахікардії вища у осіб із подовженим інтервалом Q–Tс (Сычев О.С., Епанчинцева О.А., 2005). На відміну від пацієнтів із хронічною формою ІХС, у осіб із гострим ІМ предикторна цінність часових параметрів інтервалу Q–T із розпізнавання потенційно небезпечних порушень ритму серця значно зростала. Чутливість і специфічність збільшеної dQ–T при її граничному значенні ≥50 мс становили 82,2 і 85,8% відповідно. При граничному значенні даного показника >70 мс чутливість зростала до 88,1%, а специфічність — до 94,5%.
Встановлено, що у осіб з ІХС подовження коригованого інтервалу Q–Tс >440 мс у комбінації зі зниженням варіабельності серцевого ритму <100 мс можна розглядати як предиктори розвитку шлуночкових аритмій і кардіоваскулярних подій.
Діагностична цінність подовження інтервалу Q–Tc >440 мс і збільшення dQ–Tc >50 мс для оцінки ризику виявлення шлуночкових аритмій IV класу за B. Lown протягом 4 років відповідно становить: чутливість 24 і 23%, специфічність — 86 і 91%, позитивна прогностична значимість — 37 і 74%, негативна прогностична значимість — 77 і 50%.
ІНТЕРВАЛ Q–Т І СУПУТНІ ЗАХВОРЮВАННЯ (АГ, ЦУКРОВИЙ ДІАБЕТ)
Багато робіт вказують на прогностичну цінність подовженого інтервалу Q–Tc і збільшеної dQ–Tc за чутливістю щодо шлуночкових аритмій та ранньої коронарної смерті пацієнтів з ІХС і АГ. Прогресування АГ асоціюється зі збільшенням тривалості інтервалу Q–Tc, ступенем варіабельності ритму серця. Наявність підвищеного АТ, включаючи початковий період АГ «білого халата», супроводжується рядом несприятливих електрофізіологічних змін у міокарді ЛШ, які асоціюються з гіпертрофією міокарда та дисфункцією регуляції вегетативної нервової системи, мають достовірний зв’язок з віком і ступенем тяжкості захворювання. L. Oikarinen та співавтори (2001) показали, що ріст індексу маси міокарда ЛШ, незалежно від типу гіпертрофії, асоціювався з високими значеннями тривалості й дисперсії інтервалу Q–T. Таким чином, встановлено високу частоту виникнення шлуночкових аритмій III–IV класу за B. Lown і високу частоту ранньої коронарної смерті серед пацієнтів з надмірною масою тіла і зміненою геометрією ЛШ.
Моніторування інтервалу Q–T рекомендується як додатковий специфічний тест діагностики діабетичної вегетативної кардіальної нейропатії. У роботі І.Е. Сапожнікової зі співавторами (2001) найвищі показники дисперсії інтервалу Q–T відзначені у хворих на цукровий діабет II типу. З наростанням вираженості метаболічних порушень розширюється спектр факторів, що впливають на посилення гетерогенності реполяризації, досягаючи максимуму при поєднанні АГ і цукрового діабету. Було виявлено чітку кореляцію порушень ритму серця з дисперсією інтервалу Q–Tc, а збільшення дисперсії інтервалу Q–T у пацієнтів із цукровим діабетом як I, так і II типу асоціюється лише з дисфункцією автономної нервової системи. Це підтверджується кореляцією між збільшенням негомогенної реполяризації та наявністю автономної нейропатії за даними радіоізотопних досліджень.
C. Cardoso та співавтори (2003) встановили, що подовжений Q–Tc (>470 мс) є незалежним предиктором гострого порушення мозкового кровообігу у хворих на цукровий діабет II типу (HR=2,2–2,9; 95% ДІ=1,1–6,0).
Q–T, ХСН І ДКМП
На підставі проспективного дослідження хворих на СН (Barr C., 1994) зроблено висновок, що dQ–T >79 мс вірогідно виділяє із загальної групи пацієнтів із високим ризиком ранньої коронарної смерті. У хворих на СН і ГЛШ існує взаємозв’язок між збільшенням dQ–T і схильністю до розвитку шлуночкових аритмій. Робота М. Galinier та співавторів (1998) показала достовірний зв’язок збільшення dQ–T із загальною та раптовою кардіальною смертю, аритмічними епізодами у хворих на ДКМП, тоді як при СН, спричиненій ІХС, збільшення dQ–T не дозволило виокремити пацієнтів високого ризику із загальної групи. Крім того, відзначено зменшення dQ–T при лікуванні СН антагоністами альдостерону.
Sakabe і співавтори (2001), порівнюючи прогностичну значимість збільшення дисперсії Q–T і зміненої морфології зубця Т щодо розвитку небезпечних для життя шлуночкових аритмій у пацієнтів із ДКМП, пропонують використати змінену морфологію зубця Т як цінний маркер аритмогенної готовності (чутливість — 100%, специфічність — 35%, позитивна прогностична значимість — 54%, негативна прогностична значимість — 100%).
Q–T І ГКМП
За даними багатьох досліджень виявлено, що великі значення Q–T, dQ–T асоціювалися з несприятливим прогнозом у хворих на ГКМП; проте чіткої кореляції між dQ–T і ранньою коронарною смертю не встановлено. Великі значення dQ–T (як абсолютні, так і кориговані) відзначають у хворих на ГКМП порівняно зі здоровими, а також у пацієнтів з наявністю тяжких шлуночкових порушень ритму порівняно з особами без аритмій. У дослідженні H. Elming (2001) у пацієнтів із СН IIА стадії та більше і зниженою систолічною функцією ЛШ проведене проспективне спостереження 1319 хворих протягом 18 міс. Граничне значення dQ–T становило 70 мс. При цьому аналіз виживаності не виявив прогностичного значення dQ–Tc щодо загальної (OR=1,0; 95% ДІ=1,00–1,00; p=0,74), кардіальної (OR=1,0; 95% ДІ=1,00–1,01; p=0,55) або аритмічної смертності (OR=1,0; 95% ДІ=0,99–1,01; p=0,38). Незважаючи на це, відмінність у величині показника dQ–T між хворими на ГКМП і здоровими особами підтверджується результатами різних авторів, проте не встановлено, чи є дисперсія інтервалу Q–T лише електрофізіологічним феноменом, що супроводжує цю патологію, або ж маркером, на підставі якого можна прогнозувати можливі аритмічні ускладнення у цих пацієнтів.
ПРОГНОСТИЧНА ЗНАЧИМІСТЬ ІНТЕРВАЛУ Q–T І ЙОГО ДИСПЕРСІЇ
У цілому ряді проспективних досліджень показана прогностична роль значення інтервалу Q–T (440 мс). У Нідерландах у проспективному дослідженні осіб без кардіальної патології (1991) встановлено взаємозв’язок між тривалістю інтервалу Q–T і ризиком ранньої коронарної чи серцево-судинної смерті протягом 28-річного спостереження. В іншому нідерландському дослідженні (1994) виявлено, що чоловіки з інтервалом Q–T >420 мс мали більш високий ризик серцево-судинної смертності порівняно з чоловіками, у яких Q–T <420 мс. Надалі 28-річне спостереження нідерландських державних службовців показало, що при Q–T >440 мс істотно підвищувалася серцево-судинна смертність з OR=2,1 (1998). Результати дослідження італійських вчених (2002), що включало 1357 пацієнтів з ІХС і цукровим діабетом II типу, свідчать, що Q–Tc >440 мс і dQ–Tc >80 мс можуть використовувати для стратифікації ризику осіб з ІХС. Так, у дослідженні H. Elming (1998) тривалістю 11 років брали участь 3455 пацієнтів. При цьому виявлено, що коригований інтервал Q–Tc >440 мс вказував на підвищення ризику смерті від серцево-судинних захворювань у 8 разів. Подальші роботи підтвердили наявність збільшеної dQ–T у реанімованих хворих порівняно з адекватною контрольною групою. Також відзначено, що циркадний ритм, що описує варіабельність інтервалу Q–T і його дисперсії в контрольній групі, був порушений у пацієнтів із ранньою коронарною смертю в анамнезі. Дані субаналізу Роттердамского (1998) дослідження загальної популяції свідчать, що збільшення dQ–T >60 мс у людей похилого віку є достовірним предиктором кардіальної смерті.
Дослідниками відділу аритмій серця Інституту кардіології ім. Н.Д. Стражеско АМН України у 2005 р. встановлено прогностичне значення інтервалу Q–T і його дисперсії dQ–T у 193 хворих зі стенокардією напруження, що пройшли проспективне 4-річне спостереження. У пацієнтів із розвитком великих кардіальних подій (кардіальної смерті, ІМ) протягом тривалого 4-річного спостереження значення Q–Tc і dQ–Tc суттєво перевищували нормальний граничний рівень і вірогідно відрізнялися від групи пацієнтів із відносно сприятливим перебігом ІХС. Також встановлено, що частка хворих із Q–Tc ≥440 мс і dQ–Tc ≥50 мс була вірогідно більшою у групі з розвитком кардіальної смерті та/чи нелетального ІМ. Частота розвитку великих кардіальних подій наростала з підвищенням показника коригованого інтервалу Q–Tc: при значенні Q–Tc <440 мс великі кардіальні події розвилися лише у 8,3% хворих, при Q–Tc=440–449 мс — у 17,4% хворих, при Q–Tc=450–469 мс — у 33,3%, а при Q–Tc >470 мс — у 62,5% пацієнтів (p<0,005).
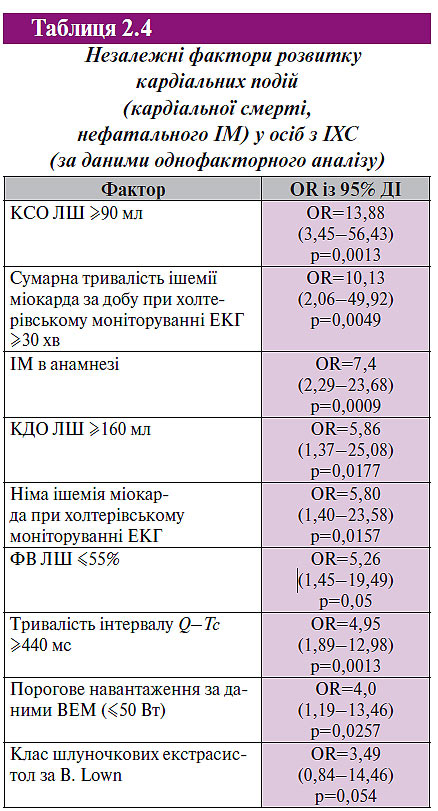
Проранжировано загальновідомі фактори ризику розвитку несприятливого прогнозу у хворих обстежених груп. Для виміру значення незалежних предикторів обчислювали величину співвідношення шансів (OR) з 95% довірчим інтервалом (ДІ) (табл. 2.4). Показники розміщені в порядку зниження їх інформативності. Інтервал Q–Tc ≥440 мс не є найбільш прогностично значимим. Проте його роль досить велика серед наведених факторів ризику розвитку великих кардіальних подій.
У роботі J. Perkiomaki та співавторів (2001) протягом 10-річного проспективного спостереження 330 пацієнтів віком старше 65 років збільшення дисперсії Q–Tc >70 мс зумовлювало ріст загальної смертності (OR=1,38; 95% ДІ=1,02–1,86), ранньої коронарної смерті (OR=2,7; 95% ДІ=1,29–5,73), а в комбінації з показниками ГЛШ ризик розвитку ранньої коронарної смерті різко зростав (OR=16,52; 95% ДІ=3,37–80,89).
Результати 6-річного дослідження AIREX (1999), що включало 605 пацієнтів у гострий період ІМ, ускладненого СН, свідчать, що збільшена дисперсія інтервалу dQ–Tс (>100 мс) при однофакторному (OR=1,07; 95% ДІ=1,03–1,10; p=0,001) і багатофакторному (OR=1,05; 95% ДІ=1,01–1,09; p=0,022) аналізах може бути незалежним предиктором ризику загальної смертності, але з низькою чутливістю даного ЕКГ-маркера, що обмежує його застосування для стратифікації ризику пацієнтів із різними формами ІХС із шлуночковими аритміями.
У табл. 2.5 показана прогностична значимість інтервалу Q–Tc ≥440 мс і dQ–Tc ≥50 мс для оцінки ймовірності розвитку великих коронарних подій протягом 4 років.
Таблиця 2.5 Чутливість, специфічність, прогностична значимість Q–Tc і dQ–Tc для оцінки вірогідності розвитку великих кардіальних подій (кардіальної смерті, ІМ) протягом 4 років
Показник | Чутливість, % | Специфічність, % | Позитивна прогностична значимість, % | Негативна прогностична значимість, % |
Q–Tc ≥440 мс | 31 | 92 | 56 | 80 |
dQ–Tc ≥50 мс | 18 | 91 | 70 | 46 |
Отримані результати свідчать про необхідність найбільш раннього виявлення факторів ризику, використання інтервалу Q–Tc і його дисперсії для стратифікації ризику хворих стенокардією напруження I–III ФК із шлуночковими аритміями.
ІНТЕРВАЛ Q–T, ЙОГО ДИСПЕРСІЯ ТА ВАРІАБЕЛЬНІСТЬ СЕРЦЕВОГО РИТМУ
Зниження адаптації інтервалу Q–T до добових змін ЧСС розглядається як патологія й асоціюється з підвищеним ризиком розвитку фібриляції шлуночків. Слід зазначити, що у хворих із трансплантованим серцем і редукуванням вегетативних впливів на серце різниці між денною та нічною динамікою інтервалу Q–T не виявлено. Інформація щодо тривалості адаптації Q–T до ЧСС (Q–T/R–R) може також служити неінвазивним маркером порушень автономної регуляції серця. Збільшення Q–T/R–R у хворих у постінфарктний період відображає схильність до шлуночкової тахікардії. У пацієнтів із фібриляцією шлуночків в анамнезі без органічної патології, незважаючи на нормальні показники варіабельності серцевого ритму, відзначають збільшення dQ–T і Q–T/R–R, особливо вночі та вранці.
Знижена варіабельність ритму серця є індикатором зміни вегетативної інервації серця, що може зумовлювати раптовий початок шлуночкових аритмій, але не є специфічним маркером аритмогенного субстрату. І навпаки, подовжений Q–Tc, що відображає сповільнену й асинхронну реполяризацію міокарда шлуночків, і збільшена дисперсія dQ–Tc, що відображає негомогенну шлуночкову реполяризацію, є електрофізіологічним субстратом появи тригерної активності внаслідок ранніх слідових деполяризацій і виникнення механізму re-entry, і, як наслідок, появи шлуночкових аритмій.
РОЛЬ ЛІКАРСЬКИХ ЗАСОБІВ У ВИНИКНЕННІ НАБУТОГО СИНДРОМУ ПОДОВЖЕНОГО ІНТЕРВАЛУ Q–T
Обсяг споживання лікарських засобів в економічно розвинених країнах постійно збільшується, разом з тим з’являється все більше повідомлень про кардіотоксичність препаратів різних фармакотерапевтичних груп. Список лікарських препаратів, застосування яких може призвести до подовження інтервалу Q–T, наведено у табл. 2.6.
Таблиця 2.6 Лікарські засоби, здатні викликати подовження інтервалу Q–T
Антиаритмічні | IA клас — хінідин, прокаїнамід, дизопірамід, аймалін IB клас — лідокаїн, априндин, мексилетин IC клас — флекаїнід, енкаїнід, пропафенон III клас — соталол, аміодарон, бретилію тозилат, дофетилід, сематилід, ібутилід, азимілід IV класс — бепридил |
Серцево-судинні | Епінефрин, ефедрин, вінпоцетин |
Антигістамінні | Астемізол, терфенадин, дифенгідрамін, ебастин, гідроксизин |
Антибіотики й сульфаніламіди | Еритроміцин, кларитроміцин, азитроміцин, спіраміцин, кліндаміцин, ко-тримоксазол, антраміцин, даунорубіцин, епірубіцин, пентамідин (внутрішньовенно), тролеандоміцин |
Антималярійні | Галофантрин |
Три- і тетрациклічні антидепресанти | Амітриптилін, нортриптилін, іміпрамін, доксепін, мапротилін, фенотіазин, хлорпромазин, флувоксамін |
Нейролептики | Галоперидол, хлоралгідрат, дроперидол, пімозид |
Антагоністи серотоніну | Кетансерин, зимелідин |
Гастроентерологічні | Цизаприд |
Діуретики | |
Протигрибкові | Кетоконазол, флуконазол, ітраконазол |
Інші препарати | Кокаїн, пробукол, папаверин, аденозину фосфат, лідофлазин, теродилін, бепридил, будипін, вазопресин, препарати літію |
Отруєння | Гідраргірум, органотропні інсектициди |
У ході сучасних досліджень виявлено наявність 3 типів клітин у міокарді шлуночків: епі-, ендокардіальних і М-клітин, які відрізняються тривалістю ПД. На відміну від інших видів М-клітини характеризуються невеликим сповільненням пізнього К+ току і значним сповільненням току іонів Na+ і натрій-кальцієвого обміну. Ці відмінності іонних потоків лежать в основі подовження ПД і появи пізніх деполяризацій, особливо під час терапії антиаритмічними засобами III класу, в той час як проаритмогенна дія препаратів IA класу асоціювалася зі збільшенням дисперсії dQ–T. Збільшення тривалості ПД М-клітин призводить до появи дисперсії реполяризації в міокарді шлуночків, які C. Antzelevitch і J. Fish пропонують оцінювати за поверхневою ЕКГ як інтервал між вершиною і закінченням зубця Т.
Антиаритмічний препарат дизопірамід, що досить часто використовується у клінічній практиці, у високих дозах пригнічує швидкі калієві канали, які кодуються геном HERG, що може бути молекулярною основою набутого синдрому подовженого інтервалу Q–T. Аналогічно аймалін, похідне раувольфії, що застосовується для купірування тахікардії з широкими комплексами QRS, здатний подовжувати інтервал Q–T і провокувати шлуночкову тахіаритмію. Підвищена чутливість HERG до антиаритмічних препаратів III класу, протигрибкових або антигістамінних засобів, антибіотиків групи макролідів також відповідальна за виникнення аритмій.
Жіноча стать — додатковий чинник ризику появи шлуночкових тахіаритмій. Експериментально встановлена здатність жіночих статевих гормонів (естрогену і прогестерону) моделювати процеси реполяризації in vivo. Подовження коригованого Q–Tc на фоні інфузії ібутиліду виявлено саме в першу фазу менструального циклу. Передбачається, що замісна терапія прогестинами в період менопаузи може нормалізувати реполяризацію різних відділів шлуночка.
Особливу небезпеку становить наявність декількох факторів ризику розвитку набутого синдрому подовженого інтервалу Q–T. Одночасне застосування антибіотиків, антигістамінних і протигрибкових препаратів (див. табл. 2.6) значно підвищує ризик розвитку небезпечних для життя аритмій. У табл. 2.7 наведено предиктори проаритмогенної дії антиаритмічних препаратів.
ЛІКУВАННЯ ХВОРИХ ІЗ СИНДРОМОМ ПОДОВЖЕНОГО ІНТЕРВАЛУ Q–T
Існують основні напрямки терапії хворих із синдромом подовженого інтервалу Q–T:
- запобігання нападів шлуночкової тахіаритмії;
- купірування цих нападів;
- реанімаційні заходи при виникненні фібриляції шлуночків чи асистолії.
Для здійснення такої терапії використовують лікарські засоби, хірургічні методи, електролікування.
Існують особливості ведення пацієнтів із поліморфною шлуночковою тахіаритмією залежно від тривалості інтервалу Q–T (пірует-тахікардія) (схема 2.1).

Схема 2.1. Особливості ведення пацієнтів із поліморфною шлуночковою тахіаритмією залежно від тривалості інтервалу Q–T (за Kowey P.R. et al., 1999)
Загальновизнаною вважається терапія блокаторами β-адренорецепторів у високих дозах (у дітей до 2 мг/кг/добу). Позитивний ефект цих препаратів зумовлений блокадою симпатичних впливів на серце та зниженням ступеня дисперсії реполяризації міокарда шлуночков, що попереджає напади небезпечних для життя аритмій.
На сьогодні розробляється генспецифічна терапія синдрому подовженого інтервалу Q–T. Так, блокатори β-адренорецепторів найбільш ефективні при 1-му типі синдрому подовженого інтервалу Q–T, при 2-му — препарати калію, при 3-му — блокатори натрієвих каналів (мексилетин). Новим лікарським засобом для лікування хворих з 1-м і 2-м типом вродженого синдрому подовженого інтервалу Q–T є нікорандил, що сприяє відкриттю АТФ-чутливих калієвих каналів кардіоміоцитів. Але, на жаль, реальних можливостей обстежити хворих за допомогою методів генетичної діагностики для підбору генспецифічної терапії немає.
Використовують комбінації блокаторів β-адренорецепторів з препаратами магнію (сульфат магнію), калію та блокаторами натрієвих каналів (мексилетин, флекаїнід).
За наявності у хворого, який переніс синкопе або стан клінічної смерті, тривожності, схильності до акцентування уваги на своїх відчуттях, іпохондричних страхів, можна додати до лікування короткі курси (не більше 1 міс) терапії транквілізаторами (діазепам, феназепам).
При неефективності медикаментозного лікування цим хворим проводять імплантацію електрокардіостимуляторів (мінімальна ефективна частота кардіостимуляції для запобігання torsade de pointes становить ≥70 уд./хв), які працюють у режимах ААIR, VVIR, DDDR, або кардіовертерів-дефібриляторів у поєднанні з прийомом блокаторів β-адренорецепторів (табл. 2.8). Показанням для імплантації електрокардіостимулятора є виражена брадикардія у період між нападами, частіше при 3-му типі вродженого синдрому подовженого інтервалу Q–T (при цьому генетичному варіанті вродженого синдрому подовженого інтервалу Q–T з підвищенням ЧСС інтервал Q–T стає коротшими і знижується ризик розвитку небезпечних для життя аритмій).

У хворих із вродженим синдромом подовженого інтервалу Q–T при непереносимості або неефективності блокаторів β-адренорецепторів, відсутності ефекту від електрокардіостимулятора і неможливості імплантування кардіовертера-дефібрилятора виконують ліву шийно-грудну симпатичну ганглійектомію, що усуває симпатичний дисбаланс іннервації серця. Рекомендований рівень симпатектомії: Т1–Т4 і зірчастий ганглій або його нижня третина. Однак існують відомості про те, що цей метод при високій ефективності в ранній термін після операції призводить до рецидиву захворювання у віддалений період.
Відповідно до рекомендацій Асоціації кардіологів України блокатори β-адренорецепторів є препаратами вибору для профілактики (первинної та вторинної) ранньої коронарної смерті у хворих із синдромом подовженого інтервалу Q–T.
Невідкладна допомога при раптовій зупинці кровообігу проводиться за загальноприйнятими методиками.
ЛІТЕРАТУРА
- Antzelevitch C., Dumaine R. (2002) Electrical heterogeneity in the heart: physiological, pharmacological and clinical implications. Handbook of electrophysiology: The Heart. Eds. E. Page, H. Fozzard, R.G. Solaro. N.Y.: Oxford University press, р. 654–692.
- Antzelevitch C., Fish J. (2001) Electrical heterogeneity within the ventricular wall. Basic Res Cardiol., 96 (6): 517–527.
- Balser J.R. (1998) The Long QT Syndrom: Basic Cardiac Electrophysiology: What the Fellow and Practicing Clinical Electrophysiologist Should Know I: Molecular and Ionic Basis of Arrhythmias: Pharmacology of Cardiac Ion Channels. G. V. Nacarelly. 19th Annual Scientific Sessions Hihglights, Program Chair. NASPE, May 6–9.
- Belhassen B., Glick A., Viskin S. (2004) Efficacy of quinidine in high-risk patients with Brugada syndrome. Circulation, 110 (13): 1731–1737.
- Bonnemeier H., Hartmann F., Wiegand U.K.H. et al. (2000) Course and prognostic implicatios of QT interval and QT interval variability afterprimary coronary angioplasty in acute myocardial infarction. JACC, 37 (1): 44–50.
- Chevalier P., Rodriguez C., Bontemps L. et al. (2001) Non-invasive testing of acquired long QT syndrome: Evidence for multiple arrhythmogenic substrates. Cardivasc Res., 50 (2): 386–398.
- Gadaleta F.L., Llois S.C., Sinisi V.A. et al. (2008) [Corrected QT interval prolongation: a new predictor of cardiovascular risk in patients with non-ST-elevation acute coronary syndrome]. Rev. Esp. Cardiol., 61 (6): 572–578.
- Hisamatsu K., Kusano K.F., Morita H. et al. (2004) Relationships between depolarization abnormality and repolarization abnormality in patients with Brugada syndrome: using body surface signal-averaged electrocardiography and body surface maps. J. Cardiovasc. Electrophysiol., 15 (8): 870–876.
- Hong K., Brugada J., Oliva A. et al. (2004) Value of electrocardiographic parameters and ajmaline test in the diagnosis of Brugada syndrome caused by SCN5A mutations. Circulation, 110 (19): 3023–3027.
- Hu D., Viskin S., Oliva A. (2007) C.Genetic predisposition and cellular basis for ischemia-induced ST-segment changes and arrhythmias. J. Electrocardiol., 40 (6 Suppl.): S26–29.
- Kanki H., Yang P., Xie H.G. et al. (2002) Polymorphisms in beta-adrenergic receptor genes in the acquired long QT syndrome. J. Cardiovasc. Electrophysiol., 13 (3): 252–256.
- Masaki N., Takase B., Matsui T. (2006) QT peak dispersion, not QT dispersion, is a more useful diagnostic marker for detecting exercise-induced myocardial ischemia. Heart Rhythm., 3 (4): 424–432.
- McNair W.P., Ku L., Taylor M.R. et al.; Familial Cardiomyopathy Registry Research Group (2004) SCN5A mutation associated with dilated cardiomyopathy, conduction disorder, and arrhythmia. Circulation, 110 (15): 2163–2167.
- Morita H., Zipes D.P., Fukushima-Kusano K. et al. (2008) Repolarization heterogeneity in the right ventricular outflow tract: correlation with ventricular arrhythmias in Brugada patients and in an in vitro canine Brugada model. Heart Rhythm., 5 (5): 725–733.
- Nishida K., Fujiki A., Mizumaki K. et al. (2004) Canine model of Brugada syndrome using regional epicardial cooling of the right ventricular outflow tract. J. Cardiovasc. Electrophysiol., 15 (8): 936–941.
- Ortega-Carnicer J., Benezet J., Calderon-Jimenez P. et al. (2008) Hypothermia-induced Brugada-like electrocardiogram pattern. J. Electrocardiol. Jun 3.
- Schwartz P.J., Priori S.G., Spazzolini C. et al. (2001) Genotype-phenotype correlation in the long-QT syndrome: genespecific triggers for life-threatening arrhythmias. Circulation., 103: 89–95.
- Sreeram N., Simmers T., Brockmeier K. (2004) The brugada syndrome. Its relevance to paediatric practice. Z. Kardiol., 93 (10): 784–790.
- Tanabe Y., Inagaki M., Kurita T. et al. (2001) Sympathetic stimulation produces a greater increase in both transmural and spatial dispersion of repolarization in L QT1 then L QT2 forms of congential long-QT syndrome. J. Amer. Cool. Cardiol., 37: 911–919.
- Towbin J.A. (2004) Molecular genetic basis of sudden cardiac death. Pediatr Clin North Am., 51 (5): 1229–1255.
- Vitasalo M., Oikarinen A., Swan H. et al. (2006) Effects of beta-blocker therapy on ventricular repolarization documented by 24-th electrocardiography on patients with type 1 long-QT syndrome. Amer. Coll. Cardiology, 48: 747–753.
- Watanabe H., Chinushi M., Hao K. et al. (2004) Postprandial Variations in ST-Segment in a Patient with Brugada Syndrome and Partial Gastrectomy. Pacing Clin Electrophysiol., 27 (11): 1560–1562.
- Yamaguchi M., Shimizu M., Ino H. et al. (2003) T wave peak-to-end interval and QT dispersion in acquired long QT syndrome: a new index for arrhythmogenicity. Clin. Sci., 105: 671–676.