Пухлини серця (5000155700)
Пухлини серця — рідкісні захворювання з поліморфною клінічною картиною. Перше згадування про пухлини серця відноситься до 1559 р., коли M.R. Columbus при патологоанатомічному дослідженні виявив новоутворення в ЛШ.
Епідеміологія
Дані по поширеності первинних пухлин серця, що найбільш часто виявляють, наведені в табл. 14.1. Рідкісний розвиток пухлин серця пояснюється особливостями метаболізму міокарда, кровотоком усередині серця та обмеженістю лімфовідтоку.
Таблиця 14.1 Первинні пухлини серця, що найчастіше виявляють
| Пухлина | Розповсюдженість, % |
| Доброякісні: | |
| міксома | 24–50 |
| ліпома | 8 |
| папілярна фіброеластома | 8 |
| рабдоміома | 7–20 |
| фіброма | 3 |
| гемангіома | 3 |
| тератома | 3 |
| мезотеліома АV-вузла | 2 |
| Злоякісні: | |
| ангіосаркома | 33 |
| рабдоміосаркома | 20 |
| мезотеліома | 4 |
| фібросаркома | 10 |
| лімфома | 1 |
Класифікація
Загальноприйнятої класифікації пухлин серця не існує. Новоутворення серця поділяють на первинні (0,1%) і вторинні (6%). Первинні пухлини поділяють на доброякісні (75%) і злоякісні (25%). Пухлини серця, які найчастіше виявляють, див. у табл. 14.1.
Клінічна картина
Зумовлена ураженням міокарда і перикарда. При ураженні міокарда часто реєструють порушення серцевого ритму та провідності: синусову тахікардію, екстрасистолічну аритмію, пароксизмальну форму фібриляції передсердь, повну AV-блокаду серця. Ураження перикарда можуть проявлятися ексудативним або констриктивним перикардитом, тампонадою серця.
Виникнення СН у більшості випадків зумовлено як внутрішньопорожнинними утвореннями, що викликають гемодинамічні порушення у зв’язку зі зміною припливу крові або відтоку її з уражених камер серця, так і великим неопластичним ураженням самого міокарда, що призводить до порушення насосної функції серця.
Прижиттєва діагностика пухлин серця надзвичайно тяжка у зв’язку з відсутністю патогномонічних ознак, а також з можливістю їх безсимптомного перебігу.
ПЕРВИННІ ДОБРОЯКІСНІ ПУХЛИНИ
МІКСОМА СЕРЦЯ
Визначення
Міксома серця — первинна внутрішньопорожнинна гістологічно доброякісна пухлина, що найчастіше локалізується в порожнині лівого (75%) (рис. 14.1) або правого (20%) (рис. 14.2) передсердя, дуже рідко — у шлуночках серця.

Рис. 14.1. Міксома лівого передсердя, в діастолу переміщується в порожнину ЛШ. В-режим, апікальна чотирикамерна позиція

Рис. 14.2. Міксома правого передсердя. В-режим, апікальна чотирикамерна позиція
Епідеміологія
Відзначають у пацієнтів будь-якого віку, найчастіше віком 30–60 років. Результати аналізу даних 1195 хворих, прооперованих з приводу міксоми, свідчать, що новоутворення частіше розвивається у жінок (67%), ніж у чоловіків (33%).
Етіологія
Етіологія міксоми не з’ясована. Припускають, що клітини пухлини розвиваються з ембріональної мукоїдної тканини або ендотелія з наступною міксоматозною дегенерацією. Менше 5% міксом становлять компонент міксомного комплексу — аутосомно-домінантного синдрому, відомого як синдром Карні, що включає міксому серця та позасерцеві прояви: патологічну пігментацію шкіри, кальцифікуючі тестикулярні пухлини, шкірні міксоми, пігментну гіперплазію коркового шару надниркових залоз, пухлини щитовидної залози.
Патологічна анатомія
Міксома — солітарне, рідше множинне новоутворення округлої або овальної форми, що не поширюється далі субендокардіальних шарів серця. Макроскопічно міксоми мають два різновиди: напівпрозора, безбарвна желатинозна по консистенції, фіксована до стінки серця більш-менш широкою основою; або округла щільна маса, що звисає на ніжці (80%). Зовнішній вигляд пухлини нагадує поліп або виноградне гроно діаметром від 5 мм до 8–12 см із крупно- або дрібнозернистою поверхнею, її маса може досягати 250 г. Поверхня пухлини блискуча, капсула чітко виражена. Кольори можуть варіювати від зеленувато-сірого до жовтувато-коричневого, пухлина желеподібна або значно рідше еластичної консистенції. У самій пухлині можуть бути виявлені дистрофічні зміни — некрози, крововиливи, рідше відбувається звапнення.
Гістологічна будова міксоми неоднорідна. Основна субстанція (матрикс) представлена аморфною оксифільною речовиною, у якій розсіяні клітини пухлини веретеноподібної форми з круглим або овальним ядром, чітким ядерцем, які іноді утворють синцитіальні групи, формуючи сигароподібні та кільцеподібні структури або тісно оточуючі судини капілярного типу. Пухлинні клітини за ультраструктурою нагадують ендотеліальні і можуть брати участь у формуванні судин. Гістологічно часто виявляється фіброзне потовщення ендокарда, стулок AV- клапанів і нижньої частини передсердя, що зумовлено відкладенням фібрину на поверхні ендокарда та збільшенням кількості колагенових та еластичних волокон у зв’язку з постійним тертям тіла пухлини по ендокарду. При вираженому кальцинозі міксоми відзначається деструкція стулок AV-клапанів.
Патологічна фізіологія
Міксома лівого передсердя звужує мітральний отвір, зумовлює обструкцію легеневих вен, що призводить до легеневої венозної гіпертензії та АГ, а також до вторинної правошлуночкової СН.
Якщо міксома пролабує в ЛШ, то в ранню систолу вона рухається від шлуночка до передсердя, викликаючи в останньому значне підвищення тиску, у ранню діастолу пухлина «провалюється» у порожнину шлуночка, що сприяє різкому зниженню внутрішньопередсердного тиску. Якщо пухлина не пролабує і перешкоджає проходженню крові через AV-отвір в діастолу, то гемодинаміка схожа на таку, як при мітральному або трикуспідальному стенозі з уповільненим кровотоком через отвір у діастолу.
Пухлина правого передсердя стенозує правий AV-отвір, може утрудняти відтік з порожнистих вен, що призводить до появи системної венозної гіпертензії.
Пухлина ЛШ звужує його вихідний тракт, імітуючи обструктивну кардіоміопатію. Правошлуночкова міксома може стенозувати устя легеневого стовбура.
Клінічна картина
При аускультації у фазу ранньої або середньої діастоли вислуховується низькочастотний шум, названий пухлинним хлопком (tumor plop), що виникає внаслідок різкої зупинки пухлини при ударі її об стінку шлуночка або фіброзне кільце мітрального клапана на початку діастоли. Міксома правого передсердя часто маніфестує емболією ЛА, що може бути причиною летального кінця. При обтурації кровотоку на рівні тристулкового клапана можливі судоми та інші розлади функції ЦНС або раптова смерть.
Системні прояви, що відзначаються у 90% хворих, включають зменшення маси тіла, міалгію, м’язову слабкість, артралгію, лихоманку, анемію, підвищення ШОЕ, кількості лейкоцитів і концентрації IgG. Як правило, ці симптоми зникають після видалення пухлини.
У 50% хворих внаслідок фрагментації пухлини розвиваються системні емболічні ускладнення. Емболія коронарних артерій може призводити до гострого ІМ. Першою ознакою міксоми може бути емболія периферичних судин. Внутрішньочерепна аневризма внаслідок емболізації виникає рідко, але є серйозним ускладненням. Природа цієї аневризми не з’ясована, однак повідомлялося про гістологічну верифікацію міксомних клітин у стінці артерії.
Виділяють основні клінічні симптоми, на підставі яких можна запідозрити або діагностувати міксому серця:
- раптова поява клінічних ознак вади серця (шумів) у хворого без ревматичного анамнезу, які змінюються при зміні положення тіла (внаслідок зміщення пухлини відносно клапана);
- швидкий розвиток серцево-судинної недостатності без видимих причин, резистентної до терапії;
- невелика тривалість захворювання порівняно з ревматичними вадами серця, прогресуючий перебіг і несподівані «ремісії»;
- виникнення емболій периферичних судин або судин легень на фоні синусового ритму, особливо у людей молодого віку;
- задишка або короткотривала втрата свідомості, артеріальна гіпотензія, тахікардія, що з̓ являється раптово без видимих причин (виникають при обтурації міксомою клапанних отворів);
- перебіг захворювання під маскою інфекційного ендокардиту: лихоманка невідомого походження, анемія, підвищення ШОЕ, незважаючи на лікування антибіотиками.
Діагностика
Зміни ЕКГ розвиваються у 20–40% хворих, вони неспецифічні, включають фібриляцію або тріпотіння передсердь і блокаду лівої ніжки пучка Гіса. Ступінь вираженості змін залежить від величини стенозу, зумовленого пухлиною. При міксомах передсердь відзначають ознаки гіпертрофії передсердь, рідше шлуночків.
Особливістю рентгенологічної картини при міксомі лівого передсердя, якщо порушення гемодинаміки відповідають мітральному стенозу, є відсутність вибухання вушка лівого передсердя, порожнина лівого передсердя розширена менше, ніж при мітральному стенозі. При звапненні міксоми на рентгенограмах — кальциноз.
Метод ехоКГ дозволяє верифікувати діагноз. Пухлина лівого передсердя викликає появу «хмарини» ехосигналу між стулками мітрального клапана в діастолу шлуночків, у систолу його виявляють у порожнині лівого передсердя (див. рис. 14.1). При лінійному скануванні протягом серцевого циклу можна простежити рух «хмарини» з лівого передсердя в ЛШ і назад. Пухлина спотворює характер кривої руху передньої стулки мітрального клапана, викликаючи деформацію діастолічного руху, і призводить до зміщення цієї стулки до міжшлуночкової перегородки (рис. 14.3).
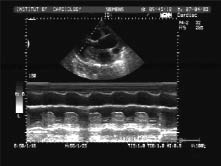
Рис. 14.3. Міксома лівого передсердя. М-режим
Щільна гладка капсула міксоми дає чіткі контури відбитого ехосигналу, тоді як у пухлинних мас без оболонки нечіткий контур. При двомірній ехоКГ міксому виявляють у порожнинах серця у вигляді більш світлого утворення на темному фоні, рух пухлини візуалізується протягом усього серцевого циклу.
Ангіокардіографія отримала широке розповсюдження в діагностиці міксом серця. Характерним симптомом є стійкий дефект наповнення округлої форми з рівними і гладкими контурами, що обтікається кров’ю з контрастом.
При неможливості встановити точний діагноз за допомогою ехоКГ проводять КТ або МРТ для визначення країв пухлини та виключення пухлинної інфільтрації (рис. 14.4а, б).
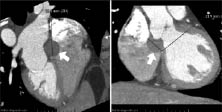
Рис. 14.4. Міксома передсердя. Мультиспіральна КТ: а) зріз по осі серця; б) фронтальний зріз
Для підтвердження діагнозу «міксома» необхідне гістологічне дослідження всіх хірургічно видалених емболів.
Лікування
Хірургічне видалення міксоми є єдиним радикальним методом лікування, відстрочку операції варто вважати грубою помилкою. У більшості оперованих пацієнтів наступає значне поліпшення стану або повне одужання, госпітальна смертність мінімальна.
Важливою є ідентифікація близьких родичів з документованим міксомним синдромом, оскільки емболізація — основне ускладнення міксом, особливо сімейних пухлин.
Прогноз
Тривалість захворювання міксомою різна. У хворих зі спорадичними пухлинами сприятливий прогноз з 1% рецидивів, проте близько в 10% випадків із сімейними міксомами відзначають рецидив пухлини або розвиток іншої пухлини з іншою локалізацією. При відсутності лікування у 30% хворих з міксомою наступає раптова смерть, інші причини смерті — СН або емболії.
ЛІПОМА СЕРЦЯ
Визначення
Ліпома серця — доброякісна пухлина, що утворюється з жирової тканини, розвивається в будь-якому віці. Найчастіше являє собою солітарне утворення, що розташовується в будь-якому відділі серця, але частіше в ЛШ, правому передсерді або міжшлуночковій перегородці.
Патологічна анатомія
Макроскопічно характерна вузлувата форма пухлини розміром від 1 до 15 см у діаметрі з чітко вираженою капсулою. Маса ліпоми може досягати >2 кг. Пухлина може розташовуватися внутрішньоміокардіально (25%) або субепікардіально (25%), але частіше субендокардіально (50%). Мікроскопічно складається з типових жирових клітин і зрідка містить фіброзну тканину (фіброліпома), м’язову тканину (міоліпома), кровоносні судини. Характерні різні розміри жирових клітин і часточок, наявність ембріональних жирових клітин.
Деякі дослідники виділяють патологію, названу ліпоматозною гіпертрофією міжпередсердної перегородки, що є скоріше гіперплазією первинної жирової тканини, ніж істиною неоплазмою. Являє собою неінкапсульовану масу жирової тканини, розташовану під ендокардом міжпередсердної перегородки. Утворення має коричневе забарвлення, розміри від 1 до 8 см у діаметрі, частіше розташовано попереду від овальної ямки з боку правого передсердя, але також може поширюватися на область AV-вузла. Гістологічно ліпоматозна гіпертрофія міжпередсердної перегородки представлена різним співвідношенням зрілих та ембріональних жирових клітин, фіброзною тканиною та вогнищами хронічного запалення, переважно у вигляді скупчення лімфоцитів і плазматичних клітин.
Клінічна картина
Звичайно інтрамуральні ліпоми безсимптомні, але можуть бути виявлені порушення ритму серця, передсердно-шлуночкової або внутрішньошлуночкової провідності, ознаки зниження скорочувальної здатності серця. Субендокардіальні пухлини проявляються симптомами, що відповідають їх локалізації, у той час як субепікардіальні пухлини можуть викликати здавлювання серця та випіт у перикард.
У випадку утворення ліпоматозної гіпертрофії міжпередсердної перегородки можуть виникати порушення ритму, застійна СН або раптова смерть.
Прогноз
До 25% хворих помирають раптово, що пов’язано з різними порушеннями ритму серця.
ПАПІЛЯРНА ФІБРОЕЛАСТОМА
Визначення
Папілярна фіброеластома — доброякісна пухлина серця, що проростає з ендокарда, може розташовуватися в будь-якому відділі серця, але найчастіше уражує клапанний апарат (рис. 14.5).
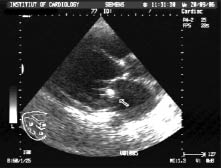
Рис. 14.5. Фіброеластома фіброзного кільця мітрального клапана. В-режим, парастернальна позиція, довга вісь
Патологічна анатомія
При мікроскопічному дослідженні виявляють множинні відростки до ендокарда або безпосередньо до одного з клапанів серця діаметром 3–4 см. У дорослих частіше уражується аортальний клапан. Гістологічно пухлина покрита ендотелієм, який оточує центральну частину (серцевину) пухлини, що складається із щільної сполучної тканини, включає матрикс із кислих мукополісахаридів, еластичні волокна та гладком’язові клітини. Гістогенез пухлини невідомий.
Прогноз
У більшості випадків пухлина безсимптомна, її випадково виявляють при аутопсії. У деяких випадках наступає раптова смерть.
РАБДОМІОМА СЕРЦЯ
Визначення
Рабдоміома — доброякісна внутрішньом’язова пухлина, розвивається найчастіше у дітей віком молодше 15 років. Рабдоміома може локалізуватися у будь-якому відділі серця, крім клапанного апарату, найчастіше — у шлуночках, часто має внутрішньопорожнинний характер росту.
Вперше описана F. Recklinghausen у 1862 р. У 30–50% випадків рабдоміома супроводжується туберозним склерозом кори головного мозку, а також множинними аденомами і аденофіброліпомами нирок та аденомами шкіри.
Етіологія
Етіологія рабдоміоми дотепер не встановлена. Існують припущення, що вона походить із міобластів або атипових клітин Пуркіньє або є ознакою вродженого порушення вуглеводного обміну.
Патологічна анатомія
Розміри пухлини можуть варіювати від декількох міліметрів до декількох сантиметрів. Рабдоміома має білясте або коричнювате забарвлення, чітко відмежована від навколишніх тканин, але не має капсули, мікроскопічно складається із клітин різноманітної форми з великим вмістом глікогену. Типовими для рабдоміоми є павукоподібні клітини з центрально розташованими круглими ядрами та наявністю в цитоплазмі міофібрил з поперечною смугастістю (рис. 14.6).
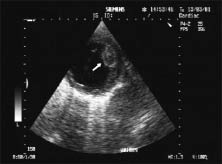
Рис. 14.6. Рабдоміома. В-режим, парастернальна позиція, коротка вісь, на рівні папілярних м’язів ЛШ
Прогноз
Прогноз несприятливий. Смерть частіше настає раптово.
ФІБРОМА СЕРЦЯ
Визначення
Фіброма — доброякісна сполучнотканинна пухлина, яку виявляють у осіб обох статей у будь-якому віці. Фіброма може розташовуватися в різних відділах серця, найчастіше — в шлуночках або міжшлуночковій перегородці.
Патологічна анатомія
Як правило, являє собою солітарне утворення діаметром 3–10 см щільної консистенції сірувато-білого забарвлення (рис. 14.7).

Рис. 14.7. Фіброма ЛШ. В-режим, парастернальна позиція, довга вісь
Пухлина чітко відмежована від навколишніх тканин, але не має капсули, характеризується інвазивним ростом. При мікроскопічному дослідженні центральна частина пухлини складається з гіалінізованої фіброзної тканини з множинними вогнищами кальцинозу та кістозною дегенерацією, на периферії розташовані веретеноподібні клітини типу фібробластів із зернистою цитоплазмою і овальними ядрами з 1–2 ядерцями. Клітини розташовуються між пучками колагенових волокон, що мають різний напрямок.
Прогноз
При рості пухлини часто в патологічний процес втягується провідна система серця, що зумовлює високу частоту випадків раптової смерті.
ГЕМАНГІОМА СЕРЦЯ
Визначення
Гемангіома серця — доброякісна судинна пухлина, що характеризується внутрішньопорожнинним, внутрішньом’язовим або епікардіальним ростом. Пухлина може уражувати будь-який відділ серця.
Патологічна анатомія
Макроскопічно гемангіома невеликого розміру, має вигляд виноградного грона або поліподібного розростання синьо-багряних кольорів. На розрізі — губчаста будова.
Прогноз
Прогноз при гемангіомах не вивчений, залежить від локалізації та розміру пухлини, в 50% випадків їх виявляють випадково при аутопсії.
ТЕРАТОМА СЕРЦЯ
Визначення
Тератома — пухлина, що містить елементи всіх трьох зародкових листків. Внутрішньосерцева тератома являє собою дуже рідкісне захворювання, виявляють переважно у жінок.
Патологічна анатомія
Морфологічно має грушоподібну форму і може досягати до 15 см у діаметрі. На розрізі — полікістозна будова.
Прогноз
Не вивчений, проте описані випадки виникнення рефрактерної СН і раптової смерті.
МЕЗОТЕЛІОМА АV-ВУЗЛА
Визначення
Доброякісна пухлина, що вибірково уражує AV-вузол. Виявляють переважно у жінок будь-якого віку.
Патологічна анатомія
Гістогенез пухлини не з’ясований. Макроскопічно пухлина має вигляд множинних вузликів, розташованих в області AV-вузла, не має чітких границь. Характерна відсутність метастазів і проростання пухлини в тристулковий клапан та міокард ПШ.
Прогноз
Прогноз несприятливий, що зумовлено виникненням асистолії або фібриляції шлуночків на фоні повної поперечної блокади серця.
ПЕРВИННІ ЗЛОЯКІСНІ ПУХЛИНИ
САРКОМА
Найбільш частим різновидом первинних злоякісних пухлин є саркома, що походить з мезенхіми і тому може проявлятися різноманіттям морфологічних типів (див. табл. 1) та зумовлювати складність гістологічної верифікації. Саркома може виникнути в осіб будь-якого віку, але найчастіше — в 30–50 років, однаково часто в чоловіків і жінок. Пухлина уражує переважно праві відділи серця, виходячи, як правило, з ендокарда або перикарда. Первинна саркома серця може викликати оклюзію клапанних отворів і вихідних відділів шлуночків, здавлювати та проростати коронарні судини, великі артерії і вени. Відрізняється швидким інвазивним ростом, проростає всі шари серця і прилеглі органи, а також швидко та поширено метастазує у легені, середостіння, трахеобронхіальні та ретроперитонеальні лімфатичні вузли, надниркову залозу, мозок.
АНГІОСАРКОМА
Найбільш частий різновид первинних злоякісних пухлин, у чоловіків розвивається в 2–3 рази частіше, ніж у жінок. Пухлина може уражувати будь-які відділи серця, найчастіше — праве передсердя.
Ангіосаркома макроскопічно являє собою щільне горбисте утворення, що інфільтрує тканини. На розрізі виявляють вогнища некрозу та крововиливи. Мікроскопічно визначаються веретеноподібні, полігональні або округлі клітини, що утворюють синцитій і складаються у безладно розташовані тяжі. Характерним є утворення різних за розміром і формою судинних порожнин, заповнених кров’ю і сполучених між собою. Між клітинами пухлини перебувають пухкі мережі аргірофільних волокон, що нагадують базальну мембрану.
РАБДОМІОСАРКОМА
Походить із серцевої смугастої м’язової тканини, розвивається в будь-якому віці, дещо частіше у чоловіків.
Макроскопічно рабдоміосаркома визначається як вузол м̓ якої консистенції білого або блідо-рожевого кольору, розташований в товщі міокарда. На розрізі виявляють вогнища крововиливів і некрозів. Мікроскопічно визначається різне співвідношення дрібних округлих або овальних, веретеноподібних клітин. Важливе діагностичне значення має їх виражений поліморфізм: можуть нагадувати тенісну ракетку, маючи округле тіло з ядром і один товстий цитоплазматичний відросток, або бути павукоподібної форми з центрально розташованим ядром і великими вакуолями глікогену по периферії. У цитоплазмі визначають міофібрили з поперечною смугастістю. Клітини пухлини можуть розташовуватися суцільними полями або формувати альвеолярні та пучкові структури, укладені в мережу аргірофільних і колагенових волокон.
ФІБРОСАРКОМА
Є мезенхімальною пухлиною, виникає у осіб обох статей у будь-якому віці.
Макроскопічно являє собою чітко обмежений щільний вузол білого або сірувато-білого кольору і має інфільтративний ріст. Мікроскопічно виявляють фібробластоподібні клітини з різним ступенем диференціації та колагенові волокна. Клітини розташовані у вигляді пучків, що переплітаються.
Інші первинні злоякісні пухлини, у тому числі мезотеліома і лімфома, виявляються рідко. Необхідні детальні дослідження їх морфологічних та клінічних особливостей.
Клінічна картина
Клінічна картина залежить від локалізації пухлини та величини обструкції порожнин серця. Типовою є невідомого походження, швидко прогресуюча СН зі збільшенням розмірів серця, випотом у перикард (геморагічним), тампонадою, болем в області грудної клітки, аритміями, порушеннями провідності, обструкцією порожнистої вени та раптовою смертю. Пухлини, обмежені міокардом без поширення всередину порожнини, можуть якийсь час мати безсимптомний перебіг або викликати аритмії і порушення провідності. Запідозрити наявність злоякісного новоутворення можливо з наступних симптомів:
- біль всередині грудної клітки є раннім і частим симптомом злоякісного ураження;
- наявність гемоперикарда при відсутності травми в анамнезі;
- необхідність проведення повторних перикардіоцентезів (цитологічне дослідження евакуйованої рідини обов’язкове);
- прогресування синдрому верхньої порожнистої вени при відсутності тампонади серця.
При поширенні пухлини на перикардіальний простір часто утворюється геморагічний випіт у перикард, може виникнути тампонада.
Саркома часто викликає симптоми правошлуночкової недостатності внаслідок обструкції правого передсердя, ПШ, тристулкового клапана або клапана ЛА. Обструкція верхньої порожнистої вени може призводити до набряку обличчя і верхніх кінцівок, тоді як обструкція нижньої порожнистої вени викликає застій у внутрішніх органах.
Діагностика
ЕхоКГ розглядають як метод вибору в діагностиці пухлин серця, достатній для вироблення відповідної хірургічної тактики.
Останнім часом все більше визнання в діагностиці здобуває метод КТ, який відрізняється високою чутливістю і надійністю, що дозволяє проводити топічну діагностику пухлини і визначити місце її фіксації. Іншим достовірним методом топічної діагностики пухлини серця є МРТ.
Лікування
Терапія злоякісних пухлин серця найчастіше симптоматична. Хірургічне лікування переважної більшості пацієнтів з первинними злоякісними новоутвореннями серця неефективне у зв’язку з тим, що до моменту діагностики відзначається значне поширення пухлини як у межах самого міокарда, так і на прилеглі органи та тканини. Найчастіше проводять променеву терапію з системною хіміотерапією або без неї, що дозволяє тимчасово зменшити клінічну вираженість захворювання і у ряді випадків збільшити тривалість життя до 5 років після початку лікування.
Прогноз
Прогноз несприятливий. При встановленні діагнозу «саркома серця» у 80% хворих уже є метастази. Як правило, пацієнти помирають протягом 6–12 міс після появи перших клінічних симптомів.
ЛІТЕРАТУРА
- Книшов Г.В., Витовский Р.М., Захарова В.П. (2005) Опухоли сердца, проблемы диагностики и хирургического лечения. Киев, 256 с.
- Коваленко В.Н., Несукай Е.Г. (2001) Некоронарогенные болезни сердца. Практ. руководство, Морион, Киев, 480 с.
- Коваленко В.Н. (ред.) (2008) Руководство по кардиологии. Морион, Киев, 1424 с.
- Моисеев С.В., Попова Е.Н., Фомин В.В. и др. (2005) Миксома левого предсердия и фиброзирующий альвеолит — случайное сочетание? Клин. мед., 6: 42–46.
- Оганов Р.Г., Фомина И.Г. (ред.) (2006) Болезни сердца: руководство для врачей. Литтерра, Москва, 1328 с.
- Фейгенбаум Х. (1999) Эхокардиография: Пер. с англ. под ред. В.В. Митькова. Видар, Москва, 512 с.
- Шиллер Н., Осипов М.А. (2005) Клиническая эхокардиография. 2-е изд. Практика, Москва, 344 с.
- Aoyama A., Isowa N., Chihara K. et al. (2005) Pericardial metastasis of myxoid liposarcoma causing cardiac tamponade. Jpn. J. Thorac. Cardiovasc. Surg., 53(193–195).
- Bley T.A., Zeiser R., Ghanem N.A. et al. (2005) High grade cardiac lymphoma vitality monitoring by gadolinium-enhanced magnetic resonance imaging (MRI). In Vivo, 19: 689–693.
- Burke A.P., Tazelaar H., Gomez Roman J.J. et al. (2004) Benign tumors of pluripotent mesenchyme. In: Travis W. (Ed.) Tumours of the lung, thymus, pleura and heart. Springer-Verlag, Lyon, p. 260–265.
- Burke A.P., Veinot J., Loire R. et al. (2004) Tumors of the heart: introduction. In: Travis W. (Ed.) Tumours of the lung, thymus, pleura and heart. Springer-Verlag, Lyon, p. 251–253.
- Butany J., Nair V., Naseemuddin A. et al. (2005) Cardiac tumours: diagnosis and management. Lancet Oncol., 6: 219–228.
- Galderisi M., Mondillo S. (2007) Echocardiography in clinical practice. One Way S.r.l., 120 p.
- Gowda R.M., Khan I.A. (2003) Clinical perspectives of primary cardiac lymphoma. Angiology, 54: 599–604.
- Grebenc M.L., Rosado-de-Christenson M.L., Green C.E. et al. (2002) Cardiac myxoma: imaging features in 83 patients. Radiographics, 22: 673–689.
- Ipek G., Erentug V., Bozbuga N. et al. (2005) Surgical management of cardiac myxoma. J. Card. Surg., 20: 300–304.
- Karaeren H., Ilgenli T.F., Celik T. et al. (2000) Papillary fibroelastoma of the mitral valve with systemic embolization. Echocardiography, 17: 165–167.
- Keeling I.M., Oberwalder P., Anelli-Monti M. et al. (2000) Cardiac myxomas: 24 years of experience in 49 patients. Eur. J. Cardiothorac. Surg., 22: 971–977.
- Mathur A., Airan B., Bhan A. et al. (2000) Non-myxomatous cardiac tumours: twenty-year experience. Indian Heart J., 52: 319–323.
- Mochizuki Y., Okamura Y., Iida H. et al. (1998) Interleukin-6 and «complex» cardiac myxoma. Ann. Thorac. Surg., 66: 931–933.
- Orlandi A., Ferlosio A., Angeloni C. et al. (2005) Cardiac tumours. Pathologica, 97: 115–123.
- Peters P.J., Reinhardt S. (2006) The echocardiographic evaluation of intracardiac masses: a review. J. Amer. Soc. Echocardiogr., 19: 230–240.
- Reynen K., Rein J., Wittekind C. et al. (1993) Surgical removal of a lipoma of the heart. Int. J. Cardiol., 40: 67–68.
- Sá M.I., Reis H., Lagarto V. et al. (2006) Papillary fibroelastoma located deep in the left ventricle. Rev. Port Cardiol., 25: 605–609.
- Shin M.S., Chung W.J., Koh K.K. et al. (2004) Protruding left atrial myxoma presented with congestive heart failure and transient ischemic attack. Clin. Cardiol., 27: 605.
- Topol E.J. (Ed.) (2007) Textbook of cardiovascular medicine. 3th ed. Lippincott Williams&Wilkins, 1628 p.
- Watson J.C., Stratakis C.A., Bryant-Greenwood P.K. et al.(2000) Neurosurgical implications of Carney complex. J. Neurosurg., 92: 413–418.
- Wiese T.H., Enzweiler C.N., Borges A.C. et al. (2001) Electron beam CT in the diagnosis of recurrent cardiac lipoma. AJR Amer. J. Roentgenol., 176: 1066–1068.
- Wilhite D.B., Quigley R.L. (2003) Occult cardiac lymphoma presenting with cardiac tamponade. Tex. Heart Inst. J., 30: 62–64.
- Yamamoto T., Nejima J., Ino T. et al. (2004) Case of massive left atrial lipoma occupying pericardial space. Jpn. Heart J., 45: 715–721.
- Yoon D.H., Roberts W. (2002) Sex distribution in cardiac myxomas. Amer. J. Cardiol., 90: 563–565.
- Yuda S., Nakatani S., Yutani C. et al. (2002) Trends in the clinical and morphological characteristics of cardiac myxoma: 20-year experience of a single tertiary referral center in Japan. Circ. J., 66: 1008–1013.