Форксіга (Forxiga) (264220) - інструкція із застосування ATC-класифікація

Форксіга інструкція із застосування
Фармакологічні властивості
фармакодинаміка.
Механізм дії. Дапагліфлозин — високопотужний (Kі: 0,55 нМ), селективний та зворотний інгібітор натрійзалежного котранспортера глюкози 2 типу (іНЗКТГ2).
Інгібування іНЗКТГ2 дапагліфлозином зменшує реабсорбцію глюкози з клубочкового фільтрату в проксимальному відділі ниркових канальців з одночасним зменшенням реабсорбції натрію, що призводить до виведення глюкози із сечею та осмотичного діурезу. Таким чином, дапагліфлозин збільшує доставку натрію до дистальних канальців, що збільшує тубулогломерулярний зворотний зв’язок і знижує внутрішньогломерулярний тиск. Це в поєднанні з осмотичним діурезом призводить до зменшення перевантаження об’ємом, зниження артеріального тиску та зниження перед- і постнавантаження, що може мати сприятливий вплив на ремоделювання міокарда та його діастолічну функцію, а також збереження функції нирок. Користь застосування дапагліфлозину для серця та нирок не залежить лише від ефекту зниження рівня глюкози в крові та не обмежується пацієнтами з цукровим діабетом, як продемонстрували дослідження DAPA-HF, DELIVER та DAPA-CKD. До інших ефектів належать підвищення гематокриту та зниження маси тіла.
Дапагліфлозин поліпшує рівні глюкози натще та після прийому їжі в плазмі крові за допомогою зменшення реабсорбції глюкози в нирках, що призводить до виведення глюкози із сечею. Це виведення глюкози (глюкозуричний ефект) спостерігається після першої дози лікарського засобу, триває протягом 24-годинного інтервалу дозування та зберігається протягом лікування. Кількість глюкози, виведеної нирками за допомогою цього механізму, залежить від концентрації глюкози в крові та показника швидкості клубочкової фільтрації (ШКФ). Таким чином, у пацієнтів із нормальним рівнем глюкози в крові дапагліфлозин має низьку здатність викликати гіпоглікемію. Дапагліфлозин не порушує нормальне продукування ендогенної глюкози у відповідь на гіпоглікемію. Дапагліфлозин діє незалежно від секреції та дії інсуліну. У клінічних дослідженнях дапагліфлозину спостерігалося поліпшення функції бета-клітин (бета-клітини НОМА) при оцінці моделі гомеостазу.
НЗКТГ2 селективно експресуються в нирках. Дапагліфлозин не пригнічує інші переносники глюкози, що є важливим для транспортування глюкози в периферичні тканини, та у >1400 разів є більш селективним відносно НЗКТГ2 порівняно з НЗКТГ1, головного переносника в кишечнику, що відповідає за абсорбцію глюкози.
Фармакодинамічні ефекти
У здорових учасників дослідження та пацієнтів з цукровим діабетом 2 типу після застосування дапагліфлозину спостерігалося збільшення кількості глюкози, виведеної із сечею. Приблизно 70 г глюкози на добу виводилося із сечею (що відповідає 280 ккал/добу) при застосуванні дапагліфлозину в дозі 10 мг на добу пацієнтам з цукровим діабетом 2 типу протягом 12 тижнів. У пацієнтів із цукровим діабетом 2 типу, які отримували дапагліфлозин у дозі 10 мг/добу протягом періоду до 2 років, спостерігалися ознаки тривалої екскреції глюкози.
Така екскреція глюкози із сечею при застосуванні дапагліфлозину також призводить до осмотичного діурезу та збільшення об’єму сечі у пацієнтів з цукровим діабетом 2 типу. Збільшення об’єму сечі у пацієнтів з цукровим діабетом 2 типу досягає приблизно 375 мл на добу. Збільшення об’єму сечі було асоційоване із незначним і тимчасовим збільшенням екскреції натрію із сечею, що не супроводжувалося змінами концентрації натрію у сироватці крові.
Екскреція сечової кислоти із сечею також тимчасово була підвищена (протягом 3–7 днів) і супроводжувалася стійким зменшенням концентрації сечової кислоти в сироватці крові. На 24 тижні зменшення концентрації сечової кислоти в сироватці крові варіювало від –48,3 до –18,3 мкмоль/л (від –0,87 до –0,33 мг/дл).
Клінічна ефективність і безпека
Цукровий діабет 2 типу
Поліпшення глікемічного контролю, зниження серцево-судинної та ниркової захворюваності та смертності є невід’ємною частиною лікування цукрового діабету 2 типу.
Було проведено чотирнадцять подвійно сліпих, рандомізованих, контрольованих клінічних досліджень за участю 7056 дорослих пацієнтів із цукровим діабетом 2-го типу з метою оцінки глікемічної ефективності та безпеки лікарського засобу Форксіга; 4737 пацієнтів у цих дослідженнях отримували лікування дапагліфлозином. У дванадцяти дослідженнях період лікування становив 24 тижні, у 8 довгострокових продовженнях — від 24 до 80 тижнів (до загальної тривалості дослідження 104 тижні), в одному дослідженні період лікування був 28 тижнів, а ще в одному дослідженні тривалість лікування дорівнювала 52 тижня з довгостроковим продовженням тривалістю 52 і 104 тижні (загальна тривалість дослідження — 208 тижнів). Середня тривалість захворювання учасників на цукровий діабет становила від 1,4 до 16,9 року. У 50% спостерігалося легке порушення функції нирок, а в 11% – порушення функції нирок середнього ступеня. 51% учасників становили чоловіки, 84% належали до європеоїдної раси, 8 % – до монголоїдної, 4% — до негроїдної і 4% — до інших расових груп. 81% учасників мали індекс маси тіла (ІМТ) ≥27. Крім цього, проведено два 12-тижневі плацебо-контрольовані дослідження за участю пацієнтів з недостатнім контролем цукрового діабету 2-го типу та артеріальною гіпертензією.
Було проведено клінічне дослідження з оцінки серцево-судинних подій (DECLARE) з дапагліфлозином у дозуванні 10 мг у порівнянні з плацебо за участю 17160 пацієнтів з цукровим діабетом 2 типу з або без встановлених серцево-судинних захворювань для оцінки впливу на серцево-судинні події та події пов’язані з нирками.
Глікемічний контроль
Монотерапія
Подвійне сліпе, плацебо-контрольоване дослідження тривалістю 24 тижні (з додатковим періодом продовження) проводилося з метою оцінки безпеки та ефективності монотерапії лікарським засобом Форксіга у пацієнтів з недостатнім контролем цукрового діабету 2 типу. Прийом дапагліфлозину 1 раз на добу зумовив статистично значуще (p <0,0001) зниження рівня глікозильованого гемоглобіну (HbA1c) порівняно з плацебо (таблиця 1).
У періоді продовження зниження рівня HbA1c зберігалося до тижня 102 включно (середня зміна від вихідного рівня з поправкою –0,61% і –0,17% для дапагліфлозину 10 мг і плацебо відповідно).
Таблиця 1. Результати через 24 тижні (ПВДОСа) плацебо-контрольованого дослідження застосування дапагліфлозину як монотерапії
| Монотерапія | ||
| Дапагліфлозин 10 мг | Плацебо | |
| Nб | 70 | 75 |
| HbA1c (%) Вихідний рівень (середній) | 8,01 | 7,79 |
| Зміна від вихідного рівняв | –0,89 | –0,23 |
| Різниця порівняно з плацебов (95% ДІ) | –0,66* (–0,96; –0,36) | |
| Пацієнти (%), у яких досягнуто: HbA1c (%) >7% Відкориговано для вихідного рівня | 50,8§ | 31,6 |
| Маса тіла (кг) | ||
| Вихідний рівень (середній) | 94,13 | 88,77 |
| Зміна від вихідного рівняв | –3,16 | –2,19 |
| Різниця порівняно з плацебов (95% ДІ) | –0,97 (–2,20; 0,25) | |
аПВДОС – перенесення вперед даних останнього спостереження (перед лікуванням пролікованих пацієнтів).
бУсі рандомізовані пацієнти, які отримали принаймні одну дозу лікарського засобу, досліджуваного у короткотривалому подвійному сліпому періоді дослідження.
вСереднє за методом найменших квадратів скориговане на початкове значення.
*р-значення ˂ 0,0001 у порівнянні із плацебо.
§Не оцінювалося щодо статистичної значущості в результаті послідовної процедури тестування для вторинних кінцевих точок.
Додаткова комбінована терапія
У ході 52-тижневого активно-контрольованого дослідження з доведення не нижчої ефективності досліджуваного лікарського засобу (з періодами продовження 52 і 104 тижні) дію лікарського засобу Форксіга оцінювали при додаванні до метформіну порівняно із сульфонілсечовиною (гліпізид) при додаванні до метформіну у пацієнтів з недостатнім глікемічним контролем (HbA1c >6,5% і ≤10%). Результати свідчили про подібне середнє зниження HbA1c від вихідного рівня через 52 тижні у порівнянні з гліпізидом, що продемонструвало не нижчу ефективність досліджуваного лікарського засобу. Через 104 тижні відкоригована середня зміна HbA1c від вихідного рівня складала –0,32% для дапагліфлозину і –0,14% для гліпізиду. Через 208 тижнів відкоригована середня зміна HbA1c від вихідного рівня складала –0,10 % для дапагліфлозину і 0,20 % для гліпізиду. Через 52, 104 і 208 тижнів у значно меншої частки пацієнтів у групі лікування дапагліфлозином (3,5%, 4,3% і 5,0% відповідно) спостерігався принаймні один епізод гіпоглікемії у порівнянні з групою, яка отримувала гліпізид (40,8%, 47,0% і 50,0% відповідно). Частка пацієнтів, які продовжували брати участь у дослідженні на момент 104 і 208 тижнів, складала 56,2% і 39,7% для групи лікування дапагліфлозином і 50,0% та 34,6% для групи лікування гліпізидом.
Дапагліфлозин як доповнення до метформіну, глімепіриду, метформіну та сульфонілсечовини, ситагліптину (з метформіном або без) або інсуліну зумовив статистично значуще зменшення HbA1c через 24 тижні у порівнянні з плацебо (p <0,0001).
Зменшення HbA1c, яке спостерігалося на 24 тижні, зберігалося у дослідженнях додаткової комбінованої терапії (глімепірид та інсулін) до 48 тижнів (глімепірид) та до 104 тижнів (інсулін). Через 48 тижнів при додаванні до ситагліптину (з метформіном або без) відкоригована середня зміна від вихідного рівня для дапагліфлозину у дозі 10 мг і плацебо складала –0,30% та 0,38% відповідно. У дослідженні із додаванням метформіну зменшення HbA1c зберігалося через 102 тижні (відкоригована середня зміна від вихідного рівня –0,78% та 0,02% для лікарського засобу у дозі 10 мг та плацебо відповідно). Через 104 тижні при застосуванні інсуліну (з додатковим застосуванням пероральних цукрознижувальних лікарських засобів або без) відкоригована середня зміна від вихідного рівня зменшення HbA1c становила –0,71% та –0,06% для дапагліфлозину у дозі 10 мг та плацебо відповідно. Через 48 та 104 тижні доза інсуліну залишалася стабільною у порівнянні з вихідним рівнем у пацієнтів, які отримували дапагліфлозин у дозі 10 мг, і становила у середньому 76 МО/добу. У групі плацебо середнє збільшення дози становило 10,5 МО/добу і 18,3 МО/добу від вихідного рівня (середня доза становила 84 та 92 МО/добу) через 48 і 104 тижні відповідно. Частка пацієнтів, які продовжували участь у дослідженні через 104 тижні, становила 72,4% у групі лікування дапагліфлозином у дозі 10 мг і 54,8% у групі плацебо.
Застосування комбінації з метформіном раніше не лікованим пацієнтам
Загалом, 1236 раніше не лікованих пацієнтів з недостатньо контрольованим діабетом 2 типу (HbAlc ≥7,5% і ≤12%) брали участь у двох дослідженнях з активним контролем, що тривало 24 тижні, для оцінки ефективності та безпеки дапагліфлозину (5 мг або 10 мг) у комбінації з метформіном для раніше не лікованих пацієнтів порівняно з терапією монокомпонентними лікарськими засобами.
Лікування дапагліфлозином у дозі 10 мг у комбінації з метформіном (до 2000 мг на добу) забезпечило значне покращання HbAlc порівняно з лікуванням окремими монокомпонентними лікарськими засобами (таблиця 2) і спричинило більше зниження рівня глюкози в плазмі крові натще (ГПН) (у порівнянні з лікуванням окремими монокомпонентними лікарськими засобами) та маси тіла (у порівнянні з метформіном).
Таблиця 2: Результати на тижні 24 (ПВДОСа) в активно-контрольованому дослідженні комбінованої терапії дапагліфлозином і метформіном у раніше не лікованих пацієнтів
| Параметр | Дапагліфлозин 10 мг + Метформін | Дапагліфлозин 10 мг | Метформін |
| Nb | 211b | 219b | 208b |
| HbAlc (%) Початково (середнє) Зміна від початковогоc Різниця порівняно з дапагліфлозиномc (95% ДІ) Різниця порівняно з метформіномc (95% ДІ) | 9,10 –1,98 –0,53* (–0,74; –0,32) –0,54* (–0,75; –0,33) | 9,03 –1,45 –0,01 (–0,22; 0,20) | 9,03 –1,44 |
aПВДОС – перенесення вперед даних останнього спостереження.
bВсі рандомізовані пацієнти, які отримали принаймні одну дозу лікарського засобу подвійного сліпого дослідження під час короткочасного подвійного сліпого періоду.
cСереднє за методом найменших квадратів скориговане на початкове значення.
*p-значення <0,0001.
Комбінована терапія з ексенатидом пролонгованого вивільнення
У 28-тижневому подвійному сліпому активно-контрольованому дослідженні комбінація дапагліфлозину та ексенатиду пролонгованого вивільнення (агоніст рецептора ГПП-1) порівнювалася з лікуванням дапагліфлозином окремо і ексенатидом пролонгованого вивільнення окремо у пацієнтів з недостатньо контрольованим діабетом на монотерапії метформіном (HbAlc ≥8% і ≤12%). У всіх групах лікування зменшився рівень HbAlc порівняно з початковим. Комбінована терапія дапагліфлозином у дозі 10 мг та ексенатидом пролонгованого вивільнення зумовила значне зниження рівня HbAlc порівняно з початковим показником у порівнянні з лікуванням дапагліфлозином та ексенатидом пролонгованого вивільнення окремо (таблиця 3).
Таблиця 3. Результати одного 28-тижневого дослідження дапагліфлозину та ексенатиду пролонгованого вивільнення у порівнянні з лікуванням дапагліфлозином окремо і ексенатидом пролонгованого вивільнення окремо у комбінації з метформіном (сукупність всіх рандомізованих пацієнтів згідно з призначеним лікуванням)
| Параметр | Дапагліфлозин 10 мг 1 р/д + Ексенатид пролонгованого вивільнення 2 мг 1 р/т | Дапагліфлозин 10 мг 1 р/д + Плацебо 1 р/т | Ексенатид пролонгованого вивільнення 2 мг 1 р/т + Плацебо 1 р/д |
| N | 228 | 230 | 227 |
| HbAlc (%) Початково (середнє) Зміна від початковогоa | 9,29 –1,98 | 9,25 –1,39 | 9,26 –1,60 |
| Середня різниця зміни від початкового між комбінацією і окремими лікарськими засобами (95% ДІ) | –0,59* (–0,84; –0,34) | –0,38** (–0,63; –0,13) | |
| Пацієнти (%), що досягли HbAlc <7% | 44,7 | 19,1 | 26,9 |
| Маса тіла (кг) Початково (середнє) Зміна від початковогоa | 92,13 –3,55 | 90,87 –2,22 | 89,12 –1,56 |
| Середня різниця зміни від початкового між комбінацією і окремими лікарськими засобами (95% ДІ) | –1,33* (–2,12; –0,55 ) | –2,00* (–2,79; –1,20) | |
1 р/д = один раз на добу. 1 р/т = один раз на тиждень. N = кількість пацієнтів. ДI = довірчий інтервал
aСереднє за методом найменших квадратів скориговане на початкове значення і різниця між групами лікування у зміні від початкових значень на тижні 28 моделюються за допомогою змішаної моделі з повторюваними вимірюваннями, включаючи лікування, регіон, початковий рівень HbAlc (<9,0% або ≥9,0%), тиждень і потижневе лікування як фіксовані фактори і початкове значення як коваріату.
* p <0,001.
** p <0,01.
р-значення — всі скориговані р-значення для множинності.
Аналізи виключають вимірювання після терапії порятунку і після дострокового припинення застосування досліджуваного лікарського засобу.
Рівні глюкози в плазмі крові натще
Застосування дапагліфлозину у дозі 10 мг у вигляді монотерапії або як доповнення до метформіну, глімепіриду, метформіну та сульфонілсечовини, ситагліптину (з метформіном або без) або інсуліну зумовило статистично значуще зниження ГПН (від –1,90 до –1,20 ммоль/л [від –34,2 до –21,7 мг/дл]) порівняно з плацебо (від –0,33 до 0,21 ммоль/л [від –6,0 до 3,8 мг/дл]). Цей ефект спостерігався у тиждень 1 лікування і зберігався у дослідженнях з продовженням до тижня 104 включно.
Комбінована терапія дапагліфлозином 10 мг та ексенатидом пролонгованого вивільнення привела до суттєвішого зниження ГПН на 28 тижні: –3,66 ммоль/л (–65,8 мг/дл), у порівнянні –2,73 ммоль/л (–49,2 мг/дл) у разі застосування дапагліфлозину окремо (р <0,001) та –2,54 ммоль/л (–45,8 мг/дл) у разі застосування ексенатиду окремо (р <0,001).
У спеціальному дослідженні у пацієнтів, хворих на цукровий діабет, з pШКФ від ≥45 до <60 мл/хв/1,73 м2 лікування дапагліфлозином продемонструвало зниження ГПН на 24 тижні: -1,19 ммоль/л (-21,46 мг/дл) у порівнянні з -0,27 ммоль/л (-4,87 мг/дл) для плацебо (р = 0,001).
Рівні глюкози у плазмі крові після прийому їжі
Лікування дапагліфлозином у дозі 10 мг додатково до лікування глімепіридом спричинило статистично значуще зниження рівнів глюкози в плазмі крові через 2 години після прийому їжі через 24 тижні зі збереженням цих показників до тижня 48.
Лікування дапагліфлозином у дозі 10 мг у вигляді доповнення до ситагліптину (з метформіном або без) зумовило зниження рівня глюкози через 2 години після прийому їжі на 24-му тижні, що зберігалося до тижня 48.
Комбінована терапія дапагліфлозином 10 мг та екcенатидом пролонгованого вивільнення зумовила значуще зниження рівня глюкози у 2-годинному постпрандіальному тесті на 28 тижні порівняно з окремими лікарськими засобами.
Маса тіла
Дапагліфлозин у дозі 10 мг як доповнення до метформіну, глімепіриду, метформіну та сульфонілсечовини, ситагліптину (з метформіном або без) або інсуліну зумовив статистично значуще зменшення маси тіла через 24 тижні (p <0,0001). Ці ефекти зберігалися у довгострокових дослідженнях. Через 48 тижнів відмінність від плацебо у разі застосування дапагліфлозину як доповнення до ситагліптину (з метформіном або без) становила –2,22 кг. Через 102 тижні відмінність від плацебо у разі застосування дапагліфлозину як доповнення до метформіну або інсуліну становила –2,14 та –2,88 кг відповідно.
В активно-контрольованому дослідженні з доведення не нижчої ефективності досліджуваного лікарського засобу дапагліфлозин як доповнення до метформіну зумовив статистично значуще зменшення маси тіла порівняно з гліпізидом: –4,65 кг через 52 тижні (p <0,0001), що зберігалося через 104 та 208 тижнів (–5,06 кг та –4,38 кг відповідно).
Комбінація дапагліфлозину 10 мг та ексенатиду пролонгованого вивільнення продемонструвала суттєвіше зниження маси тіла у порівнянні з терапією кожним із лікарських засобів окремо (таблиця 3).
Результати 24-тижневого дослідження за участю 182 пацієнтів з цукровим діабетом, в якому використовували двоенергійну рентгенівську абсорбціометрію для оцінки складу тіла, показали більше зменшення маси тіла та жирової маси тіла, ніж зменшення безжирової маси тіла чи втрату рідини, у пацієнтів в групі лікування дапагліфлозином у дозі 10 мг і метформіном порівняно з групою плацебо і метформіну. Лікування лікарським засобом Форксіга та метформіном зумовило чисельне зменшення вісцеральної жирової тканини порівняно з лікуванням плацебо та метформіном, за даними субдослідження з використанням магнітно-резонансної томографії.
Артеріальний тиск
Згідно з даними попередньо запланованого об’єднаного аналізу 13 плацебо-контрольованих досліджень, лікування дапагліфлозином у дозі 10 мг зумовило зміну систолічного артеріального тиску від вихідного рівня –3,7 мм рт. ст. та діастолічного артеріального тиску –1,8 мм рт. ст. порівняно з –0,5 мм рт. ст. для систолічного та –0,5 мм рт. ст. для діастолічного артеріального тиску у групі плацебо у тиждень 24. Подібне зниження спостерігалося протягом усього періоду тривалістю до 104 тижнів.
Комбінована терапія дапагліфлозином 10 мг та ексенатидом пролонгованого вивільнення призвела до суттєвого зниження систолічного тиску на 28 тижні (–4,3 мм рт. ст.) у порівнянні із застосуванням дапагліфлозину окремо (–1,8 мм рт. ст., р <0,05) та застосуванням ексенатиду пролонгованого вивільнення окремо (–1,2 мм рт. ст., р <0,01).
У двох 12-тижневих плацебо-контрольованих дослідженнях усього 1062 пацієнти з недостатньо контрольованим цукровим діабетом 2 типу та артеріальною гіпертензією (незважаючи на постійне лікування інгібітором ангіотензинперетворюючого ферменту (іАПФ) чи блокатором рецепторів ангіотензину ІІ першого типу (БРА) в одному дослідженні та іАПФ чи БРА з додаванням одного антигіпертензивного лікарського засобу в іншому дослідженні) отримували лікування дапагліфлозином у дозі 10 мг або плацебо. До тижня 12 у обох дослідженнях дапагліфлозин у дозі 10 мг у комбінації зі звичайним антидіабетичним лікуванням забезпечив покращення рівня HbA1c та зниження (з поправкою на плацебо) систолічного артеріального тиску в середньому на 3,1 та 4,3 мм рт. ст. відповідно.
У спеціальному дослідженні у пацієнтів, хворих на діабет, з рШКФ від ≥45 до <60 мл/хв/1,73 м2 лікування дапагліфлозином продемонструвало зниження систолічного артеріального тиску на 24 тижні: -4,8 мм. рт. ст. у порівнянні з плацебо -1,7 мм. рт. ст. (р <0,05).
Глікемічний контроль у пацієнтів з порушенням функції нирок середнього ступеня (хронічна хвороба нирок 3А ХХН)(розрахована швидкість клубочкової фільтрації (рШКФ) від ≥45 до <60 мл/хв/1,73м2)
Ефективність дапагліфлозину оцінювали також окремо у ході спеціального дослідження за участю пацієнтів із цукровим діабетом з рШКФ ≥45 мл/хв/1,73м2 до <60 мл/хв/1,73 м2, які мали недостатній глікемічний контроль при звичайному лікуванні. Лікування дапагліфлозином призвело до зниження HbA1c і маси тіла порівняно з плацебо (таблиця 4).
Таблиця 4. Результати плацебо-контрольованого дослідження дапагліфлозину у пацієнтів з цукровим діабетом з рШКФ від ≥45 до <60 мл/хв/1,73м2 на 24 тижні
| Дапагліфлозина 10 мг | Плацебоа | |
| Nб | 159 | 161 |
| HbA1c (%) Вихідний рівень (середній) Зміна від вихідного рівняб Різниця порівняно з плацебоб (95% ДІ) | 8,35 -0,37 -0,34* (-0,53; -0,15) | 8,03 -0,03 |
| Маса тіла (кг) Вихідний рівень (середній) Відсоткова зміна від вихідного рівняв Різниця у відсотках порівняно з плацебов (95% ДІ) | 92,51 -3,42 -1,43* (-2,15; -0,69) | 88,30 -2,02 |
аМетформін або метформіну гідрохлорид були частиною звичайного лікування у 69,4% і 64,0% пацієнтів для групи дапагліфлозину та плацебо, відповідно.
бСереднє значення за методом найменших квадратів, скориговане на початкове значення.
вПохідні від середнього значення за методом найменших квадратів, скориговані на початкове значення.
* р<0,001
Пацієнти з вихідним рівнем HbA1с ≥9%
У ході попередньо запланованого аналізу у пацієнтів з вихідним рівнем HbA1с ≥9,0% монотерапія дапагліфлозином у дозі 10 мг (відкоригована середня зміна від вихідного рівня: –2,04% та 0,19% при застосуванні дапагліфлозину у дозі 10 мг і плацебо відповідно) та застосування дапагліфлозину додатково до лікування метформіном (відкоригована середня зміна від вихідного рівня: –1,32% та –0,53% при застосуванні дапагліфлозину і плацебо відповідно) призводило до статистично значущого зниження рівнів HbA1с на тижні 24.
Серцево-судинні та ниркові результати
Вплив дапагліфлозину на серцево-судинні події (DECLARE) — це міжнародне, багатоцентрове, рандомізоване, подвійне сліпе, плацебо-контрольоване клінічне дослідження, що проведене для визначення впливу дапагліфлозину у порівнянні з плацебо на серцево-судинні результати, при додаванні до поточної базової терапії. Усі пацієнти мали цукровий діабет 2 типу та інші щонайменше два додаткові фактори ризику серцево-судинних захворювань (вік ≥55 років для чоловіків або ≥60 років для жінок і одне або кілька з таких станів, як дисліпідемія, артеріальна гіпертензія або наявне тютюнопаління) або встановлені серцево-судинні захворювання.
Серед 17160 рандомізованих пацієнтів, 6974 (40,6%) мали виявлені серцево-судинні захворювання і 10186 (59,4%) не мали встановленого серцево-судинного захворювання. 8582 пацієнти були рандомізовані до дапагліфлозину в дозуванні 10 мг і 8578 до плацебо, і за ними спостерігали протягом медіани в 4,2 роки.
Середній вік досліджуваної популяції становив 63,9 роки, 37,4% були жінками. Загалом 22,4% мали діабет протягом ≤5 років, середня тривалість діабету була 11,9 років. Середнє значення HbA1c було 8,3% і середнє значення індексу маси тіла 32,1 кг/м2.
На початку дослідження 10,0% пацієнтів мали в анамнезі серцеву недостатність. Середнє значення рШКФ було 85,2 мл/хв/1,73 м2, 7,4% пацієнтів мали рШКФ <60 мл/хв/1,73 м2, і 30,3% пацієнтів мали мікро- або макроальбумінурію (співвідношення альбумін/креатинін в сечі [UACR] ≥30 до ≤300 мг/г або >300 мг/г відповідно).
Більшість пацієнтів (98%) використовували один або більше діабетичних лікарських засобів на початку дослідження, зокрема метформін (82%), інсулін (41%) і сульфонілсечовину (43%).
Первинними комбінованими кінцевими точками був час до першого виникнення однієї з таких подій, як смерть через серцево-судинні захворювання, інфаркт міокарда або ішемічний інсульт (великі несприятливі серцево-судинні події [MACE]), і час до першої події, що включає в себе госпіталізацію через серцеву недостатність або смерть через серцево-судинні захворювання. Вторинними кінцевими точками була ниркова комбінована кінцева точка та смерть через будь-яку причину.
Великі несприятливі серцево-судинні події
Дапагліфлозин у дозуванні 10 мг продемонстрував результат, не гірший від плацебо (non-inferiority versus placebo), для таких наслідків як серцево-судинна смерть, інфаркту міокарда або ішемічного інсульту (односторонній р <0,001).
Серцева недостатність або серцево-судинна смерть
Дапагліфлозин у дозуванні 10 мг продемонстрував перевагу в порівнянні з плацебо (superiority versus placebo) у запобіганні госпіталізації через серцеву недостатність або серцево-судинної смерті. Різниця в ефекті лікування була обумовлена госпіталізацією через серцеву недостатність без різниці у серцево-судинній смерті.
Користь від лікування дапагліфлозином у порівнянні з плацебо спостерігалася як у пацієнтів з, так і без встановленого серцево-судинного захворювання, як з серцевою недостатністю так і без серцевої недостатності на початковому етапі, і була послідовною в різних підгрупах, зокрема за віком, статтю, функцією нирок (рШКФ) і регіоном.
Перевага дапагліфлозину над плацебо не була продемонстрована для MACE (p = 0,172). Ниркову комбіновану кінцеву точку та смерть через будь-яку причину не перевіряли як частину процедури підтверджувального тестування.
Нефропатія
Дапагліфлозин знижував частоту подій комбінованої точки: підтвердженого стійкого зниження рШКФ, термінальної стадії ниркової недостатності (ТСНН), смерті через ниркові або серцево-судинні захворювання. Різниця між групами була обумовлена зниженням подій ниркових компонентів: стійкого зниження рШКФ, термінальної стадії ниркової недостатності і смерті через ниркові захворювання.
Відношення ризику до часу виникнення нефропатії (стійке зниження рШКФ, ТСНН і смерть через ниркові захворювання) було 0,53 (95 % ДІ 0,43; 0,66) для дапагліфлозину у порівнянні з плацебо.
Крім того, дапагліфлозин зменшив нові епізоди стійкої альбумінурії (відношення меж функцій ризику 0,79 [95 % ДІ 0,72; 0,87]) і призвів до більшої регресії макроальбумінурії (відношення меж функцій ризику 1,82 [95 % ДІ 1,51; 2,20]) у порівнянні з плацебо.
Серцева недостатність
Дослідження DAPA-HF: серцева недостатність зі зниженою фракцією викиду (ФВЛШ ≤40%)
Дослідження здатності дапагліфлозину запобігати небажаним наслідкам серцевої недостатності (DAPA-HF) — це міжнародне, багатоцентрове, рандомізоване, подвійно сліпе, плацебо-контрольоване дослідження, проведене за участю пацієнтів із серцевою недостатністю (функціональна класифікація Нью-Йоркської кардіологічної асоціації [NYHA], функціональний клас II–IV) зі зниженою фракцією викиду (фракція викиду лівого шлуночка [ФВЛШ] ≤40%). Метою цього дослідження було визначення впливу дапагліфлозину в порівнянні з плацебо при додаванні до стандартного лікування на частоту серцево-судинної смерті та погіршення серцевої недостатності.
Із 4744 пацієнтів 2373 особи були рандомізовані до групи дапагліфлозину в дозуванні 10 мг і 2371 — до групи плацебо, медіана спостереження — 18 місяців. Середній вік досліджуваної популяції становив 66 років, 77% були чоловіками.
На початку дослідження 67,5% пацієнтів були віднесені за шкалою NYHA до класу II, 31,6% — до класу III та 0,9% — до класу IV, середня ФВЛШ становила 32%, 56% випадків серцевої недостатності були ішемічними, 36% — неішемічними та 8% — невідомої етіології. У кожній групі лікування 42% пацієнтів мали в анамнезі цукровий діабет 2 типу, 3% пацієнтів у кожній групі були класифіковані як такі, що страждають на цукровий діабет 2 типу на основі рівня HbA1c ≥6,5% як при включенні, так і при рандомізації. Пацієнти отримували стандартне лікування; 94 % пацієнтів отримували лікування іАПФ, БРА або інгібітором рецептора ангіотензину/неприлізину (ІРАН, 11%), 96% — блокатором β-адренорецепторів, 71% — антагоністом мінералокортикоїдних рецепторів (АМКР), 93% — діуретиком і 26% мали імплантований пристрій (з функцією дефібрилятора).
У дослідження були включені пацієнти з рШКФ ≥30 мл/хв/1,73 м2 на початку дослідження. Середня рШКФ становила 66 мл/хв/1,73 м2, 41% пацієнтів з рШКФ <60 мл/хв/1,73 м2 та 15% пацієнтів мали рШКФ <45 мл/хв/1,73 м2.
Серцево-судинна смерть та погіршення серцевої недостатності
Дапагліфлозин перевершував плацебо щодо попередження первинної комбінованої кінцевої точки серцево-судинної смерті, госпіталізації з приводу серцевої недостатності або відвідування відділення невідкладної допомоги через серцеву недостатність (ВР (відношення ризиків) 0,74 [95% ДІ 0,65; 0,85], р <0,0001). Ефект спостерігався рано та зберігався протягом усього часу дослідження (рисунок 1).
Рисунок 1. Час до першого виникнення випадків серцево-судинної смерті, госпіталізації з приводу серцевої недостатності або відвідування відділення невідкладної допомоги через серцеву недостатність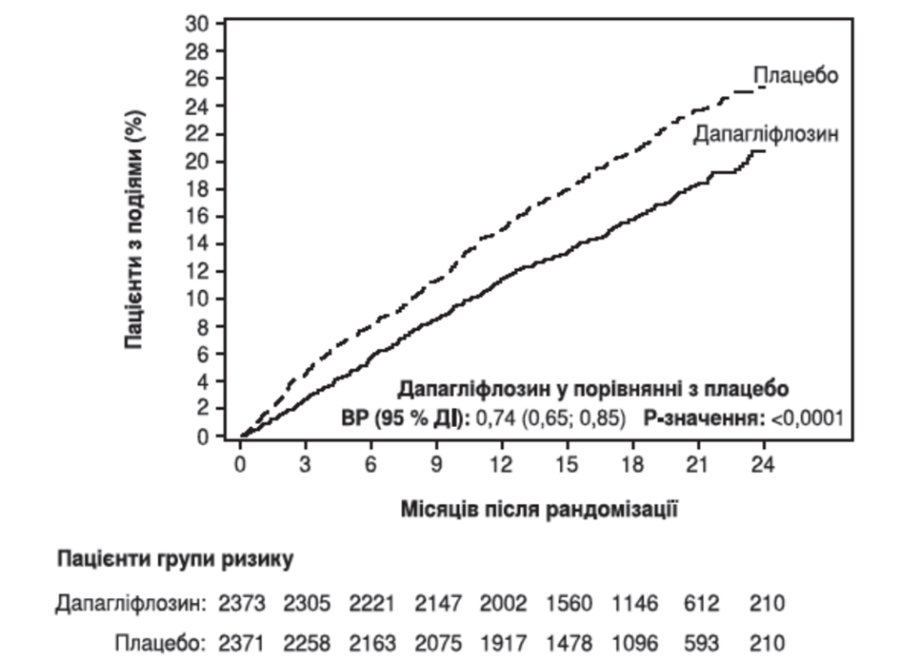
Відвідування відділення невідкладної допомоги через серцеву недостатність було визначено як термінове, незаплановане обстеження лікарем, наприклад, у відділенні невідкладної допомоги, та потреба в лікуванні при погіршенні серцевої недостатності (крім простого збільшення прийому пероральних діуретиків).
Пацієнти групи ризику — це кількість пацієнтів, які перебувають у групі ризику на початку періоду.
Усі три компоненти первинної комбінованої кінцевої точки окремо сприяли ефекту лікування (рисунок 2). Зареєстровано малу кількість відвідувань відділення невідкладної допомоги через серцеву недостатність.
Рисунок 2. Ефекти лікування для первинної комбінованої кінцевої точки, її складових і смертності з усіх причин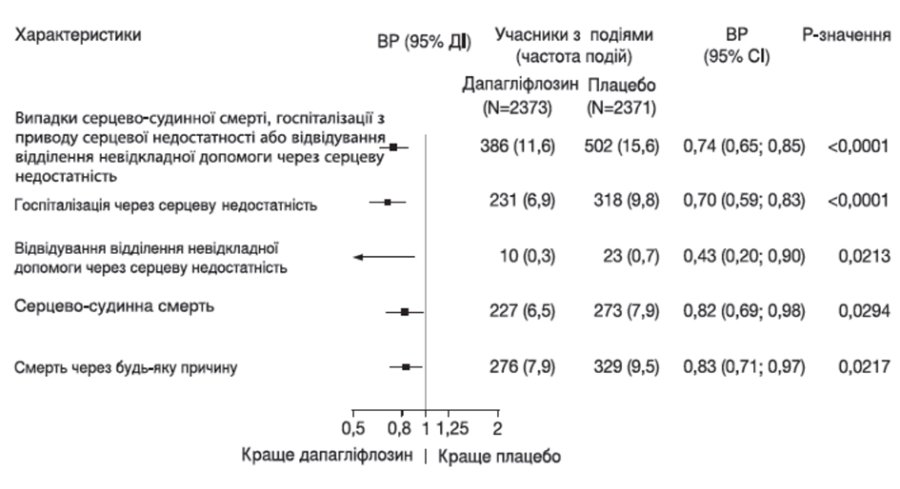
Відвідування відділення невідкладної допомоги через серцеву недостатність було визначено як термінове, незаплановане обстеження лікарем, наприклад, у відділенні невідкладної допомоги, та потреба в лікуванні при погіршенні серцевої недостатності (крім простого збільшення прийому пероральних діуретиків).
Кількість перших подій для окремих компонентів є фактичною кількістю перших подій для кожного компонента і не додається до числа подій у комбінованій кінцевій точці.
Частота подій представлена як відношення кількості учасників з подіями до 100 пацієнто-років спостереження.
р-значення для окремих складових і смертності з усіх причин є номінальними.
Застосування дапагліфлозину також зменшило загальну кількість випадків госпіталізації з приводу серцевої недостатності (первинної та повторної) та серцево-судинної смерті; зареєстровано 567 випадків у групі дапагліфлозину в порівнянні з 742 випадками в групі плацебо (відношення ризиків 0,75 [95% ДІ 0,65; 0,88]; p = 0,0002).
Користь від лікування дапагліфлозином спостерігалась у пацієнтів із серцевою недостатністю як із цукровим діабетом 2 типу, так і без нього. Застосування дапагліфлозину знижувало первинну комбіновану кінцеву точку частоти серцево-судинної смерті та погіршення серцевої недостатності із ВР 0,75 (95 % ДІ 0,63; 0,90) у пацієнтів з цукровим діабетом та 0,73 (95 % ДІ 0,60; 0,88) у пацієнтів без цукрового діабету.
Користь від лікування дапагліфлозином порівняно з плацебо щодо первинної кінцевої точки також прослідковувалась в інших ключових підгрупах, у т. ч. у підгрупах із супутнім лікуванням серцевої недостатності, функції нирок (рШКФ), у підгрупах за віком, статтю та регіоном.
Результати лікування, що повідомляються пацієнтами, — симптоми серцевої недостатності
Вплив дапагліфлозину на симптоми серцевої недостатності оцінювали за загальним балом симптомів Канзаського опитувальника для оцінки пацієнтів із кардіоміопатією (KCCQ-TSS), який визначає частоту та тяжкість симптомів серцевої недостатності, включаючи втому, периферичні набряки, задишку та ортопное. Бали у діапазонів від 0 до 100, при цьому більш високі бали відповідають кращому стану здоров’я.
Лікування дапагліфлозином мало статистично та клінічно значущу перевагу у порівнянні з плацебо при симптомах серцевої недостатності, що визначалася за зміною від вихідного рівня на 8-му місяці за KCCQ-TSS (коефіцієнт переваги 1,18 [95% ДІ 1,11; 1,26]; p <0,0001). У результатах враховано частоту та тяжкість симптомів. Перевага спостерігалася як у покращенні симптомів серцевої недостатності, так і в запобіганні погіршенню симптомів серцевої недостатності.
В аналізах відповідей респондентів частка пацієнтів із клінічно значущим покращенням за KCCQ-TSS через 8 місяців від вихідного рівня, визначеним як 5 балів або більше, була вищою в групі дапагліфлозину порівняно з групою плацебо. Кількість пацієнтів із клінічно значущим погіршенням, визначеним як 5 балів або більше, була меншою в групі дапагліфлозину порівняно з групою плацебо. Переваги, що спостерігались при застосуванні дапагліфлозину, зберігалися при використанні більш консервативних граничних показників для більших клінічно значущих змін (таблиця 5).
Таблиця 5. Кількість і відсоткове співвідношення пацієнтів із клінічно значущим покращенням і погіршенням через 8 місяців за KCCQ-TSS
| Зміна вихідної оцінки через 8 місяців | Дапагліфлозин 10 мг na = 2086 | Плацебо na = 2062 | ||
| Покращення | n (%) покращенняb | n (%) покращенняb | Відношення ризиківc (95% ДІ) | p-значенняf |
| ≥5 балів | 933 (44,7) | 794 (38,5) | 1,14 (1,06; 1,22) | 0,0002 |
| ≥10 балів | 689 (33,0) | 579 (28,1) | 1,13 (1,05; 1,22) | 0,0018 |
| ≥15 балів | 474 (22,7) | 406 (19,7) | 1,10 (1,01; 1,19) | 0,0300 |
| Погіршення | n (%) погіршенняd | n (%) погіршенняd | Відношення ризиківe (95% ДІ) | p-значенняf |
| ≥5 балів | 537 (25,7) | 693 (33,6) | 0,84 (0,78; 0,89) | <0,0001 |
| ≥10 балів | 395 (18,9) | 506 (24,5) | 0,85 (0,79; 0,92) | <0,0001 |
aКількість пацієнтів, які спостерігалися з KCCO-TSS або померли до завершення 8 місяців.
bКількість пацієнтів, у яких спостерігалося покращення принаймні на 5, 10 або 15 балів у порівнянні з вихідним рівнем. Пацієнти, які померли до визначеного часу вважаються такими, в яких покращення не спостерігалось.
cДля покращення відношення ризиків > 1 з перевагою на користь дапагліфлозину 10 мг.
dКількість пацієнтів, у яких спостерігалося погіршення принаймні на 5 або 10 балів у порівнянні з вихідним рівнем. Пацієнти, які померли до визначеного часу, , вважаються такими, в яких спостерігалося погіршення.
eДля погіршення відношення ризиків <1 з перевагою на користь дапагліфлозину 10 мг.
fp-значення номінальні.
Нефропатія
Спостерігалося небагато подій ниркової комбінованої кінцевої точки (підтверджене стійке зниження рівня рШКФ ≥50%, ТСНН або смерть через ниркові захворювання); частота склала 1,2% у групі дапагліфлозину та 1,6% у групі плацебо.
Дослідження DELIVER: серцева недостатність із фракцією викиду лівого шлуночка >40%
DELIVER (Dapagliflozin Evaluation to Improve the LIVEs of Patients with PREserved Ejection Fraction Heart Failure, Оцінка здатності дапагліфлозину покращувати життя пацієнтів із серцевою недостатністю зі збереженою фракцією викиду) — це міжнародне багатоцентрове рандомізоване подвійне сліпе плацебо-контрольоване дослідження за участю пацієнтів віком ≥ 40 років із серцевою недостатністю (II–IV клас за класифікацією NYHA) з ФВЛШ >40% і ознаками структурних патологій серця, метою якого є визначення впливу дапагліфлозину на частоту випадків серцево-судинної смерті та погіршення перебігу серцевої недостатності у порівнянні з плацебо.
6263 учасники дослідження були розподілені на групи: застосування дапагліфлозину у дозі 10 мг — 3131 пацієнт; застосування плацебо — 3132 пацієнти. Середній час спостереження становив 28 місяців. Серед учасників дослідження 654 (10%) пацієнти мали підгостру серцеву недостатність (вони визначаються як рандомізовані під час госпіталізації з приводу серцевої недостатності або протягом 30 днів після виписки). Середній вік популяції дослідження становив 72 роки, 56% пацієнтів були чоловічої статі.
На початку дослідження 75% пацієнтів були віднесені до II класу за класифікацією NYHA, 24% — до III класу і 0,3% — до IV класу. Медіана ФВЛШ становила 54%. У 34% пацієнтів ФВЛШ становила ≤49%, у 36% — 50–59%, а у 30% — ≥60%. У кожній групі дослідження у 45% пацієнтів в анамнезі був цукровий діабет 2-го типу. Базова терапія включала інгібітори ангіотензинперетворюючого ферменту (іАПФ)/блокатори рецепторів ангіотензину II (БРА)/ інгібітори рецептора ангіотензину/неприлізину (ІРАН) (77%), блокатори β-адренорецепторів (83%), діуретики (98%) та антагоністи мінералокортикоїдних рецепторів (АМКР) (43%).
Середнє значення рШКФ становило 61 мл/хв/1,73 м2. У 49% пацієнтів показник рШКФ становив <60 мл/хв/1,73 м2, у 23% — < 45 мл/хв/1,73 м2, а у 3% — <30 мл/хв/1,73 м2.
Дапагліфлозин переважав плацебо у зниженні частоти первинної комбінованої кінцевої точки серцево-судинної смерті, госпіталізації з приводу серцевої недостатності або термінового звернення за медичною допомогою через серцеву недостатність (ВР 0,82 [95% ДІ 0,73, 0,92]; p = 0,0008) (рисунок 3).
Рисунок 3. Час до першого виникнення первинної комбінованої кінцевої точки серцево-судинної смерті, госпіталізації з приводу серцевої недостатності або термінового звернення за медичною допомогою через серцеву недостатність
Термінове звернення за медичною допомогою через серцеву недостатність визначали як невідкладний незапланований огляд лікарем, наприклад, у відділенні невідкладної допомоги, та потребу в лікуванні загострення серцевої недостатності (окрім збільшення дози пероральних діуретиків).
Пацієнти групи ризику — це кількість пацієнтів, які перебувають у групі ризику на початку періоду.
На рисунку 4 зображено внесок трьох компонентів первинної комбінованої точки в показник ефективності лікування.
Рисунок 4. Ефективність лікування для первинної комбінованої кінцевої точки та її компонентів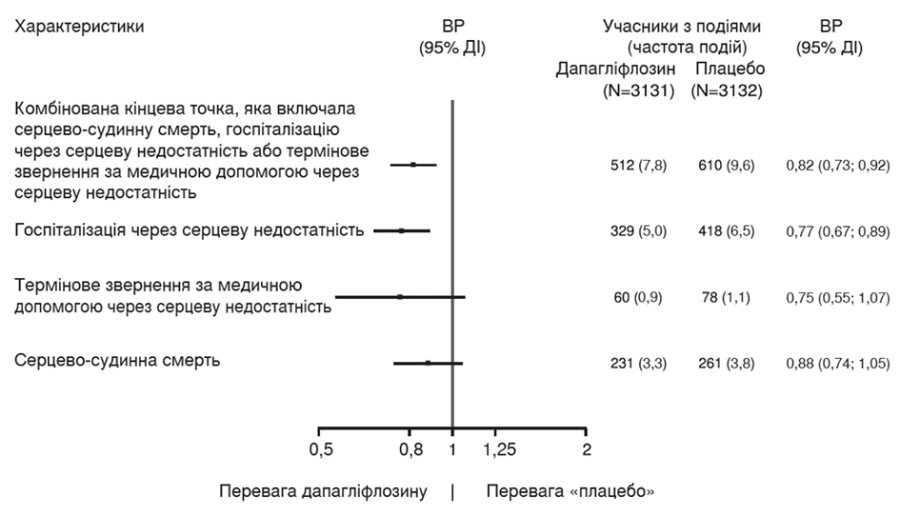
Термінове звернення за медичною допомогою через серцеву недостатність визначали як невідкладний незапланований огляд лікарем, наприклад, у відділенні невідкладної допомоги, та потребу в лікуванні загострення серцевої недостатності (окрім збільшення дози пероральних діуретиків).
Кількість перших подій для окремих компонентів є фактичною кількістю перших подій для кожного компонента, що не додається до кількості подій у комбінованій кінцевій точці.
Частота подій — це кількість пацієнтів, у яких була зафіксована відповідна подія, на 100 пацієнто-років спостереження.
Дані щодо серцево-судинної смерті, представленої тут як компонент первинної кінцевої точки, також аналізували з формальним контролем помилок I типу як вторинну кінцеву точку.
Дапагліфлозин переважав плацебо у зменшенні загальної кількості подій, пов’язаних із серцевою недостатністю (визначених як перша та повторна госпіталізації з приводу серцевої недостатності або термінове звернення за медичною допомогою через серцеву недостатність), та серцево-судинної смерті. У групі дапагліфлозину було зафіксовано 815 таких подій, а у групі плацебо — 1057 (відношення ризиків 0,77 [95% ДІ 0,67, 0,89]; p = 0,0003).
Користь від лікування дапагліфлозином щодо впливу на первинну кінцеву точку у порівнянні з плацебо спостерігалася в підгрупах пацієнтів із ФВЛШ ≤49%, 50–59% та ≥60%. Ефекти в інших ключових підгрупах, категоризованих, наприклад, за віком, статтю, класом NYHA, рівнем NT-proBNP, наявністю чи відсутністю підгострого стану, а також наявністю чи відсутністю цукрового діабету 2-го типу, також були послідовними.
Результати лікування, повідомлені пацієнтом, — симптоми серцевої недостатності
У порівнянні з плацебо, лікування дапагліфлозином мало статистично значущу користь з точки зору симптомів серцевої недостатності, яка визначалася за зміною загальної оцінки за Канзаським опитувальником для пацієнтів із кардіоміопатією (KCCQ-TSS) через 8 місяців у порівнянні з вихідним рівнем (коефіцієнт переваги 1,11 [95% ДІ 1,03, 1,21]; p = 0,0086). На результати вплинули як частота виникнення, так і тяжкість симптомів.
В аналізах відповідей респондентів частка пацієнтів, у яких через 8 місяців спостерігалося помірне (≥5 балів) або значне (≥14 балів) погіршення оцінки KCCQ-TSS у порівнянні з вихідним рівнем, була нижчою в групі лікування дапагліфлозином; у 24,1% пацієнтів, які отримували дапагліфлозин, та 29,1% пацієнтів, які отримували плацебо, відзначалося помірне погіршення (відношення шансів 0,78 [95% ДІ 0,64, 0,95]). Водночас у 13,5% пацієнтів групи дапагліфлозину та 18,4% пацієнтів групи плацебо спостерігалося значне погіршення (відношення шансів 0,70 [95% ДІ 0,55, 0,88]). Частки пацієнтів з незначним або помірним поліпшенням (≥13 балів) або значним поліпшенням (≥17 балів) у групах дослідження не відрізнялися.
Серцева недостатність у дослідженнях DAPA-HF і DELIVER
За результатами об’єднаного аналізу досліджень DAPA-HF і DELIVER у разі застосування дапагліфлозину у порівнянні з плацебо ВР комбінованої кінцевої точки серцево-судинної смерті, госпіталізації з приводу серцевої недостатності або термінового звернення за медичною допомогою через серцеву недостатність становило 0,78 (95% ДІ 0,72, 0,85), p <0,0001. Ефект лікування був послідовним у всьому діапазоні ФВЛШ без послаблення ефекту залежно від ФВЛШ.
Згідно з результатами попередньо визначеного об’єднаного аналізу досліджень DAPA-HF і DELIVER дапагліфлозин у порівнянні з плацебо знижував ризик серцево-судинної смерті (ВР 0,85 [95 % ДІ 0,75, 0,96], p = 0,0115). Обидва дослідження зробили внесок у визначення ефективності.
Хронічна хвороба нирок
Дослідження впливу дапагліфлозину на нирки та на смертність через серцево-судинні захворювання в пацієнтів із хронічною хворобою нирок (DAPA-CKD) було міжнародним, багатоцентровим, рандомізованим, подвійно сліпим, плацебоконтрольованим дослідженням за участю пацієнтів з хронічною хворобою нирок (ХХН) з рШКФ від ≥25 до ≤75 мл/хв/1,73 м2 та альбумінурією (UACR від ≥200 до ≤5000 мг/г), метою якого було визначення впливу дапагліфлозину у порівнянні з плацебо при додаванні його до стандартного лікування на частоту комбінованої кінцевої точки — стійкого зниження рШКФ на ≥50%, термінальної стадії ниркової недостатності (ТСНН) (визначається як стійка рШКФ <15 мл/хв/1,73 м2, лікування хронічним діалізом або трансплантація нирки), смерті через серцево-судинні або ниркові захворювання.
Із 4304 учасників дослідження 2 152 пацієнти були рандомізовані до групи застосування 10 мг дапагліфлозину і 2 152 — до групи плацебо, медіана спостереження становила 28,5 місяця. Лікування тривало, якщо рівень рШКФ знижувався нижче 25 мл/хв/1,73 м2 протягом дослідження, та могло тривати у разі виникнення потреби у діалізі.
Середній вік досліджуваної популяції становив 61,8 року, 66,9% учасників дослідження були чоловіками. На вихідному рівні середнє значення рШКФ становило 43,1 мл/хв/1,73 м2, а медіана UACR становила 949,3 мг/г, у 44,1% пацієнтів відзначалася рШКФ від 30 до <45 мл/хв/1,73 м2, а у 14,5% рШКФ становила <30 мл/хв/1,73 м2. У 67,5% пацієнтів був цукровий діабет 2 типу. Пацієнти отримували стандартне лікування; 97,0% пацієнтів отримували лікування інгібітором ангіотензинперетворюючого ферменту (іАПФ) або блокатором рецепторів ангіотензину (БРА).
Дослідження було припинено достроково для оцінки ефективності до запланованого аналізу на підставі рекомендації незалежного комітету з моніторингу даних. Дапагліфлозин перевершував плацебо щодо попередження первинної комбінованої кінцевої точки — стійкого зниження рШКФ на ≥50%, досягнення термінальної стадії ниркової недостатності, смерті через ниркові або серцево-судинні захворювання. Згідно з графіком Каплана – Мейєра часу до першого виникнення первинної комбінованої кінцевої точки ефект лікування очевидний з 4 місяців та зберігався до кінця дослідження (рисунок 5).
Рисунок 5. Час до першого виникнення первинної комбінованої кінцевої точки — стійкого зниження рШКФ на ≥50%, розвитку термінальної стадії ниркової недостатності, смерті через ниркові або серцево-судинні захворювання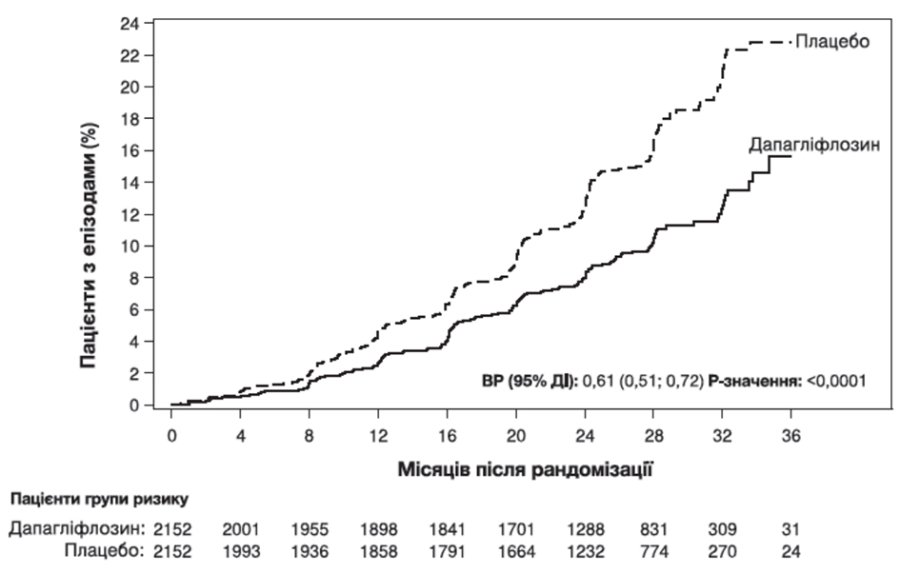
Пацієнти групи ризику — це кількість пацієнтів, які перебувають у групі ризику на початку періоду дослідження.
Усі чотири компоненти первинної комбінованої кінцевої точки окремо сприяли ефекту лікування. Дапагліфлозин також знижував ризик подій кінцевої точки — стійкого зниження рШКФ на ≥ 50 %, термінальної стадії ниркової недостатності або смерті через ниркові захворювання та комбінованої кінцевої точки — смерті через серцево-судинні захворювання та госпіталізації з приводу серцевої недостатності. Лікування дапагліфлозином покращило загальну виживаність у пацієнтів із хронічною хворобою нирок з достовірним зниженням частоти смерті з будь-якої причини (рисунок 6).
Рисунок 6. Ефекти лікування за первинними та вторинними комбінованими кінцевими точками, їхніми окремими компонентами та смертністю з будь-якої причини
Кількість перших подій для окремих компонентів є фактичною кількістю перших подій для кожного компонента і не додається до кількості подій у комбінованій кінцевій точці.
Частота подій представлена як відношення кількості учасників з явищами до 100 пацієнто-років спостереження.
Оцінки відношення ризиків не представлені для підгруп із загальною кількістю подій менше ніж 15 в обох групах.
Переваги лікування дапагліфлозином у пацієнтів із хронічною хворобою нирок із цукровим діабетом 2 типу відповідали таким у пацієнтів без цукрового діабету. Дапагліфлозин знижував первинну комбіновану кінцеву точку — стійке зниження рШКФ на ≥50%, досягнення термінальної стадії ниркової недостатності, смерть через ниркові або серцево-судинні захворювання — з ВР 0,64 (95% ДІ 0,52; 0,79) у пацієнтів з цукровим діабетом 2 типу та 0,50 (95% ДІ 0,35; 0,72) у пацієнтів без цукрового діабету.
Переваги лікування дапагліфлозином над плацебо щодо первинної кінцевої точки також були послідовними в інших ключових підгрупах, зокрема у підгрупах за рШКФ, віком, статтю та регіоном.
Діти
Цукровий діабет 2 типу
У клінічному дослідженні за участю пацієнтів віком 10–24 роки з цукровим діабетом 2 типу 39 пацієнтів було рандомізовано до групи застосування дапагліфлозину 10 мг як додаткового лікування до метформіну, інсуліну або комбінації метформіну та інсуліну, а 33 пацієнти — до групи плацебо. На момент рандомізації 74% пацієнтів були віком до 18 років.
Скоригована середня зміна від вихідного рівня HbA1c у групі застосування дапагліфлозину відносно плацебо до тижня 24 становила –0,75% (95% ДІ [довірчий інтервал] –1,65; 0,15). У віковій групі <18 років скоригована середня зміна HbA1c у групі дапагліфлозину відносно плацебо становила –0,59% (95% ДІ –1,66; 0,48). У віковій групі ≥18 років скоригована середня зміна HbA1c від вихідного рівня становила –1,52% у групі застосування дапагліфлозину (n = 9) і 0,17% у групі застосування плацебо (n = 6). Ефективність та безпека були схожими з тими, що спостерігалися у дорослій популяції, яка отримувала лікування дапагліфлозином. Безпека та переносимість були додатково підтверджені під час дослідження 28-тижневого продовження лікування.
Серцева недостатність та хронічна хвороба нирок
Європейське агентство з лікарських засобів відстрочило зобов’язання щодо надання результатів досліджень застосування дапагліфлозину в одній або декількох підгрупах дітей для профілактики серцево-судинних ускладнень у пацієнтів із хронічною серцевою недостатністю та при лікуванні хронічної хвороби нирок (про застосування дітям див. розділ Діти).
Фармакокінетика.
Всмоктування. Дапагліфлозин швидко і добре всмоктувався після перорального застосування. Максимальні концентрації дапагліфлозину в плазмі крові (Cmax) звичайно досягалися протягом 2 годин після застосування лікарського засобу натще. Середні геометричні значення Cmax і AUCτ дапагліфлозину при досягненні рівноважної концентрації після застосування дапагліфлозину в дозах 10 мг один раз на добу становили 158 нг/мл і 628 нг год/мл відповідно. Абсолютна біодоступність дапагліфлозину після перорального застосування лікарського засобу у дозі 10 мг становить 78%. Застосування лікарського засобу з їжею з високим вмістом жирів знижувало Cmax дапагліфлозину на 50% і подовжувало показник Tmax приблизно на 1 годину, але не змінювало показник AUC порівняно з прийомом лікарського засобу натще. Ці зміни не вважаються клінічно значущими. Таким чином, лікарський засіб Форксіга можна застосовувати незалежно від прийому їжі.
Розподіл. Дапагліфлозин зв’язується з білками приблизно на 91%. При різних захворюваннях зв’язування лікарського засобу з білками не змінювалося (наприклад при порушенні функції нирок або печінки). Середній об’єм розподілу дапагліфлозину при досягненні рівноважної концентрації становив 118 л.
Біотрансформація. Дапагліфлозин широко метаболізується, в першу чергу з утворенням дапагліфлозину 3-О-глюкуроніду, що є неактивним метаболітом. Дапагліфлозин 3-О-глюкуронід або інші метаболіти не забезпечують глюкозознижувальну дію. Утворення дапагліфлозину 3-О-глюкуроніду опосередковане UGT1A9, ферментом у печінці та нирках, а метаболізм, опосередкований CYP, у людей не відігравав значної ролі у кліренсі.
Виведення. Середній кінцевий період напіввиведення з плазми крові (t½) дапагліфлозину у здорових учасників дослідження становив 12,9 години після одноразового перорального прийому дапагліфлозину в дозі 10 мг. Середній загальний системний кліренс дапагліфлозину, введеного внутрішньовенно, складав 207 мл/хв.
Дапагліфлозин і пов’язані з ним метаболіти в основному виводяться шляхом екскреції із сечею, причому менше 2% дапагліфлозину виводиться в незміненому вигляді. Після застосування дози 50 мг [14С]-дапагліфлозину виводилося 96% дози: 75% – із сечею і 21% — з калом. Приблизно 15% дози виводилося з калом у незміненому вигляді.
Лінійність. Вплив дапагліфлозину збільшувався пропорційно збільшенню дози дапагліфлозину в діапазоні від 0,1 до 500 мг, а його фармакокінетика не змінювалася з часом при повторному добовому дозуванні протягом до 24 тижнів.
Особливі групи пацієнтів
Порушення функції нирок
Середня системна експозиція дапагліфлозину у рівноважному стані (20 мг дапагліфлозину один раз на добу протягом 7 діб) у пацієнтів із цукровим діабетом 2 типу та порушенням функції нирок легкого, середнього та тяжкого ступенів (що визначається за плазмовим кліренсом йогексолу) була на 32%, 60% та 87% відповідно вище за таку у пацієнтів із цукровим діабетом 2 типу з нормальною функцією нирок. Добова екскреція глюкози із сечею при рівноважній концентрації лікарського засобу значною мірою залежала від функції нирок і становила 85, 52, 18 та 11 г глюкози на добу у пацієнтів із цукровим діабетом 2 типу та нормальною функцією нирок або з порушенням функції нирок легкого, середнього або тяжкого ступеня відповідно. Вплив гемодіалізу на експозицію дапагліфлозину невідомий.
Вплив зниженої ниркової функції на системну експозицію оцінювали на популяційній фармакокінетичній моделі. Відповідно до попередніх результатів значення AUC, прогнозоване на підставі застосованої моделі, було вищим у пацієнтів із хронічною хворобою нирок у порівнянні з таким у пацієнтів з нормальною функцією нирок, а також суттєво не відрізнялося у пацієнтів із хронічною хворобою нирок із цукровим діабетом 2 типу та без цукрового діабету.
Порушення функції печінки
У пацієнтів з порушенням функції печінки легкого або середнього ступеня (клас А і клас В за класифікацією Чайлда–П’ю) середні значення Cmax і AUC дапагліфлозину були вище на 12% і 36% відповідно у порівнянні з відповідними показниками у здорових учасників дослідження в контрольній групі. Такі відмінності не вважаються клінічно значущими. У пацієнтів з порушенням функції печінки тяжкого ступеня (клас С за класифікацією Чайлда–П’ю) середні показники Cmax і AUC дапагліфлозину були на 40% і 67% відповідно вище ніж ті ж показники у здорових учасників дослідження в контрольній групі.
Пацієнти літнього віку (≥65 років)
У пацієнтів віком до 70 років клінічно значущого збільшення експозиції лікарського засобу в залежності тільки від віку не спостерігається. Однак можна очікувати підвищеної експозиції лікарського засобу у зв’язку зі зниженням функції нирок з віком. Недостатньо даних для того, щоб зробити висновки щодо експозиції у пацієнтів віком >70 років.
Діти
Фармакокінетика та фармакодинаміка (глюкозурія) у дітей з цукровим діабетом 2 типу віком 10–17 років були подібними до тих, що спостерігалися у дорослих із цукровим діабетом 2 типу.
Стать
Середній показник AUCss дапагліфлозину у жінок, за оцінками, був приблизно на 22% вище, ніж у чоловіків.
Расова належність
Ніяких клінічно значущих відмінностей у системній експозиції лікарського засобу між представниками європеоїдної, негроїдної або монголоїдної раси не спостерігалося.
Маса тіла
Експозиція дапагліфлозину знижувалася при збільшенні маси тіла. Отже, пацієнти з низькою масою тіла можуть мати дещо підвищену експозицію лікарського засобу, а пацієнти з високою масою тіла — дещо знижену експозицію лікарського засобу. Однак відмінності в експозиції не вважалися клінічно значущими.
Показання Форксіга
Цукровий діабет 2-го типу. Препарат Форксіга показаний дорослим для лікування недостатньо контрольованого цукрового діабету 2-го типу як доповнення до дієти та фізичних навантажень:
– як монотерапія, коли застосування метформіну вважається неможливим через непереносимість препарату;
– у поєднанні з іншими лікарськими засобами для лікування цукрового діабету 2-го типу.
Результати досліджень щодо вивчення поєднання препаратів, впливу на глікемічний контроль, серцево-судині та ниркові події, а також дослідження популяцій, див. у ОСОБЛИВОСТІ ЗАСТОСУВАННЯ, ВЗАЄМОДІЯ З ІНШИМИ ЛІКАРСЬКИМИ ЗАСОБАМИ та Фармакодинаміка).
Серцева недостатність. Препарат Форксіга показаний для лікування дорослих із симптоматичною хронічною серцевою недостатністю.
Хронічна хвороба нирок. Препарат Форксіга показаний для лікування дорослих із хронічною хворобою нирок.
Застосування Форксіга
дозування
Цукровий діабет 2-го типу. Рекомендована доза дапагліфлозину становить 10 мг один раз на добу.
При застосуванні дапагліфлозину в комбінації з інсуліном або засобами, що посилюють секрецію інсуліну, такими як сульфонілсечовина, з метою зниження ризику розвитку гіпоглікемії слід розглянути можливість застосування інсуліну в низьких дозах або засобів, що посилюють секрецію інсуліну (див. ВЗАЄМОДІЯ З ІНШИМИ ЛІКАРСЬКИМИ ЗАСОБАМИ і ПОБІЧНА ДІЯ).
Серцева недостатність. Рекомендована доза дапагліфлозину становить 10 мг один раз на добу.
Хронічна хвороба нирок. Рекомендована доза дапагліфлозину становить 10 мг один раз на добу.
Особливі групи пацієнтів
Пацієнти з порушенням функції нирок. Корекція дози на основі функції нирок не потрібна.
Через обмежений досвід не рекомендується починати лікування дапагліфлозином у пацієнтів із ШКФ <25 мл/хв.
У пацієнтів з цукровим діабетом цукрознижувальна ефективність дапагліфлозину знижується, коли ШКФ <45 мл/хв, та, ймовірно, відсутня у пацієнтів з тяжкими порушеннями функції нирок. Тому, якщо показник ШКФ нижче 45 мл/хв, потрібно розглянути можливість застосування додаткової гіпоглікемічної терапії для пацієнтів з цукровим діабетом, які потребують додаткового глікемічного контролю (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ, ПОБІЧНА ДІЯ, Фармакодинаміка та Фармакокінетика).
Пацієнти з порушенням функції печінки. Пацієнтам з порушенням функції печінки легкого чи середнього ступеня корекція дози не потрібна. Пацієнтам із тяжким порушенням функції печінки препарат рекомендується у початковій дозі 5 мг. Якщо препарат добре переноситься, дозу можна підвищити до 10 мг (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ та Фармакокінетика).
Пацієнти літнього віку (≥65 років). Корекція дози препарату у зв’язку з віком пацієнта не потрібна.
Спосіб застосування. Лікарський засіб Форксіга потрібно приймати внутрішньо один раз на добу в будь-який час доби, незалежно від прийому їжі. Таблетки слід ковтати цілими.
Діти. Для лікування цукрового діабету 2 типу у дітей віком від 10 років корекція дози лікарського засобу не потрібна (див. Фармакодинаміка та Фармакокінетика). Даних щодо застосування лікарського засобу дітям віком до 10 років немає.
Безпека та ефективність дапагліфлозину для лікування серцевої недостатності або лікування хронічної хвороби нирок для дітей віком ˂18 років на цей час ще не встановлені. Дані відсутні.
Протипоказання
підвищена чутливість до діючої речовини або до будь-якої із допоміжних речовин.
Побічна дія
резюме профілю безпеки
Цукровий діабет 2 типу
У клінічних дослідженнях діабету 2 типу понад 15 000 пацієнтів отримували лікування дапагліфлозином.
Проведено первинну оцінку безпеки та переносимості у попередньо запланованому об’єднаному аналізі 13 короткострокових (до 24 тижнів) плацебо-контрольованих дослідженнях, за участі 2360 пацієнтів, які отримували дапагліфлозин у дозі 10 мг і 2295, які отримували плацебо.
У клінічному дослідженні впливу дапагліфлозину на серцево-судинну систему у пацієнтів з цукровим діабетом 2 типу (дослідження DECLARE, див. Фармакодинаміка) 8574 пацієнтів отримували дапагліфлозин у дозі 10 мг та 8569 пацієнтів отримували плацебо для середнього часу експозиції 48 місяців. Усього було 30623 пацієнто-років експозиції дапагліфлозину.
Найбільш частою побічною реакцією протягом клінічних досліджень були генітальні інфекції.
Серцева недостатність
У дослідженні впливу дапагліфлозину на серцево-судинну систему пацієнтів із серцевою недостатністю зі зниженою фракцією викиду (дослідження DAPA-HF) 2368 пацієнтів отримували 10 мг дапагліфлозину та 2368 пацієнтів — плацебо з середньою медіаною часу 18 місяців. Популяція пацієнтів включала пацієнтів із цукровим діабетом 2 типу та без нього, а також пацієнтів із рШКФ ≥30 мл/хв/1,73 м2. У дослідженні впливу дапагліфлозину на серцево-судинну систему пацієнтів із серцевою недостатністю з фракцією викиду лівого шлуночка >40% (DELIVER) 3126 учасників дослідження приймали дапагліфлозин у дозі 10 мг, а 3127 — отримували плацебо. Середній час лікування становив 27 місяців. Популяція досліджуваних включала пацієнтів із цукровим діабетом 2-го типу та без нього, а також пацієнтів з рШКФ ≥25 мл/хв/1,73 м2.
Загальний профіль безпеки дапагліфлозину у пацієнтів із серцевою недостатністю відповідав відомому профілю безпеки дапагліфлозину.
Хронічна хвороба нирок
У дослідженні впливу дапагліфлозину на нирки у пацієнтів із хронічною хворобою нирок (дослідження DAPA-CKD) 2149 пацієнтів отримували 10 мг дапагліфлозину та 2149 пацієнтів — плацебо з середньою медіаною часу 27 місяців. Популяція досліджуваних включала пацієнтів із цукровим діабетом 2 типу та без цукрового діабету, із рШКФ ≥25 до ≤75 мл/хв/1,73 м2 та альбумінурією (співвідношення альбумін/ креатинін в сечі [UACR] ≥200 та ≤5000 мг/г). Лікування продовжували, якщо рівень рШКФ знижувався нижче 25 мл/хв/1,73 м2.
Загальний профіль безпеки дапагліфлозину в пацієнтів із хронічною хворобою нирок відповідав відомому профілю безпеки дапагліфлозину.
Перелік побічних реакцій
Наведені нижче побічні реакції були ідентифіковані у плацебо-контрольованих клінічних дослідженнях. Встановлено, що жодна з них не була дозозалежною. Побічні реакції класифікуються за частотою та системами органів. Категорії частоти визначалися згідно з такими критеріями: дуже часто (≥1/10); часто (від ≥1/100 до <1/10); нечасто (від ≥1/1000 до <1/100); рідко (від ≥1/10000 до <1/1000); дуже рідко (<1/10 000); частота невідома (неможливо оцінити на основі наявних даних).
Таблиця 6. Побічні реакції у плацебо-контрольованих дослідженняха та післяреєстраційний досвід застосування
| Система органів | Дуже часто | Часто* | Нечасто** | Рідко | Дуже рідко |
| Інфекції та інвазії | Вульвовагініт, баланіт і супутні інфекції статевих органів*,б,в Інфекція сечовивідних шляхів*,б,г | Грибкова інфекція** | Некротичний фасциїт промежини (гангрена Фурньє) | ||
| З боку обміну речовин і харчування | Гіпоглікемія (у разі застосування у комбінації із СС або інсуліном)б | Зменшення об’єму позаклітинної рідиниб,ґ Спрага** | Діабетичний кетоацидоз (при застосуванні при цукровому діабеті 2 типу)б,ж,и | ||
| З боку нервової системи | Запаморочення | ||||
| З боку травної системи | Запор** Сухість у роті** | ||||
| З боку шкіри та її похідних | Висипз | Ангіодема | |||
| З боку кістково-м’язової системи та сполучної тканини | Біль у спині* | ||||
| З боку нирок і сечовивідних шляхів | Дизурія Поліурія*,д | Ніктурія** | Тубулоінтер-стиціальний нефрит | ||
| З боку репродуктивної системи та молочних залоз | Свербіж у ділянці вульви та піхви** Свербіж у ділянці статевих органів** | ||||
| Відхилення від норми, виявлені у результаті лабораторних досліджень | Підвищений гематокрите Знижений нирковий кліренс креатиніну протягом початкового лікуванняб Дисліпідеміяє | Підвищений рівень креатиніну крові протягом початкового лікуванняб Підвищений рівень сечовини крові** Зменшення маси тіла** | |||
аУ таблиці представлені дані за період тривалістю до 24 тижнів (короткострокові дані), незалежно від надання невідкладної допомоги у разі підвищення чи зниження рівня глюкози крові.
бДодаткову інформацію можна знайти у відповідних підрозділах нижче.
вДо вульвовагініту, баланіту та супутніх інфекцій статевих органів належать, наприклад, такі попередньо визначені терміни переважного використання: вульвовагінальна грибкова інфекція, вагінальна інфекція, баланіт, грибкова інфекція статевих органів, вульвовагінальний кандидоз, вульвовагініт, кандидозний баланіт, кандидоз статевих органів, інфекція статевих органів, інфекція чоловічих статевих органів, інфекція пеніса, вульвіт, бактеріальний вагініт, абсцес вульви.
гДо інфекцій сечовивідних шляхів належать такі терміни переважного використання, наведені у порядку частоти: інфекція сечовивідних шляхів, цистит, ешерихіозна інфекція сечовивідних шляхів, інфекція сечостатевих шляхів, пієлонефрит, тригоніт, уретрит, інфекція нирок та простатит.
ґДо зменшення об’єму позаклітинної рідини належать, наприклад, такі попередньо визначені терміни переважного використання: дегідратація, гіповолемія, артеріальна гіпотензія.
дДо поліурії належать такі терміни переважного використання: полакіурія, поліурія, збільшення об’єму сечовипускання.
еСередня зміна від вихідного рівня гематокриту становила 2,30% у разі застосування дапагліфлозину у дозі 10 мг порівняно з –0,33% у разі застосування плацебо. Показники гематокриту >55% спостерігалися у 1,3% пацієнтів, які отримували дапагліфлозин у дозі 10 мг порівняно з 0,4% пацієнтів, які отримували плацебо.
єСередня зміна у відсотках від вихідного рівня у разі застосування дапагліфлозину у дозі 10 мг порівняно з плацебо становила відповідно: загальний холестерин 2,5% проти 0,0%; холестерин ліпопротеїдів високої щільності (ЛПВЩ) 6,0% проти 2,7%; холестерин ліпопротеїдів низької щільності (ЛПНЩ) 2,9% проти –1,0%; тригліцериди –2,7% проти –0,7%.
жДив. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ.
зПобічна реакція була встановлена в ході післяреєстраційного спостереження. Наведені нижче терміни переважного застосування, що стосуються висипу, перелічені в порядку частоти повторюваності у клінічних дослідженнях: висип, генералізований висип, висип зі свербежем, макульозний висип, макуло-папульозний висип, пустульозний висип, везикульозний висип та еритематозний висип. В активно- та плацебо-контрольованих клінічних дослідженнях (дапагліфлозин, N = 5936; усі контролі, N = 3403) частота висипу була подібною у разі застосування дапагліфлозину (1,4%) та усіх контрольних лікарських засобів (1,4%).
иПро це повідомлялося в клінічному дослідженні з оцінки серцево-судинних подій у пацієнтів з діабетом 2 типу (DECLARE). Частота ґрунтується на річному показнику.
*Спостерігалися у ≥2% пацієнтів та на ≥1% і принаймні на 3 випадки частіше у пацієнтів, які отримували дапагліфлозин у дозі 10 мг, порівняно з плацебо.
**Оцінені дослідником як можливо пов’язані або пов’язані з досліджуваним лікуванням і спостерігалися у ≥0,2% пацієнтів та на ≥0,1% і принаймні на 3 випадки частіше у пацієнтів, які отримували дапагліфлозин у дозі 10 мг, порівняно з плацебо.
Опис окремих побічних реакцій
Вульвовагініт, баланіт та пов’язані інфекції статевих органів
У 13 об’єднаних дослідженнях безпеки, вульвовагініт, баланіт та по’вязані інфекції статевих органів спостерігались у 5,5% і 0,6% суб’єктів, що отримували дапагліфлозин у дозуванні 10 мг і плацебо відповідно. У більшості випадків інфекції були легкого або середнього ступеня тяжкості, у пацієнтів відзначалася відповідь на початковий курс стандартного лікування, і такі явища рідко ставали причиною припинення лікування дапагліфлозином. Ці інфекції частіше спостерігалися у жінок (8,4% та 1,2% у разі застосування дапагліфлозину та плацебо відповідно), а ймовірність рецидиву інфекції була вищою у пацієнтів з подібними проблемами в анамнезі.
У клінічному дослідженні DECLARE кількість пацієнтів із серйозними побічними реакціями генітальних інфекцій була малою та збалансованою: 2 пацієнти у кожній групі дапагліфлозину та плацебо.
У дослідженні DAPA-HF жоден пацієнт не повідомляв про серйозні побічні ефекти у вигляді інфекцій статевих органів у групі дапагліфлозину, у групі плацебо спостерігався один такий випадок. У групі дапагліфлозину було 7 (0,3%) пацієнтів з побічними реакціями, що призвели до припинення лікування через генітальні інфекції, і жодного в групі плацебо. У дослідженні DELIVER у 1 пацієнта (<0,1%) у кожній групі лікування було зафіксовано серйозне побічне явище у вигляді генітальної інфекції. У групі дапагліфлозину в 3 пацієнтів (0,1%) були зафіксовані побічні явища, які призвели до припинення лікування через генітальні інфекції. Водночас у групі плацебо не було жодного такого пацієнта.
У дослідженні DAPA-CKD в 3 (0,1%) пацієнтів групи застосування дапагліфлозину повідомлялося про серйозні побічні реакції інфекцій статевих органів, у групі плацебо про такі випадки не повідомлялося. У групі дапагліфлозину у трьох (0,1%) пацієнтів виникли побічні реакції, що призвели до припинення участі у дослідженні через інфекції статевих органів і у жодного пацієнта групи плацебо не повідомлялося таких побічних реакцій. Про інфекції статевих органів як про серйозні побічні явища або такі, що призвели до припинення участі в дослідженні, не повідомлялося у жодного з пацієнтів без цукрового діабету.
Некротизуючий фасціїт промежини (гангрена Фурньє)
Повідомлялося про випадки гангрени Фурньє в післяреєстраційний період у пацієнтів, які приймали інгібітори НЗКТГ2, зокрема дапагліфлозин (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
У дослідженні DECLARE впливу дапагліфлозину на результати серцево-судинних подій, проведеному за участю 17160 пацієнтів із цукровим діабетом 2 типу та середнім часом експозиції 48 місяців, було зареєстровано загалом 6 випадків гангрени Фурньє: один у групі, що отримувала лікування дапагліфлозином, та 5 у групі плацебо.
Гіпоглікемія
Частота гіпоглікемії залежала від типу базової терапії, що застосовувалася у клінічних дослідженнях цукрового діабету.
У дослідженнях застосування дапагліфлозину як монотерапії, як доповнення до метформіну або доповнення до ситагліптину (з метформіном або без) частота незначних епізодів гіпоглікемії була подібною (<5%) у різних групах лікування, включаючи плацебо, протягом періоду лікування тривалістю до 102 тижнів. В усіх дослідженнях значні епізоди гіпоглікемії траплялися нечасто та з порівнянною частотою у групах лікування дапагліфлозином і плацебо. У дослідженнях комбінацій із сульфонілсечовиною та інсуліном частота гіпоглікемії була вищою (див. ВЗАЄМОДІЯ З ІНШИМИ ЛІКАРСЬКИМИ ЗАСОБАМИ).
У дослідженні комбінації з глімепіридом у тижні 24 та 48 незначні епізоди гіпоглікемії частіше спостерігалися у групі лікування дапагліфлозином у дозі 10 мг та глімепіридом (6,0% та 7,9% відповідно), ніж у групі плацебо та глімепіриду (2,1% та 2,1% відповідно).
У дослідженні комбінації з інсуліном повідомляли про епізоди вираженої гіпоглікемії у 0,5% та 1,0% пацієнтів, які отримували дапагліфлозин у дозі 10 мг та інсулін у тижні 24 і 104 відповідно, та у 0,5% пацієнтів, які отримували плацебо та інсулін, у тижні 24 і 104. У тижні 24 і 104 незначні епізоди гіпоглікемії спостерігалися відповідно у 40,3% та 53,1% пацієнтів, які отримували дапагліфлозин у дозі 10 мг та інсулін, та у 34,0% та 41,6% пацієнтів, які отримували плацебо та інсулін.
У дослідженні комбінації з метформіном та сульфонілсечовиною тривалістю до 24 тижнів епізодів вираженої гіпоглікемії не спостерігалось. Незначні епізоди гіпоглікемії спостерігалися у 12,8% пацієнтів, які отримували дапагліфлозин у дозі 10 мг і метформін та сульфонілсечовину, та у 3,7% пацієнтів, які отримували плацебо і метформін та сульфонілсечовину.
У клінічному дослідженні DECLARE не спостерігалось підвищення ризику важкої гіпоглікемії при терапії дапагліфлозином у порівнянні з плацебо. Повідомляли про епізоди важкої гіпоглікемії у 58 (0,7%) пацієнтів, що отримували дапагліфлозин і 83 (1,0%) пацієнтів, що отримували плацебо.
У дослідженні DAPA-HF про події вираженої гіпоглікемії повідомлялося в 4 (0,2%) пацієнтів як у групі дапагліфлозину, так і в групі плацебо. У дослідженні DELIVER у 6 пацієнтів (0,2%) групи дапагліфлозину і в 7 (0,2%) пацієнтів групи плацебо були зафіксовані події вираженої гіпоглікемії, проте вони спостерігалися лише у пацієнтів із цукровим діабетом 2 типу.
У дослідженні DAPA-CKD про епізоди вираженої гіпоглікемії повідомляли у 14 (0,7%) пацієнтів групи дапагліфлозину та у 28 (1,3%) пацієнтів групи плацебо, такі епізоди спостерігалися лише у пацієнтів із цукровим діабетом 2 типу.
Зменшення об’єму позаклітинної рідини
У 13 об’єднаних дослідженнях реакції, що свідчать про зменшення об’єму позаклітинної рідини (враховуючи повідомлення про випадки дегідратації, гіповолемії та артеріальної гіпотензії), спостерігалися у 1,1% та 0,7% пацієнтів, які отримували дапагліфлозин у дозі 10 мг і плацебо відповідно; серйозні побічні реакції виникали у <0,2% пацієнтів і розподілилися за частотою порівну між групами лікування дапагліфлозином у дозі 10 мг і плацебо (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
У клінічному дослідженні DECLARE кількість пацієнтів з епізодами, що свідчать про зменшення об’єму позаклітинної рідини розподілилися порівну між групами лікування: 213 (2,5%) і 207 (2,4%) у групах дапагліфлозину та плацебо відповідно. Серйозні побічні реакції спостерігались у 81 (0,9%) і 70 (0,8%) у групах дапагліфлозину та плацебо відповідно. В основному епізоди розподілились порівну між групами лікування в підгрупах за віком, використанням діуретиків, артеріальним тиском та використанням інгібіторів ангіотензинперетворюючого ферменту (іАПФ)/блокаторів рецепторів ангіотензину ІІ типу 1 (БРА). У пацієнтів з вихідною розрахованою швидкістю клубочкової фільтрації рШКФ <60 мл/хв/1,73 м2 спостерігалося 19 епізодів серйозних побічних реакцій, що свідчать про зменшенням об’єму позаклітинної рідини для групи дапагліфлозину та 13 епізодів у групі плацебо.
У дослідженні DAPA-HF кількість пацієнтів з явищами, що свідчать про зменшення об’єму позаклітинної рідини, становила 170 (7,2%) у групі дапагліфлозину та 153 (6,5%) у групі плацебо. У групі дапагліфлозину було менше пацієнтів із серйозними проявами симптомів (23 [1,0%]), що свідчать про зменшення об’єму позаклітинної рідини, порівняно з групою плацебо (38 [1,6%]). Результати були подібними незалежно від наявності цукрового діабету на вихідному рівні та вихідного показника рШКФ. У дослідженні DELIVER кількість пацієнтів з серйозними проявами симптомів гіповолемії становила 35 (1,1%) у групі дапагліфлозину і 31 (1,0%) у групі плацебо.
У дослідженні DAPA-CKD кількість пацієнтів з явищами, що свідчили про зменшення об’єму позаклітинної рідини, становила 120 (5,6%) у групі дапагліфлозину та 84 (3,9%) у групі плацебо. У групі дапагліфлозину було 16 (0,7%) пацієнтів із серйозними проявами симптомів, що свідчили про зменшення об’єму позаклітинної рідини, у порівнянні з 15 (0,7%) пацієнтами у групі плацебо.
Діабетичний кетоацидоз при цукровому діабеті 2 типу
У клінічному дослідженні DECLARE, з середнім часом експозиції 48 місяців, епізоди ДКА спостерігались у 27 пацієнтів у групі дапагліфлозину у дозуванні 10 мг і 12 пацієнтів у групі плацебо. Спостережувані епізоди рівномірно розподілилися протягом періоду дослідження. Серед 27 пацієнтів з епізодами ДКА у групі дапагліфлозину, 22 мали супутнє лікування інсуліном під час епізоду. Провокуючі фактори для ДКА були такими, як очікувалося, у популяції цукрового діабету 2 типу (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
У дослідженні DAPA-HF випадки ДКА були зареєстровані у 3 пацієнтів із цукровим діабетом 2 типу в групі дапагліфлозину та жодного — в групі плацебо. У дослідженні DELIVER випадки ДКА були зафіксовані у 2 пацієнтів із цукровим діабетом 2-го типу в групі дапагліфлозину та жодного — в групі плацебо.
У дослідженні DAPA-CKD про епізоди ДКА не повідомлялося у жодного пацієнта групи дапагліфлозину, у групі плацебо епізоди ДКА було зафіксовано у 2 пацієнтів із цукровим діабетом 2 типу.
Інфекції сечовивідних шляхів
У 13 об’єднаних дослідженнях безпеки інфекції сечовивідних шляхів частіше спостерігалися у пацієнтів, які отримували дапагліфлозин у дозі 10 мг, порівняно з тими, хто отримував плацебо (4,7% проти 3,5% відповідно; див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ). У більшості випадків інфекції були легкого або середнього ступеня тяжкості, у пацієнтів відзначалася відповідь на початковий курс стандартного лікування, і такі явища рідко ставали причиною дострокового припинення лікування дапагліфлозином. Ці інфекції частіше спостерігалися у жінок, а ймовірність рецидиву інфекції була вищою у пацієнтів з подібними проблемами в анамнезі.
У клінічному дослідженні DECLARE, серйозні епізоди інфекцій сечовивідних шляхів спостерігались рідше для дапагліфлозину у дозуванні по 10 мг, ніж для плацебо, 79 (0,9%) епізодів у порівнянні з 109 (1,3%) епізодів відповідно.
У дослідженні DAPA-HF кількість пацієнтів із серйозними побічними реакціями інфекцій сечовивідних шляхів становила 14 (0,6%) у групі дапагліфлозину та 17 (0,7%) у групі плацебо. П’ять (0,2%) пацієнтів із побічними реакціями були змушені припинити участь у дослідженні через інфекції сечовивідних шляхів і в групі дапагліфлозину, і в групі плацебо. У дослідженні DELIVER кількість пацієнтів із серйозними побічними явищами інфекцій сечовивідних шляхів становила 41 (1,3%) у групі дапагліфлозину та 37 (1,2%) у групі плацебо. Ці побічні явища призвели до припинення лікування у 13 пацієнтів (0,4%) групи дапагліфлозину і у 9 пацієнтів (0,3%) групи плацебо.
У дослідженні DAPA-CKD кількість пацієнтів із серйозними побічними явищами інфекцій сечовивідних шляхів становила 29 (1,3 %) у групі дапагліфлозину та 18 (0,8 %) у групі плацебо. Побічні реакції, що призвели до припинення участі у дослідженні через інфекції сечовивідних шляхів розвинулися у 8 (0,4 %) пацієнтів у групі дапагліфлозину та у 3 (0,1%) пацієнтів у групі плацебо. Кількість пацієнтів без цукрового діабету, у яких повідомлялося про серйозні побічні явища інфекцій сечовивідних шляхів або про побічні явища, що призвели до припинення участі в дослідженні через інфекції сечовивідних шляхів, була подібною у групах лікування (6 [0,9%] у порівнянні з 4 [0,6%] — з серйозними побічними явищами та 1 [0,1%] у порівнянні з 0 — з побічними явищами, що призвели до припинення участі в дослідженні, у групах дапагліфлозину та плацебо відповідно).
Підвищення рівня креатиніну
Побічні реакції на лікарський засіб, пов’язані з підвищенням рівня креатиніну, були згруповані (наприклад, зниження ниркового кліренсу креатиніну, порушення функції нирок, підвищення рівня креатиніну крові та зниження швидкості клубочкової фільтрації). У 13 об’єднаних дослідженнях безпеки згруповані побічні реакції спостерігалися у 3,2% та 1,8% пацієнтів, які отримували дапагліфлозин у дозі 10 мг і плацебо відповідно. У пацієнтів з нормальною функцією нирок або порушенням функції нирок легкого ступеня (вихідна рШКФ ≥60 мл/хв/1,73м2) реакції цієї групи спостерігалися у 1,3% та 0,8% пацієнтів, які отримували дапагліфлозин у дозі 10 мг і плацебо відповідно. Ці реакції частіше спостерігалися у пацієнтів з вихідною рШКФ ≥30 та <60 мл/хв/1,73 м2 (18,5% у разі застосування дапагліфлозину у дозі 10 мг та 9,3% у разі застосування плацебо).
Подальше спостереження за пацієнтами, у яких було зафіксовано побічні явища з боку нирок, показало, що у більшості відбувалися зміни рівня креатиніну в сироватці крові на ≤44 мкмоль/л (≤0,5 мг/дл) у порівнянні з вихідним рівнем. Рівень креатиніну зазвичай підвищувався тимчасово під час тривалого лікування і повертався до норми після припинення терапії.
У клінічному дослідженні DECLARE, зокрема пацієнтів літного віку та пацієнтів з порушенням функції нирок (рШКФ менше ніж 60 мл/хв/1,73 м2), рШКФ знижується з часом в обох групах лікування. Через 1 рік середнє значення рШКФ було дещо нижче, а через 4 роки середнє значення рШКФ було дещо вищим у групі дапагліфлозину порівняно з групою плацебо.
У дослідженнях DAPA-HF і DELIVER і в групі дапагліфлозину, і в групі плацебо показник рШКФ з часом знижувався. У дослідженні DAPA-HF початкове зниження середнього значення рШКФ у групі дапагліфлозину становило -4,3 мл/хв/1,73 м2, а в групі плацебо -1,1 мл/хв/1,73 м2. Через 20 місяців зміни показника рШКФ (у порівнянні з вихідним рівнем) у групах дослідження були зіставними: -5,3 мл/хв/1,73 м2 при застосуванні дапагліфлозину та -4,5 мл/хв/1,73 м2 при застосуванні плацебо. У дослідженні DELIVER зниження середнього значення рШКФ через 1 місяць у групі дапагліфлозину становило -3,7 мл/хв/1,73 м2, а в групі плацебо — -0,4 мл/хв/1,73 м2. Через 24 місяці зміни показника рШКФ (у порівнянні з вихідним рівнем) у групах дослідження були зіставними: -4,2 мл/хв/1,73 м2 у групі дапагліфлозину та -3,2 мл/хв/1,73 м2 у групі плацебо.
У дослідженні DAPA-CKD показник рШКФ із часом зменшувався як у групі дапагліфлозину, так і в групі плацебо. Початкове зменшення (день 14) середньої рШКФ становило -4,0 мл/хв/1,73 м2 у групі дапагліфлозину та -0,8 мл/хв/1,73 м2 у групі плацебо. Через 28 місяців зміна рШКФ від вихідного рівня становила -7,4 мл/хв/1,73 м2 у групі дапагліфлозину та -8,6 мл/хв/1,73 м2 у групі плацебо.
Діти. Профіль безпеки дапагліфлозину, що спостерігався у клінічному дослідженні за участю дітей віком від 10 років з цукровим діабетом 2 типу (див. Фармакокінетика), був аналогічний тому, що спостерігався у дослідженнях за участю дорослих.
Особливості застосування
загальні попередження
Дапагліфлозин не слід застосовувати пацієнтам із цукровим діабетом 1-го типу (див. нижче Діабетичний кетоацидоз).
Порушення функції нирок
Через обмежений досвід не рекомендується починати лікування дапагліфлозином пацієнтам з ШКФ <25 мл/хв.
Цукрознижувальна ефективність дапагліфлозину залежить від функції нирок і знижується у пацієнтів з ШКФ <45 мл/хв та, ймовірно, відсутня у пацієнтів з тяжкими порушеннями функції нирок (див. ЗАСТОСУВАННЯ, Фармакодинаміка та Фармакокінетика).
В одному дослідженні за участю пацієнтів із цукровим діабетом 2 типу із порушенням функції нирок середнього ступеня (ШКФ <60 мл/хв) побічні реакції у вигляді підвищення рівнів креатиніну, фосфору, паратиреоїдного гормону (ПТГ) і артеріальної гіпотензії спостерігалися частіше у пацієнтів, які отримували дапагліфлозин, ніж у тих, які отримували плацебо.
Порушення функції печінки
Досвід застосування лікарського засобу у клінічних дослідженнях за участю пацієнтів з порушенням функції печінки обмежений. Експозиція дапагліфлозину збільшується у пацієнтів з тяжким порушенням функції печінки (див. ЗАСТОСУВАННЯ та Фармакокінетика).
Застосування пацієнтам з ризиком зменшення об’єму міжклітинної рідини та/або артеріальною гіпотензією
Завдяки своєму механізму дії дапагліфлозин збільшує рівень діурезу, що може привести до помірного зниження артеріального тиску, що спостерігається в клінічних дослідженнях (див. Фармакокінетика). Це може бути більш виражено у пацієнтів з дуже високими рівнями глюкози в крові.
Слід дотримуватися обережності пацієнтам, для яких падіння артеріального тиску, викликане застосуванням дапагліфлозину, може становити небезпеку, наприклад, пацієнтам з артеріальною гіпотензією в анамнезі, які приймають антигіпертензивні лікарські засоби, або пацієнтам літнього віку.
У випадках супутніх захворювань, що можуть призвести до розвитку зменшення об’єму міжклітинної рідини (наприклад, захворювання шлунково-кишкового тракту), рекомендується проводити ретельний моніторинг ступеня зменшення об’єму міжклітинної рідини (наприклад, фізикальне обстеження, вимірювання артеріального тиску, лабораторні аналізи, включаючи рівень гематокриту) та рівнів електролітів. Пацієнтам, у яких виникає зменшення об’єму міжклітинної рідини, рекомендується тимчасове припинення лікування дапагліфлозином до того часу, поки зменшення об’єму міжклітинної рідини не буде усунене (див. ПОБІЧНА ДІЯ).
Діабетичний кетоацидоз
Були отримані повідомлення про рідкі випадки діабетичного кетоацидозу (ДКА), в тому числі загрозливого та фатального для життя, у пацієнтів, які отримували інгібітори натрійзалежного котранспортера глюкози 2-го типу (іНЗКТГ2), у тому числі дапагліфлозин. У ряді випадків стан проявлявся атипово, тільки помірним підвищенням рівня глюкози у крові не більше ніж до 14 ммоль/л (250 мг/дл).
Якщо у пацієнта спостерігаються неспецифічні симптоми, такі як нудота, блювання, анорексія, біль у животі, надмірна спрага, утруднене дихання, сплутаність свідомості, підвищена втомлюваність або сонливість, cлід враховувати ризик розвитку діабетичного кетоацидозу. При виникненні таких симптомів, незалежно від рівня глюкози крові, необхідно негайно обстежити пацієнта на предмет наявності кетоацидозу.
У пацієнтів з підозрою на ДКА або при його діагностуванні лікування дапагліфлозином слід негайно припинити.
Пацієнтам, госпіталізованим для проведення великих хірургічних втручань або з приводу серйозних гострих захворювань, лікування слід призупинити. У таких пацієнтів рекомендовано здійснювати моніторинг рівня кетонів. Перевагу віддають вимірюванню рівня кетонів у крові, а не у сечі. Лікування дапагліфлозином можна відновити після нормалізації рівня кетонів та стабілізації стану пацієнта.
Перед початком лікування дапагліфлозином слід розглянути фактори в анамнезі пацієнта, які можуть сприяти розвитку кетоацидозу.
До пацієнтів, які можуть мати підвищений ризик розвитку ДКА, належать пацієнти з низьким функціональним резервом бета-клітин (наприклад, пацієнти із цукровим діабетом 2 типу з низьким рівнем С-пептиду або з латентним аутоімунним діабетом дорослих (LADA) або пацієнти з панкреатитом в анамнезі), пацієнти зі станами, які можуть призводити до обмеженого вживання їжі або важкого зневоднення, пацієнти, дози інсуліну для яких знижені, та пацієнти зі збільшеною потребою в інсуліні внаслідок гострого захворювання, хірургічного втручання або зловживання алкоголем. Застосовувати іНЗКТГ2 таким пацієнтам слід з обережністю.
Відновлювати лікування іНЗКТГ2 пацієнтам з попередньо перенесеним ДКА, що виник під час лікування іНЗКТГ2, не рекомендується, окрім випадків, коли виявлено та усунено інший чіткий фактор розвитку ДКА.
Дані, отримані під час клінічних досліджень дапагліфлозину у пацієнтів із цукровим діабетом 1 типу, свідчать про те, що ДКА виникає із загальною частотою. Дапагліфлозин не слід застосовувати для лікування пацієнтів із цукровим діабетом 1-го типу.
Некротичний фасциїт промежини (гангрена Фурньє)
Повідомлялося про випадки некротичного фасциїту промежини (також відомого як гангрена Фурньє) у жінок та чоловіків, які отримували інгібітори НЗКТГ2 у післяреєстраційний період (див. ПОБІЧНА ДІЯ). Це є рідкісним, але серйозним та потенційно загрозливим для життя станом, що вимагає термінового хірургічного втручання та антибіотикотерапії.
Пацієнтам треба рекомендувати звертатися по медичну допомогу, якщо у них виникла комбінація таких симптомів, як біль, чутливість, еритема чи набряк у ділянці статевих органів чи промежини, що супроводжуються лихоманкою або нездужанням.
Треба знати, що некротичному фасциїту може передувати урогенітальна інфекція чи перинеальний абсцес. Якщо підозрюють гангрену Фурньє, застосування лікарського засобу Форксіга необхідно скасувати та негайно розпочати лікування (у т. ч. з антибіотиками та хірургічним видаленням некротичних мас).
Інфекції сечовивідних шляхів
Екскреція глюкози із сечею може бути пов’язана з підвищеним ризиком розвитку інфекції сечовивідних шляхів; таким чином, при лікуванні пієлонефриту або уросепсису може бути доцільним тимчасове припинення застосування дапагліфлозину.
Пацієнти літнього віку (≥65 років)
Пацієнти літнього віку мають більший ризик розвитку зменшення об’єму міжклітинної рідини, а також частіше отримують лікування діуретиками.
Пацієнти літнього віку частіше мають порушення ниркової функції та/або отримують лікування антигіпертензивними лікарськими засобами, що можуть спричиняти зміни ниркової функції, такими як інгібітори ангіотензинперетворюючого ферменту (іАПФ) та блокатори рецепторів ангіотензину ІІ типу 1 (БРА).
Для пацієнтів літнього віку надаються ті ж самі рекомендації стосовно ниркової функції, як і для всіх пацієнтів (див. ЗАСТОСУВАННЯ, ОСОБЛИВОСТІ ЗАСТОСУВАННЯ, ПОБІЧНА ДІЯ та Фармакодинаміка).
Серцева недостатність
Досвід застосування дапагліфлозину в рамках клінічних досліджень пацієнтам IV класом серцевої недостатності за класифікацією NYHA обмежений.
Інфільтративна кардіоміопатія
Дослідження за участю пацієнтів із інфільтративною кардіоміопатією не проводилися.
Хронічна хвороба нирок
Відсутній досвід застосування дапагліфлозину для лікування хронічної хвороби нирок у пацієнтів без цукрового діабету, які не мають альбумінурії. Пацієнти з альбумінурією можуть отримати більшу користь від лікування дапагліфлозином.
Ампутації нижніх кінцівок
У довгострокових поточних клінічних дослідженнях з іншими іНЗКТГ2 при цукровому діабеті 2 типу спостерігалось зростання кількості випадків ампутації нижніх кінцівок (головним чином, пальця стопи). Невідомо, чи це ефект класу лікарських засобів. Важливо радити пацієнтам із цукровим діабетом стандартний профілактичний догляд за стопою, як і всім хворим на цукровий діабет.
Оцінка лабораторних аналізів сечі
Пацієнти, які отримують лікарський засіб Форксіга, матимуть позитивні результати аналізу на глюкозу в сечі з огляду на механізм дії лікарського засобу.
Лактоза
Таблетки містять лактозу. Пацієнтам з рідкісними спадковими проблемами непереносимості галактози, лактазною недостатністю або мальабсорбцією глюкози-галактози не слід застосовувати цей лікарський засіб.
Застосування у період вагітності або годування груддю.
Вагітність. Даних щодо застосування дапагліфлозину вагітними жінками немає. Дослідження на щурах виявили токсичний вплив лікарського засобу на нирки у ході їх розвитку в період часу, що відповідає II і III триместру вагітності у людини. Таким чином, застосування дапагліфлозину не рекомендується під час II та III триместрів вагітності.
При встановленні факту вагітності лікування дапагліфлозином слід припинити.
Годування груддю. Невідомо, чи виділяється дапагліфлозин та/або його метаболіти у грудне молоко людини. Наявні дані, отримані у ході фармакологічних/токсикологічних досліджень, продемонстрували екскрецію дапагліфлозину/метаболітів у молоко, а також фармакологічно-опосередковані ефекти у потомства під час грудного вигодовування. Ризик для новонароджених/немовлят не може бути виключений. Дапагліфлозин не слід застосовувати під час годування груддю.
Репродуктивна функція. Вплив дапагліфлозину на репродуктивну функцію у людини не вивчався. У самців і самок тварин застосування дапагліфлозину не впливало на фертильність при застосуванні лікарського засобу в будь-якій досліджуваній дозі.
Здатність впливати на швидкість реакції при керуванні транспортними засобами чи роботі з іншими механізмами. Лікарський засіб Форксіга не впливає або незначно впливає на здатність керувати транспортними засобами та працювати з механізмами. Пацієнтів слід попередити про ризик розвитку гіпоглікемії під час застосування дапагліфлозину в поєднанні із сульфонілсечовиною або інсуліном.
Взаємодія з іншими лікарськими засобами
фармакодинамічні взаємодії
Діуретики. Застосування дапагліфлозину може збільшити діуретичний ефект тіазидних і петльових діуретиків, а також підвищити ризик розвитку дегідратації та артеріальної гіпотензії (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Інсулін та засоби, що посилюють секрецію інсуліну, такі як препарати сульфонілсечовини, викликають розвиток гіпоглікемії. Таким чином, для зниження ризику розвитку гіпоглікемії при застосуванні в комбінації з дапагліфлозином може бути доцільним застосування інсуліну у нижчих дозах або засобів, що посилюють секрецію інсуліну (див. ЗАСТОСУВАННЯ та ПОБІЧНА ДІЯ).
Фармакокінетичні взаємодії
Метаболізм дапагліфлозину проходить в основному шляхом кон’югації з глюкуронідом, опосередкованої УДФ-глюкуронілтрансферазою 1А9 (UGT1A9).
У ході проведення досліджень в умовах in vitro дапагліфлозин не пригнічував ізоферменти цитохрому P450 (CYP) 1A2, CYP 2A6, CYP 2B6, CYP 2C8, CYP 2C9, CYP 2C19, CYP 2D6, CYP 3A4 та не індукував CYP 1A2, CYP 2B6 або CYP 3A4. Таким чином, не очікується, що дапагліфлозин змінюватиме метаболічний кліренс одночасно застосовуваних лікарських засобів, що метаболізуються цими ферментами.
Вплив інших лікарських засобів на дапагліфлозин. Дослідження з вивчення взаємодії, проведені за участю здорових добровольців з використанням в основному однієї дози препарату, свідчать про те, що фармакокінетика дапагліфлозину не змінюється під дією метформіну, піоглітазону, ситагліптину, глімепіриду, воглібозу, гідрохлоротіазиду, буметаніду, валсартану або симвастатину.
Після одночасного застосування дапагліфлозину з рифампіцином (індуктором різних активних переносників та ферментів, що метаболізують лікарські засоби) спостерігалося зниження на 22% системної експозиції (АUC) дапагліфлозину, але без клінічно значущої дії на добову екскрецію глюкози із сечею. Коригування дози не рекомендується. Клінічно значущого ефекту при застосуванні препарату з іншими індукторами (наприклад карбамазепіном, фенітоїном, фенобарбіталом) не очікується.
Після одночасного застосування дапагліфлозину з мефенамовою кислотою (інгібітором UGT1A9) спостерігалося збільшення системної експозиції дапагліфлозину на 55%, але без клінічно значущої дії на добову екскрецію глюкози з сечею. Коригування дози не рекомендується.
Вплив дапагліфлозину на інші лікарські засоби. Дапагліфлозин може збільшувати виведення літію нирками, а рівень літію у крові може знизитися. Після початку застосування дапагліфлозину та зміни дози слід частіше контролювати концентрацію літію у сироватці крові. Необхідно направляти пацієнта до лікаря, який призначив препарат літію, для контролю концентрації літію у сироватці крові.
В дослідженнях з вивчення взаємодії, проведених за участю здорових добровольців з використанням в основному однієї дози лікарського засобу, дапагліфлозин не змінював фармакокінетику метформіну, піоглітазону, ситагліптину, глімепіриду, гідрохлоротіазиду, буметаніду, валсартану, дигоксину (субстрату P-gp) і варфарину (S-варфарину, субстрату CYP 2C19) або антикоагулянтні ефекти варфарину, що оцінювалися за міжнародним нормалізованим відношенням (МНВ). Поєднання разової дози дапагліфлозину 20 мг та симвастатину (субстрату CYP 3A4) призводило до збільшення AUC симвастатину на 19% і збільшення AUC симвастатинової кислоти на 31%. Збільшення експозиції симвастатину і симвастатинової кислоти не вважається клінічно значущим.
Вплив на результати аналізу на 1,5-ангідроглуцитол (1,5-AG). Моніторинг глікемічного контролю за допомогою аналізу на 1,5-AG не рекомендується, оскільки показники 1,5-AG є недостовірними для оцінки контролю глікемії у пацієнтів, які приймають іНЗКТГ2. Для моніторингу глікемічного контролю рекомендується скористатись альтернативними методами.
Діти. Дослідження взаємодії проводилися лише за участю дорослих пацієнтів.
Передозування
дапагліфлозин не продемонстрував жодних ознак токсичності у здорових учасників дослідження при пероральному застосуванні разових доз до 500 мг (в 50 разів вище максимальної рекомендованої дози для людини). У цих учасників дослідження можна було виявити глюкозу в сечі протягом дозозалежного періоду часу (не менше 5 днів для дози 500 мг) без випадків дегідратації, артеріальної гіпотензії або електролітного дисбалансу, а також без клінічно значущої дії на інтервал QTc. Частота розвитку гіпоглікемії була подібною до частоти в групі застосування плацебо. У клінічних дослідженнях, в яких застосовувалися дози до 100 мг 1 раз на добу (в 10 разів вище максимальної рекомендованої дози для людини) протягом 2 тижнів здоровим учасникам дослідження та пацієнтам з цукровим діабетом 2 типу, частота виникнення гіпоглікемії була трохи вищою, ніж у групі застосування плацебо, і не була дозозалежною. Частота побічних реакцій, включаючи дегідратацію або артеріальну гіпотензію, була подібною до частоти у групі застосування плацебо; клінічно значущі дозозалежні зміни в лабораторних показниках, включаючи рівні електролітів та біомаркерів функції нирок у сироватці крові, не відмічалися.
У випадку передозування слід розпочати відповідне підтримувальне лікування, що визначається клінічним станом пацієнта. Виведення дапагліфлозину за допомогою гемодіалізу не вивчалося.
Умови зберігання
у недоступному для дітей місці при температурі до 25 °С.