Дольковая (лобулярная) неоплазия молочной железы
Наиболее сложным в патологической анатомии является вопрос дифференциальной диагностики гиперпластических процессов, которые возникают на фоне гормональной стимуляции, прежде всего гиперэстрогении, и начальных форм РМЖ.
Дольковая неоплазия наиболее часто развивается у женщин в предменопаузальный период (в возрасте 45–47 лет) и составляет 1–3,8% всех эпителиальных патологических процессов молочной железы. В 0,5–4% материала биопсий, взятых по поводу доброкачественных заболеваний молочной железы, выявляют дольковую неоплазию разной степени дифференцировки. В 85% случаев дольковая неоплазия возникает мультицентрично и в 30–67% — билатерально.
Для лобулярной неоплазии характерна пролиферация мелкого эпителия, расположенного в просвете долек, со слабым межклеточным соединением, с педжетоидной реакцией или без нее. Происходит дольковая неоплазия из эпителия концевой (терминальной) протоково-дольковой единицы молочной железы. Выраженность атипии, степень пролиферации, количество атипических митозов зависят от степени дифференцировки неоплазии. Выделяют два типа клеток дольковой неоплазии: тип А и тип В. Тип А состоит из мономорфных эпителиальных клеток, тип В — из крупных полиморфных клеток с выраженными признаками атипии. Хотя клетки крупные, они гораздо мельче эпителия протоков.
Может быть смешанный тип, представленный сочетанием в разной пропорции клеток типа А и В.
Термины «атипическая дольковая неоплазия» и «рак in situ» используют, чтобы подчеркнуть их важное прогностическое значение и для указания степени атипии клеток в очаге поражения. Однако известны публикации, свидетельствующие об отсутствии разницы клинического течения атипической дольковой неоплазии и рака in situ, а также разницы в прогнозе дальнейшего развития на их фоне инвазивного рака [203, 204].
Согласно Классификации РМЖ ВОЗ (2003) рекомендуется пользоваться термином «дольковая неоплазия», подразделяя ее на три степени и термин «дольковый рак in situ».
Деление на степени дифференцировки дольковой неоплазии происходит в зависимости от выраженности клеточного полиморфизма, наличия некрозов, признаков атипии и количества митозов.
Легкая степень дольковой неоплазии (первая степень неоплазии) характеризуется сохранением альвеолярной архитектоники, пролиферацией в одной или нескольких дольках мелких мономорфных эпителиальных клеток, слабо сцепленных между собой (клетки типа А). Как правило, клетки в очаге пролиферации имеют округлое, нечетко отграниченное ядро и скудную цитоплазму. Некрозы, митозы и кальцинаты редки. Иногда отмечают очаги пролиферации и полиморфизма клеток, появляются скопления крупных клеток, но эти признаки представлены незначительно. В единичных дольках могут быть признаки апокриновой неоплазии (фото 3).

Фото 3. Легкая степень дольковой неоплазии. Общее строение дольки сохранено, однако количество долек значительно увеличено, отмечается выработка секрета, эпителий мелкий мономорфный. Гематоксилин-эозин, х 100
Умеренная дольковая неоплазия (вторая степень неоплазии) характеризуется нарастанием полиморфизма эпителия долек, появлением большего количества крупных клеток с неправильной формой ядра и обильной цитоплазмой, отмечают единичные митозы и отдельные перстневидные клетки. Миоэпителиальные клетки чаще располагаются вдоль базальной мембраны, но могут вытесняться из обычного места расположения и примешиваться к эпителиальному пролиферату. Базальная мембрана сохранна на всем протяжении (фото 4, 5).
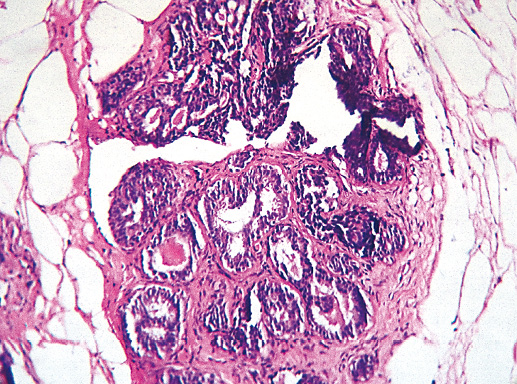
Фото 4. Умеренная степень дольковой неоплазии. Отмечается пролиферация и формирование многорядного эпителия, очаги секреции. Гематоксилин-эозин, х 200

Фото 5. Умеренная степень дольковой неоплазии. Эпителий полиморфный, формирует сосочки, миоэпителиальные клетки местами вытесняют эпителиальные. Гематоксилин-эозин, х 400
Тяжелая дольковая неоплазия (третья степень неоплазии) представлена в основном полиморфными клетками, заполняющими почти полностью просвет долек, чаще, чем в предыдущей стадии, выявляют митозы, в том числе атипические митозы, очаги некроза (фото 6). Данную дольковую неоплазию трудно дифференцировать от рака in situ. Основное отличие тяжелой дольковой неоплазии и рака in situ в том, что последний представлен малигнизированным эпителием, по клеточному составу не отличается от долькового рака и характеризуется сохранной базальной мембраной.
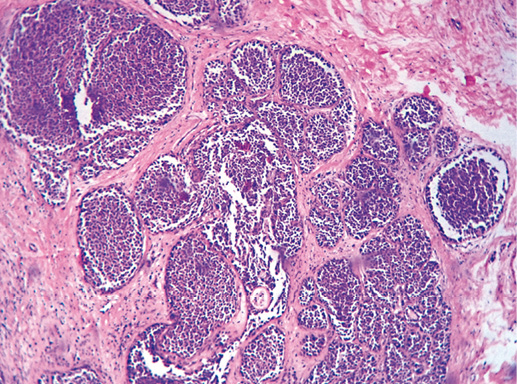
Фото 6. Тяжелая степень дольковой неоплазии. Дольки расширены, просвет полностью заполнен эпителиальными клетками. Гематоксилин-эозин, х 100

Фото 7. Дольковый рак in situ. Атипичные клетки заполняют просвет долек. Гематоксилин-эозин, х 100
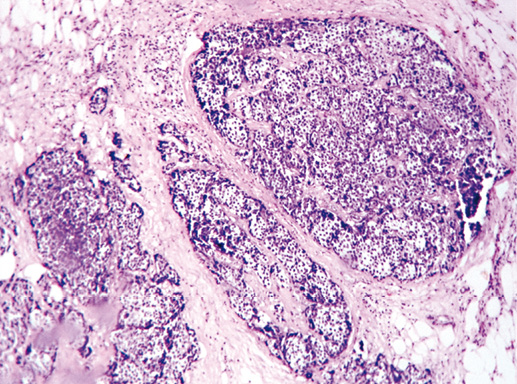
Фото 8. Дольковый рак in situ. Видны микроочаги некроза в опухолевом инфильтрате. Гематоксилин-эозин, х 100
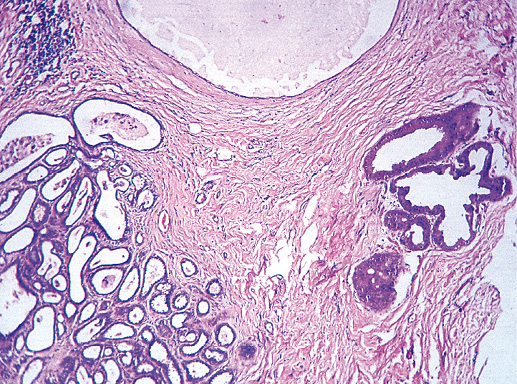
Фото 9. Простая протоковая гиперплазия. Некоторые протоки расширены в виде кист, в отдельных протоках видны признаки апокриновой секреции, однако общее строение протоков сохранено. Гематоксилин-эозин, х 100
Для описания атипической дольковой неоплазии часто используют термин «дольковый рак in situ». Все эти процессы имеют один морфологический код в Международном классификаторе онкологических заболеваний — 8520/2.
Рак in situ часто ассоциирован с микроинвазивным раком в окружающих участках, поэтому его исследование требует особой ответственности и внимания при установлении диагноза. Необходимо изучить большое количество срезов и края резекции. В сложных случаях для исключения инвазивного рака необходимо исследовать базальную мембрану для выявления ее целостности и доказать отсутствие нарушения миоэпителиального слоя и базальной мембраны.
Важным условием диагностики дольковой неоплазии является отсутствие инвазии опухолевыми клетками базальной мембраны. Для исключения инвазии применяют антитела, выявляющие коллаген IV типа и гладкомышечный актин.
Рецепторы эстрогена по данным большинства авторов и нашим наблюдениям выявляют в 60–90% случаев долькового рака in situ, а рецепторы прогестерона редко. В низкодифференцированном дольковом раке in situ может быть определена экспрессия HER2/neu и белка p53, однако это нетипично для данной патологии.
Типичным для дольковой неоплазии тяжелой степени и рака in situ является отсутствие экспрессии цитокератина СК 5/7 и E—cadherin.
Но цитокератин высокой молекулярной массы (HMW CK 34BE12) присутствует в цитоплазме клеток долькового рака in situ. Это является важным дифференциальным признаком для диагностики протокового и долькового рака.
Через довольно длительный промежуток времени у некоторых женщин на фоне рака in situ возникают инвазивные формы рака, но следует отметить, что дольковый рак in situ не обязательно является предраком инфильтративных форм.
Внутрипротоковые пролиферативные поражения
К ним относят простую протоковую гиперплазию, гиперплазию со слабо выраженной пролиферацией эпителия, атипическую протоковую гиперплазию и протоковый рак in situ (трех степеней дифференцировки).
Существуют два классификационных подхода к оценке эпителиальных пролиферативных поражений протоков. Касательно молочной железы одновременно используют две классификационные схемы.
| Традиционная терминология (классификация ВОЗ) | Терминология DIN |
|
Простая протоковая гиперплазия |
Простая протоковая гиперплазия |
|
Слабо выраженная протоковая атипия |
Протоковая интраэпителиальная неоплазия Grade1А |
|
Атипическая протоковая гиперплазия |
Протоковая интраэпителиальная неоплазия Grade1В |
|
Протоковый рак in situ Grade1 |
Протоковая интраэпителиальная неоплазия Grade1С |
|
Протоковый рак in situ Grade2 |
Протоковая интраэпителиальная неоплазия Grade2 |
|
Протоковый рак in situ Grade3 |
Протоковая интраэпителиальная неоплазия Grade3 |
Левый столбик отражает взгляды большинства экспертов ВОЗ, терминологию, представленную справа, используют преимущественно в Северной Америке.
Нам кажется, что классификация ВОЗ более отражает сущность опухолевой трансформации, кроме того эта схема более воспроизводима и более наглядна для восприятия в реальных практических условиях.
Традиционно внутрипротоковую пролиферацию разделяют на простую протоковую гиперплазию, атипическую протоковую гиперплазию и рак in situ. Однако сложилось так, что группа рак in situ оказалась гетерогенной, в нее вошли процессы, имеющие различное клиническое проявление, различную гистологическую структуру, различные биологические маркеры и генетические аномалии.
Популяционный маммологический скрининг требует выделения патологических состояний, имеющих чрезвычайно высокий риск развития инвазивного рака молочной железы. Результаты дальнейших клинических исследований показали, что различные внутрипротоковые пролиферации с различной частотой переходят в рак in situ и инвазивный рак. Так, риск развития инвазивного РМЖ из простой протоковой гиперплазия составляет 1,5%, из атипической протоковой гиперплазии 4–5% и рака in situ 8–10% [1].
Термин «интраэпителиальная неоплазия» широко используют для описания патологии не только молочной железы, но и предстательной железы, шейки матки.
При этом независимо от органа поражения очень трудно провести грань между атипической гиперплазией и раком in situ. Для этого используют особенности морфологического строения, подсчет количества митозов, наличие некрозов, но в основном признаки цитологической и тканевой атипии.
Простая (обычная) протоковая гиперплазия часто возникает на фоне мастопатии и выглядит как пролиферация эпителия с признаками некоторого полиморфизма внутри протоков. Протоки располагаются неравномерно, их размеры разные. Характерно изменение нормальной структуры протоков, формирование расширенных, неправильной формы протоков вокруг долек нормального строения. Протоки ветвятся в виде ручейков от центра участка гиперплазии к периферии. Клеточные пролифераты могут формировать солидные участки, криброзные структуры, мостики.
Клеточный состав пролифератов полиморфный. Причем необходимо отметить, что полиморфизм клеток неопухолевый. Эпителий протоков, несмотря на различный размер ядер и разную выраженность цитоплазмы, имеет зрелый вид. Полиморфизм клеток формируется за счет наличия эпителия, находящегося в функционально различном состоянии. В одном протоке могут отмечать клетки с выраженными признаками секреции (часто эти клетки находятся в центре протока), а также с признаками пролиферации (чаще возле базальной мембраны). Эпителиальные клетки могут формировать 2–4 слоя. Следует отметить, что общее строение протоков сохранено, имеется четкая базальная мембрана, слой миоэпителиальных клеток. Возможны очаги апокриновой метаплазии. Наличие такого разнообразия типов клеток является характерным для этого вида гиперплазии. Не исключается наличие микрокальцинатов и некрозов. В случаях отсутствия истинной атипии клеток эти признаки не должны склонить патолога в сторону диагноза «атипическая гиперплазия» или «рак in situ». Следует отметить, что некрозы и микрокальцинаты часто имитируют рак in situ. Решающее значение в установлении диагноза имеют цитологические признаки истинной атипии (фото 10).
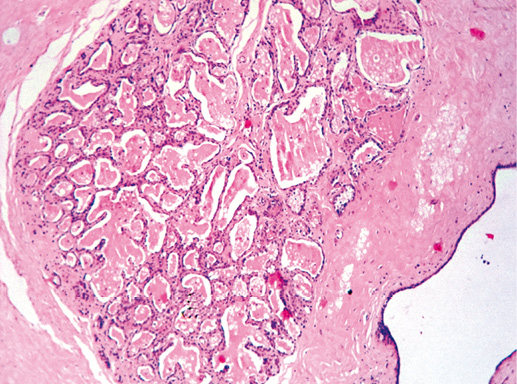
Фото 10. Простая протоковая гиперплазия. Участок апокриновой метаплазии. Гематоксилин-эозин, х 100

Фото 11. Протоковая неоплазия со слабо выраженной атипией. Гематоксилин-эозин, х 100
Критерии простой протоковой гиперплазии
Цитологические. Вариабельность форм ядер с гиперхромными округлыми и овальными ядрышками, ассиметричными нуклеолами.
Гистологические. Эпителиальные клетки имеют тенденцию к беспорядочному расположению в протоках, отмечается вариабельность расстояния между ядрами, ориентация клеток нарушена, их цитоплазма нечетко очерчена, часто выявляют секрецию.
Интерцеллюлярные расстояния отличаются по размеру и форме, часто отмечают щелеподобные структуры.
Иммуногистохимическое исследование подтверждает мозаичность различных паттернов клеток. Часть клеток экспрессирует цитокератин высокой молекулярной массы (СК HMW), таких как СК 5/10/14. Отмечается высокая экспрессия E—cadherin. Количество клеток, имеющих рецептор эстрогена, выше, чем в нормальной ткани молочной железы. Cyclin D1 выявлен в 11–19% случаев простой протоковой гиперплазии [1].
Риск развития инвазивного рака из простой протоковой гиперплазии составляет 2,6% за период наблюдения около 14 лет. Следует отметить, что такой процент инвазивного рака на фоне атипической протоковой гиперплазии формируется за 8,3 года [61]. В другом исследовании указывается, что в 4% случаев простая протоковая гиперплазия транформировалась в инвазивный РМЖ за 15 лет наблюдения [62]. Однако риск развития рака на фоне этой гиперплазии значительно ниже, чем при других вариантах гиперплазий.
Обычная протоковая гиперплазия является одним из морфологических проявлений гормональных изменений в организме женщины.
Морфофункциональные изменения, возникающие в различные периоды менструального цикла и беременности, могут симулировать обычную протоковую гиперплазию, поэтому патологоанатом должен иметь информацию о состоянии женщины, ее возрасте, наличии эндокринных и гинекологических заболеваний. Обязательно следует выдерживать сроки взятия биопсии или проведения операции в соответствии с менструальным циклом.
Протоковая неоплазия со слабо выраженной атипией
В данном варианте протоковой неоплазии по сравнению с предыдущим более выражена пролиферация эпителия, клетки формируют в протоке от 1 до 3–5 рядов, более существенно проявление атипии клеток. Папиллярные, криброзные, солидные пролифераты отсутствуют. Часто отмечают секрецию эпителия (цитоплазма клеток становится обильной светлой пенистой, ядро расположено ассиметрично, ближе к базальному краю) и секрет в просвете протоков (фото 12–14). Возможны микрокальцинаты. Морфологическая картина при этой патологии соответствует протоковой интраэпителиальной неоплазии Grade1А.
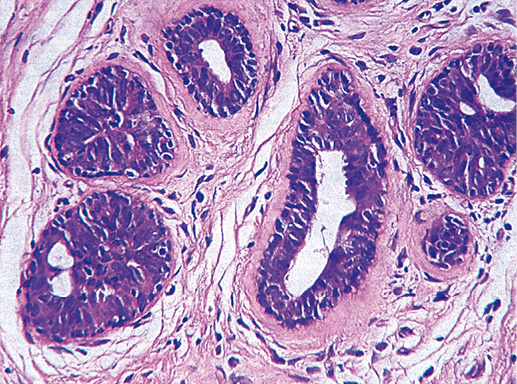
Фото 12. Протоковая неоплазия со слабо выраженной атипией. Гематоксилин-эозин, х 200

Фото 13. Протоковая неоплазия со слабо выраженной атипией. Эпителий протоков формируют микропапиллярные структуры и сосочки. Гематоксилин-эозин, х 200
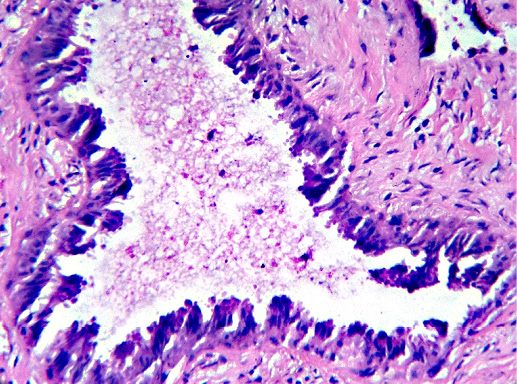
Фото 14. Атипическая протоковая гиперплазия. Эпителий протоков полиморфный с гиперхромными ядрами. Гематоксилин-эозин, х 200
Риск развития инвазивного рака на фоне простой протоковой атипии выше, чем на фоне простой протоковой гиперплазии.
Атипическая протоковая гиперплазия
Это заболевание характеризуется более выраженной пролиферацией эпителия, усилением признаков клеточного полиморфизма и появлением атипии разной степени выраженности. Заболевание характеризуется умеренным риском развития инвазивного рака молочной железы.
В протоках отмечают равномерное распределение мономорфных клеток с округлым ядром. Эпителиальные клетки формируют папиллярные структуры, солидные группы, пучки, аркады, криброзные структуры внутри протоков. Морфологическая картина соответствует протоковой интраэпителиальной неоплазии Grade1В, местами протоки похожи на рак in situ G-1. Для атипической протоковой гиперплазии обязательны участки простой протоковой гиперплазии. Для исключения рака in situ общим требованием является взятие на исследование ткани через каждый 1 мм и исследование серийных срезов гистологического блока.
Микрокальцинаты могут отсутствовать, быть представленными фокально или на большом протяжении. Это не является ведущим фактором для установления диагноза (фото 15–19).
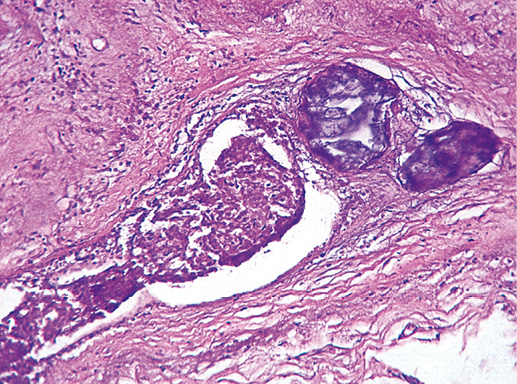
Фото 15. Атипическая протоковая гиперплазия. Некроз и кальцинаты в протоках. Гематоксилин-эозин, х 200
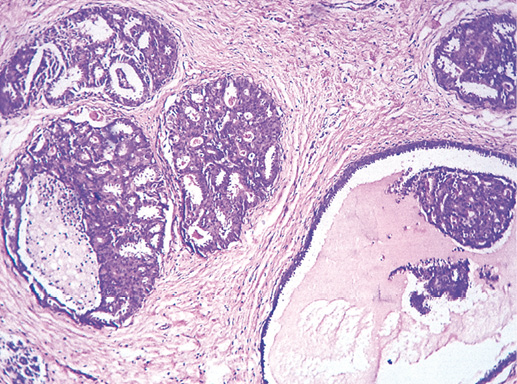
Фото 16. Атипическая протоковая гиперплазия. Эпителий протоков полиморфный с гиперхромными ядрами, формирует криброзные структуры, слева отмечается очаг некроза, во многих протоках явления секреции. Гематоксилин-эозин, х 200

Фото 17. Атипическая протоковая гиперплазия. Атипичный эпителий в протоках формирует солидные пласты, однако нет инвазии стромы. Гематоксилин-эозин, х 200

Фото 18. Тот же участок. Видны атипичные клетки с гиперхромными ядрами, нет инвазии стромы. Гематоксилин-эозин, х 400
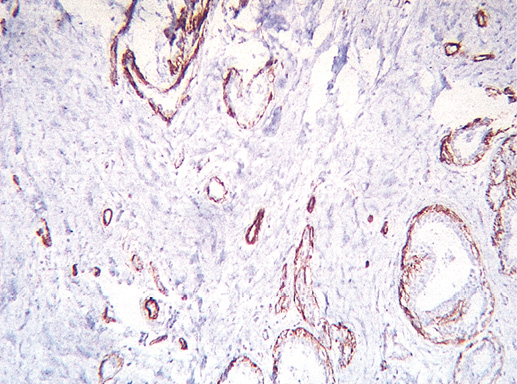
Фото 19. Экспрессия гладкомышечного актина (клон HHF35, производство DAKO). Иммуногистохимическое окрашивание, система визуализации EnVision, хромоген DAB. Миоэпителиальные клетки в виде непрерывной линии вдоль базальной мембраны. х 200
Рецепторы эстрогена и прогестерона выявляют в большом количестве клеток, белок ERBB2 экспрессируется крайне редко, экспрессия этого белка более характерна для рака in situ. Белок р53 не выявляют как в атипической протоковой гиперплазии, так и раке in situ. Однако экспрессия Cyclin D1 выявлена в 27–57% случаев атипической протоковой гиперплазии. Около 90% случаев атипической протоковой гиперплазии не имеют экспрессии цитокератина высокого молекулярного веса (СК HMW), таких как СК 5/10/14, поэтому их можно использовать для дифференциальной диагностики с простой протоковой гиперплазией [1].
Атипическая протоковая гиперплазия имеет довольно высокий риск развития инвазивного РМЖ. По данным различных авторов инвазивный рак развивается в 3,7–22% случаев атипической протоковой гиперплазии [66, 67].
Важнейшим отличительным признаком любой формы протоковой интраэпителиальной неоплазии является наличие непрерывной базальной мембраны и слоя миоэпителиальных клеток. В зависимости от степени протоковой интраэпителиальной неоплазии количество эпителиальных клеток отличается.
Наиболее важная и сложная задача патологоанатома — не пропустить инвазию опухолевыми клетками базальной мембраны. Эта задача может быть выполнена только в результате кропотливого исследования большого количества срезов, отбора наиболее подозрительных на малигнизацию участков и проведения дополнительных методов окраски базальной мембраны и миоэпителиальных клеток. Неоценимую помощь в этом оказывает иммуногистохимический метод исследования. Для маркировки миоэпителиальных клеток мы часто применяем антитела к гладкомышечному актину, которые дают четкое окрашивание, и реакция легко воспроизводима.
Внутрипротоковая папиллома
Эти образования возможны в любом месте в пределах системы протоков от соска до терминальной дольково-протоковой единицы. Бывают доброкачественные варианты (внутрипротоковая папиллома), атипические (атипическая папиллома) и злокачественные (внутрипротоковый папиллярный рак).
Среди внутрипротоковых папиллом в зависимости от локализации выделяют центральные и периферические варианты. Центральная внутрипротоковая папиллома — это одиночное образование, располагающееся, как правило, в субареолярной зоне, часто в кистозно-расширенном протоке. Периферические внутрипротоковые папилломы чаще множественные. Большинство исследователей считают, что одиночные внутрипротоковые папилломы не имеют тенденции к малигнизации. Множественные папилломы, особенно в периферических отделах дольково-протоковой системы, склонны к озлокачествлению. Большие затруднения возникают при диагностике центральных внутрипротоковых папиллом, так как они могут клинически сопровождаться кровянистыми выделениями из соска [5].
Диагностика папиллом включает обязательно маммографию, ультразвуковое исследование (УЗИ), а также цитологическое исследование выделений из соска.
Внутрипротоковая папиллома — округлое образование с четкой границей размером 3–4 см, но возможны процессы, занимающие несколько сантиметров в диаметре. Внутрипротоковая папиллома представлена сосочковыми разрастаниями, состоящими из фиброваскулярной ножки, покрытой эпителием и миоэпителием (фото 20). Часто отмечают апокринизацию эпителия [5].
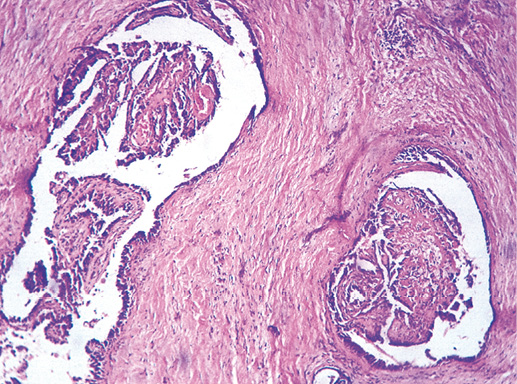
Фото 20. Внутрипротоковая папиллома. Гематоксилин-эозин, х 200
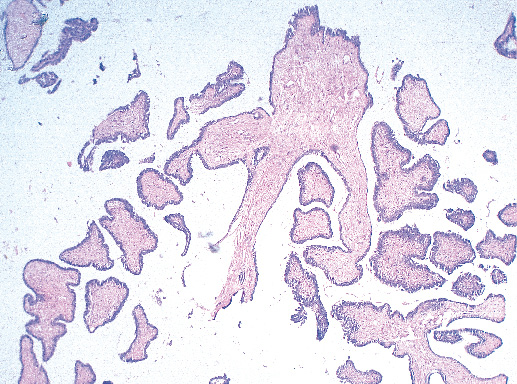
Фото 21. Внутрипротоковая папиллома. Видны отдельные сосочки с фиброзной стромой и однорядной эпителиальной выстилкой. Гематоксилин-эозин, х 200
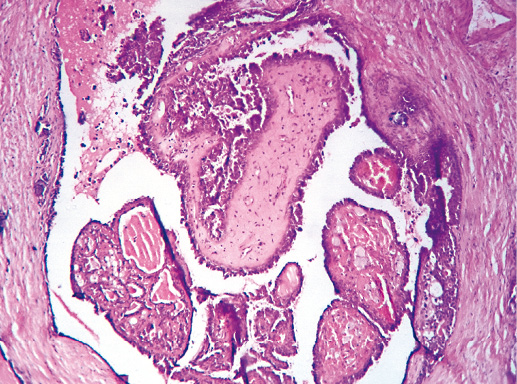
Фото 22. Периферическая внутрипротоковая папиллома. Гематоксилин-эозин, х 200
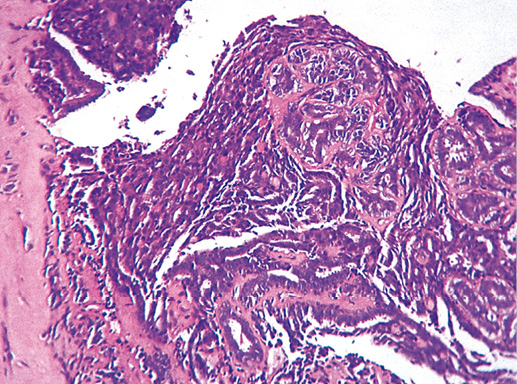
Фото 23. Атипическая внутрипротоковая папиллома. Сосочки имеют грубоволокнистую соединительнотканную основу, миоэпителиальный компонент и один или несколько слоев эпителиальных клеток с гиперхромными ядрами. Гематоксилин-эозин, х 200
Термин «папилломатоз» молочной железы эксперты ВОЗ рекомендуют избегать и использовать термин «множественные внутрипротоковые папилломы».
Все внутрипротоковые папилломы имеют общий морфологический код в Международном классификаторе онкологических заболеваний — 8503/0.
Центральная внутрипротоковая папиллома
Составляет 10% всех доброкачественных поражений молочной железы. Чаще выявляют у женщин среднего возраста (40–50 лет). Пальпаторные поражения — это округлые образования с четко ограниченными контурами, имеется связь с расширенным крупным протоком. Пункционная биопсия позволяет получить серозное содержимое. Размер, как правило, большой, от 3–4 мм до нескольких сантиметров.
Гистологическое строение центральной и периферической внутрипротоковой папилломы одинаковое. Однако, учитывая большие размеры центральной папилломы, в ней можно отметить участки двух видов: протоковый и папиллярный. Папиллярные образования представлены фиброваскулярной ножкой, покрытой двумя слоями эпителия. Протоковый компонент имеет строение описанных выше протоковых гиперплазий. Опухоли, в которых преобладает протоковый компонент и склероз стромы, обычно называют «склерозирующая папиллома».
В центральных внутрипротоковых папилломах могут быть представлены участки пролиферации миоэпителия, апокринизация эпителия, плоскоклеточная, хрящевая и костная метаплазия, внутрипротоковая пролиферация эпителия, воспалительная инфильтрация. Отсутствие клеточной атипии, инвазии стромы позволит диагностировать центральную внутрипротоковую папиллому. Особенно кропотливой работы требуют папилломы с участками, имитирующими микроинвазию. Большую помощь в таких случаях оказывает иммуногистохимическое исследование компонентов базальной мембраны и миоэпителия. Чаще для этих целей применяют антитела, выявляющие коллаген IV типа и гладкомышечный актин.
Периферическая внутрипротоковая папиллома
В отличие от центральной внутрипротоковой папилломы, эта опухоль развивается у женщин более молодого возраста. Клиническое течение чаще протекает скрыто. Большие размеры папиллом могут пальпироваться. Маммография выявляет чаще множественные узловые образования с четкими контурами, возможны микрокальцинаты.
Характерный мультицентричный рост периферической внутрипротоковой папилломы может быть на фоне внутрипротоковой гиперплазии, карциномы in situ или инвазивного рака.
Термин «микропапиллома» применяют к малым формам периферической внутрипротоковой папилломы. Часто микропапилломы выявляют в больших фокусах аденоза молочной железы.
Атипическая внутрипротоковая папиллома
Эта форма внутрипротоковой папилломы выделена из-за ее важного прогностического значения, поскольку именно на фоне атипической внутрипротоковой папилломы чаще возникают инвазивные карциномы.
В отличие от описанных выше папиллом, атипическая внутрипротоковая папиллома характеризуется ядерной атипией, часто многорядностью эпителия, наличием солидных участков с некрозами, могут быть небольшие участки высокодифференцированной карциномы in situ. Если участки рака в папилломе значительные (до 90% площади), то к этой опухоли применим термин «внутрипротоковый папиллярный рак». Характерной особенностью этого рака является отсутствие инвазии опухолевых клеток через базальную мембрану в окружающую строму. Кроме исследования большого количества срезов опухоли, исключить очаги инвазии помогает имуногистохимическое исследование с антителами к коллагену IV типа и гладкомышечному актину, а также отсутствие лимфогистиоцитарной инфильтрации в строме вокруг папилломы.
Внутрипротоковый папиллярный рак лишен (почти на всем протяжении) миоэпителиального клеточного слоя и характеризуется пролиферацией атипичного эпителия (фото 24). Часто бывает мультицентричный рост.
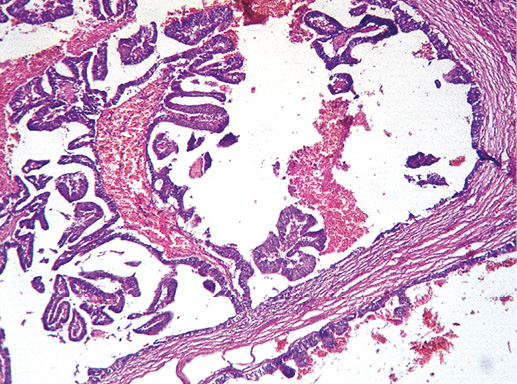
Фото 24. Внутрипротоковый папиллярный рак. Часть сосочков не имеет соединительной ткани в своей основе и состоит из атипичных эпителиальных клеток. Гематоксилин-эозин, х 400
Эта опухоль имеет свой морфологический код в Международном классификаторе онкологических заболеваний — 8503/2.